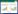文章信息
- 谈艳芳,刘福慧,何应中,黄俊琼. 2015.
- TAN Yanfang, LIU Fuhui, HE Yingzhong, HUANG Junqiong. 2015.
- RPL8基因修饰的树突状细胞对胶质瘤的免疫治疗作用
- Anti-glioma Effect of Dendritic Cells Modified by RPL8 Gene
- 肿瘤防治研究, 2015, 42(01): 19-22
- Cancer Research on Prevention and Treatment, 2015, 42(02): 19-22
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.01.005
-
文章历史
- 收稿日期:2014-01-23
- 修回日期:2014-04-26
树突状细胞(dendritic cell,DC)是目前已知的抗原提呈功能最强的细胞,可以激活初始的T细胞。将肿瘤抗原、细胞因子等基因导入树突状细胞可增强其对T细胞的免疫激活作用,增强特异性抗肿瘤免疫应答。本实验通过重组腺病毒将RPL8基因导入DC,制成RPL8基因修饰的DC,注入胶质瘤荷瘤小鼠体内,探讨RPL8基因修饰的DC对荷瘤小鼠的免疫治疗作用,为胶质瘤的免疫治疗提供新的思路。1 材料与方法1.1 材料
重组小鼠 粒细胞-巨噬细胞 集落刺激因子(rmGM-CSF)和重组小鼠白细胞介素4(rmIL-4)购于R&D公司;胎牛血清、RPMI 1640、DMEM/F12使用Hclone公司产品。GL261胶质瘤细胞、重组腺病毒Adxsi-EGFP-RPL8(Ad-RPL8)由本室保存。C57BL/6小鼠购自第三军医大学大坪医院实验动物中心。1.2 小鼠骨髓来源DC的分离培养
脱颈处死C57BL/6小鼠,无菌剥离股骨、胫骨及肱骨,用无菌PBS液反复冲洗髓腔,冲洗液用200钼钢网过滤。收集骨髓细胞,加入0.84%TrisNH4Cl裂解红细胞,PBS洗涤2次,用含rmGMCSF、rmIL-4的RPMI 1640培养液重悬细胞。第6天加入LPS(200 ng/ml)刺激细胞成熟。1.3 RPL8基因修饰DC的制备
收集培养到第8天的DC,加入MOI150的重组腺病毒Ad-RPL8及对照腺病毒Ad(带EGFP),置于37℃、5%CO2培养箱中培养2 h,感染结束后,洗去残余的病毒液,加入完全培养液继续培养。荧光显微镜观察DC内绿色荧光,观察病毒是否转染成功。收集细胞(即DC-RPL8),RT-PCR分析细胞中RPL8 mRNA表达。1.4 RPL8修饰DC诱导T细胞杀伤效应
常规培养胶质瘤细胞,将细胞密度调节至1×105/ml,加入96孔板中,每孔100 μl,培养24 h。实验分为3组:(1)PBS组:PBS+DC;(2)Ad组:Ad感染DC;(3)Ad-RPL8组:Ad-RPL8感染DC。
感染后DC与T细胞以1:3比例混匀在培养箱内培养72 h。分别按效靶比为10:1、20:1、30:1加入培养于96孔板的GL261胶质瘤细胞中,每组设3个复孔。培养48 h后,每孔加入5 mg/ml MTT各20 μl,继续培养4 h,加入100 μl DMSO,570 nm波长处测定各组的OD值。T细胞对肿瘤细胞的杀伤效应用抑制率表示,抑制率=[靶细胞对照组A值-(实验组A值-效应细胞对照组A值)]/(靶细胞对照组A值)×100%。1.5 RPL8基因修饰DC对胶质瘤的免疫效应
将GL261细胞培养传代,调整细胞浓度为1×107/ml,将细胞悬液接种于C57BL/6小鼠右前腋下,每只0.2 ml(2×106个细胞),隔天观察肿瘤的生长情况,一般5天后可在注射部位摸到米粒样大小的包块,即为荷瘤模型。荷瘤5天后,尾静脉注射RPL8基因修饰DC,每只200 μl。同时设空载体对照和PBS对照,每组5只。每周1次,共3次,每隔3天观察肿瘤体积变化及小鼠的生存情况,取瘤体进行石蜡包埋、病理切片、HE染色。1.6 统计学方法
采用SPSS 13.0软件包进行统计分析,各组数据以x±s表示,采用单因素方差分析,P<0.05为差异有统计学意义。2 结果2.1 荧光显微镜观察RPL8基因修饰的DC
DC经重组腺病毒感染后,培养初期可见较多的小而圆形贴壁细胞,随着培养时间的延长,细胞形态明显改变,继而出现集落样的生长,表面伸出典型的树枝样突起。重组病毒Ad-RPL8和空载病毒(Ad)感染DC后,细胞内可见绿色荧光,表明腺病毒成功感染DC,见图 1。
|
| A: morphological character of dendritic cells(DCs); B: DCs infected by pAd-RPL8 图 1 重组腺病毒感染后的树突状细胞(×200) Figure 1 DCs infected by recombinant adenovirus (×200) |
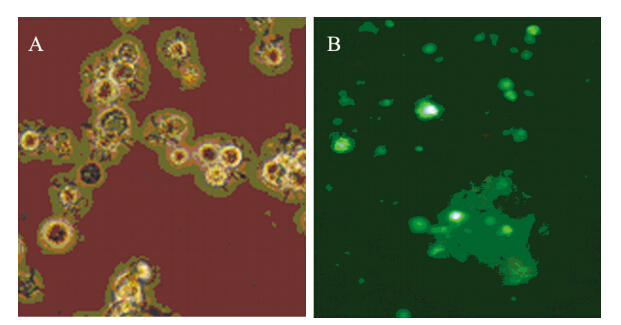
收集重组腺病毒感染后DC,提取细胞RNA,RT-PCR扩增出大小约309 bp的特异性条带,见图 2。
|
| M: marker; 1-2: Ad-RPL8; 3: Ad图 2 RT-PCR分析树突状细胞中RPL8 mRNA的表达 Figure 2 RPL8 mRNA expression in DCs detected by RTPCR |
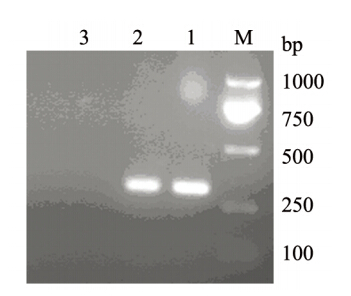
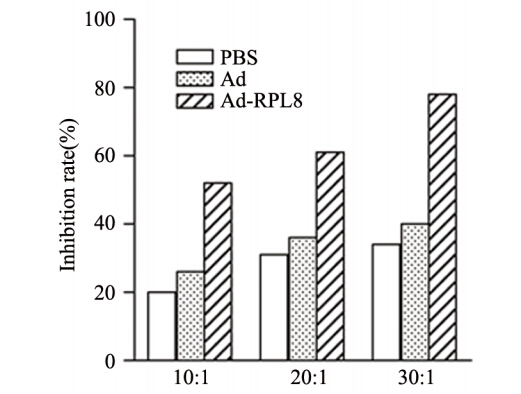
当效靶比为30:1时,Ad-RPL8感染DC激活T细胞对GL261细胞的抑制效率最高为78%,Ad感染DC体外刺激T细胞对GL261细胞的抑制率为49%,PBS组对GL261细胞的抑制率为43%。RPL8基因修饰DC诱导的T细胞杀伤效应与Ad组、PBS组比较差异有统计学意义(P<0.01),Ad组与PBS组比较差异无统计学意义(P>0.05),见图 3。
|
| 图 3 RPL8基因修饰树突状细胞诱导的T细胞杀伤效应 Figure 3 Cytotoxic effect of T cells induced by DC modified by RPL8 gene |
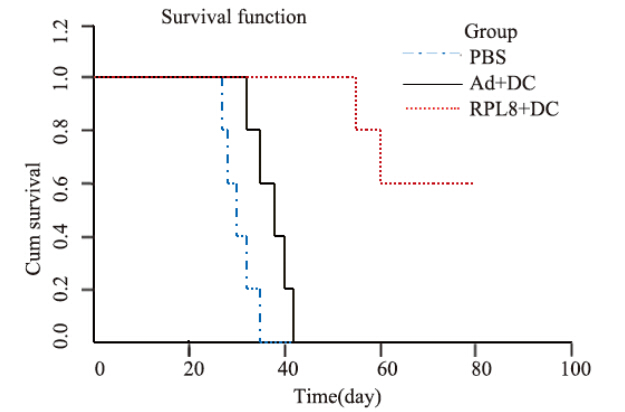
C57BL/6小鼠腋下皮下接种GL261细胞5天后,所有小鼠的接种部位均出现直径0.2~0.3 cm大小的肿瘤结节。尾静脉注射DC-RPL8 200 μl后,PBS组和Ad组荷瘤小鼠出现进食减少,精神萎靡,逐渐死亡。RPL8基因修饰DC组荷瘤小鼠的肿瘤体积明显小于Ad组与PBS组(P<0.01),见表 1。经RPL8基因修饰DC治疗的小鼠的生存期明显延长,2只小鼠肿瘤生长缓慢,分别存活55天和60天,其余小鼠的肿瘤逐渐消失,实验结束90天后仍然存活,而Ad组和PBS组肿瘤生长快,瘤体表面出现大小不等的糜烂、出血,35天左右死亡,见图 4。
 |
|
| 图 4 各组荷瘤鼠的生存时间 Figure 4 Thesurvival time of tumor-bearing mice |
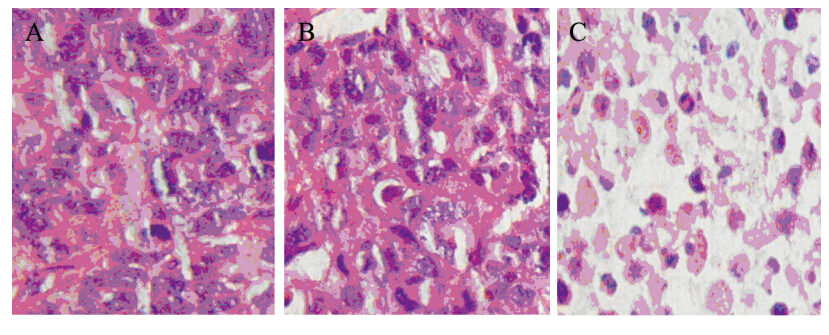
RPL8基因修饰DC组荷瘤小鼠肿瘤组织经HE染色,可见肿瘤细胞肿胀、坏死、崩解较多,胞核淡染,在肿瘤细胞间及瘤组织间质内可见有大量的淋巴细胞浸润,出现大片的溶解、坏死灶。PBS组和Ad组可见核异质性明显,核大而深染,呈浸润性生长,细胞排列紊乱,淋巴细胞浸润少,见图 5。
|
| A: PBS group. Nuclear marked heterogeneity,large nuclei and deep staining,cells arranged in disorder; B: Ad group:DCs infected by Ad. Nuclear marked heterogeneity,large and hyperchromatic nucleus,showing invasive growth; C: Ad-RPL8 group: DCs infected by Ad-RPL8. Tissue interstitial lymphocytes,dissolve and focal necrosis图 5 各组荷瘤小鼠肿瘤组织病理学检查结果(HE ×200)Figure 5 Pathological examination of mice tumor tissues (HE ×200) |
随着分子生物学和免疫学研究的不断深入,肿瘤的免疫治疗已成为继手术、化疗、放疗后发展起来的第四种疗法。树突状细胞是机体免疫应答反应的重要细胞,是唯一能直接激活初始T细胞的抗原提呈细胞,在抗肿瘤免疫应答的启动及调控中起着极其关键的作用[1,2,3]。DC表面富含MHC-Ⅰ、Ⅱ类分子,与抗原肽结合后免疫小鼠可激活CD4+T和CD8+T细胞,诱导产生特异性抗肿瘤细胞免疫和体液免疫以抑制肿瘤细胞的生长[4,5]。研究较多的DC疫苗主要包括肿瘤抗原肽致敏的DC及肿瘤抗原基因修饰的DC等[6,7]。利用腺病毒将肿瘤抗原基因导入DC,可使抗原在细胞内稳定表达,并具有安全无不良反应等特点[8]。但目前研究的DC疫苗要达到较高的肿瘤治愈率尚有相当的距离,究其原因可能主要是这些DC疫苗诱导抗肿瘤免疫的能力,特别是诱导细胞毒性(CTL)反应的能力还不稳定,而这种不稳定则主要与肿瘤抗原的选择有关。
最近研究发现,RPL8高表达于黑色素瘤和胶质瘤等,RPL8能被CD4+HLA-DR7限制性Th细胞识别,可刺激HLA-DR7+黑色素瘤患者外周血单个核细胞增殖并表达细胞因子[9]。通过分子结构扫描分析,RPL8可能包含其他能与HLA-Ⅰ类分子(A1、A 2、A24、B7、B44、B51)结合的表位,提示RPL8可作为肿瘤抗原用于RPL8阳性肿瘤患者的治疗。本实验采用重组腺病毒Ad-RPL8感染小鼠骨髓来源DC,观察RPL8基因修饰的DC在体外诱导T细胞对靶细胞的杀伤效应,以及在体内对胶质瘤的免疫治疗作用。RPL8基因修饰的DC在荷瘤小鼠体内能抑制肿瘤生长,小鼠生存期明显延长,PBS组、Ad组小鼠在35天左右死亡,而RPL8修饰的DC组在60天后仍有50%存活。体外实验发现,RPL8基因修饰的DC能激活T细胞,抑制GL261胶质瘤细胞的生长,表明RPL8基因修饰的DC可诱导小鼠产生抗肿瘤免疫反应。该实验结果可为胶质瘤的免疫治疗提供新的思路。
| [1] | Son CH, Bae JH, Shin DY, et al. Ctla-4 blockade enhances antitumor immunity of intratumoral injection of immature dendritic cells into irradiated tumor in a mouse colon cancer model[J]. J Immunother, 2014, 37(1): 1-7. |
| [2] | Wallet MA, Sen P, Tish R, et al. Immunoregulation of dendritics cells[J]. Clin Med Res, 2005, 3(3): 166-75. |
| [3] | Tel J, Sittig SP, Blom RA, et al. Targeting uptake receptors on human plasmacytoid dendritic cells triggers antigen crosspresentation and robust type Ⅰ IFN secretion[J]. J Immunol, 2013, 191(10): 5005-12. |
| [4] | Lauterbach H, P?tzold J, Kassub R, et al. Genetic adjuvantation of recombinant MVA with CD40L potentiates CD8 T cell mediated immunity[J]. Front Immunol, 2013, 4: 251. |
| [5] | Chen J, Guo XZ, Li HY, et al. Generation of CTL responses against pancreatic cancer in vitro using dendritic cells cotransfected with MUC4 and survivin RNA[J]. Vaccine, 2013, 31(41): 4585-90. |
| [6] | Zang XJ, Dong J, Wu ZL, et al. Antitumor effect of DCs vaccine modified by HSP70 peptide complex purified from mouse pancreatic carcinoma cells(MPC-83) in vivo[J]. Zhongguo Mian Yi Xue Za Zhi, 2009, 25(9): 792-6.[张哓娟, 董坚, 吴振林, 等. HSP70多肽复合物修饰DCs疫苗抗胰腺癌荷瘤小鼠的实验研究[J]. 中国免疫学杂志, 2009, 25(9): 792-6.] |
| [7] | Terando A, Roessler B, Mulé JJ. Chemokine gene modification of human dendrtic cell-based tumor vaccines using a recombinant adenoviral vector[J]. Cancer Gene Ther, 2004, 11(3): 165-73. |
| [8] | Felizardo TC, Wang JC, McGray RA, et al. Differential immune responses mediated by adenovirus- and lentivirus-transduced DCs in a HER-2/neu overexpressing tumor model[J]. Gene Ther, 2011, 18(10): 986-95. |
| [9] | Swoboda RK, Somasundaram R, Caputo L, et al. Shared MHC class Ⅱ-dependent melanoma ribosomal protein L8 identified by phage display[J]. Cancer Res, 2007, 67(8): 3555-9. |
 2014, Vol. 42
2014, Vol. 42