文章信息
- 李晓玉,何斐,叶超,蔡琳. 2014.
- LI Xiaoyu, HE Fei,YE Chao,CAI Lin. 2014.
- DNA双链断裂修复基因遗传多态性与非小细胞肺癌预后的相关性
- Association between DNA Double-strand Break Repair Gene Polymorphisms and Prognosis of Non-small Cell Lung Cancer Patients
- 肿瘤防治研究, 2014, 41(09): 1014-1020
- Cancer Research on Prevention and Treatment, 2014, 41(09): 1014-1020
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.013
-
文章历史
- 收稿日期:2013-07-12
- 修回日期:2013-08-26
肺癌是当今全球发病率和死亡率均很高的一 种恶性肿瘤,非小细胞肺癌(NSCLC)占原发性 支气管肺癌发病数的80%以上,居恶性肿瘤死因 首位[1]。目前,肺癌的5年生存率仍低于15%[1], 具有相同临床特征的不同个体在预后结局等方面 常存在较大差异[2,3,4,5,6]。DNA双链断裂修复(double strand breaks repair,DSBR)基因对保持细胞和机 体的存活起着至关重要的作用[4],DNA修复基因的 多态性可改变基因的表达和活性,影响个体损伤 DNA的修复能力,从而影响肿瘤患者的疗效和预 后。DSBR基因遗传多态性显著影响肺癌的发病风 险[7,8],但与生存结局的关联研究甚少。本课题组 前期探讨了DSBR基因的rs6869366、rs1056503、 rs3734091、rs861539、rs861537、rs1799794、 rs16942、rs144848、rs1805794、rs2735383与肺癌 易感性的关联[7,9],本研究将进一步探讨其多态性 与NSCLC预后的关联,为临床诊治和患者预后评 估提供参考。 1 资料与方法 1.1 病例资料
收集福建医科大学附属第一医院、福建医科 大学附属协和医院、南京军区福州总院2006年12 月至2010年1月NSCLC病例679例。纳入标准: (1)经纤维支气管镜或手术取得组织病理、脱落 细胞学确诊的NSCLC病例;(2)原发性NSCLC 新发病例;(3)确诊时未经历过化疗或放射治 疗者;(4)在福建本地居住10年以上。排除标 准:(1)继发性肺癌患者;(2)病情危重或不 能清晰回答问题者;(3)不愿配合问卷调查者; (4)不愿提供联系方式、身份证号码及不愿配 合随访的患者。对每位新发病例在治疗前采用 EDTA-2K抗凝管采集外周静脉血5 ml,2 000 r/min 离心10 min,分装后置-80℃超低温冰箱冻存。本 研究通过了福建医科大学伦理委员会审批,研究 对象均签署了书面知情同意书。 1.2 随访
患者的一般人口学资料、肿瘤临床资料、治 疗情况、吸烟史等信息采用统一编制的调查表, 由经过统一培训的调查员面访、查阅病案资料收 集。病例确诊后每半年随访一次,随访截止日期 为2013年5月10日,中位随访期为27月(0~77月)。 采用电话随访为主,通过电话随访与患者或其家 属交流,进一步核实患者生存状态及临床治疗 信息。如果出现无法接通、关机、电话欠费等情 况,间隔数天继续电话随访,三次无法联系到患 者或其家属则通过省疾控死亡登记系统或患者身 份证号码到公安局查证患者的生存结局,查不到 者根据末次电话随访到的时间,或病案室收集到 的末次出院时间作为其截止时间。 1.3 标签SNP的选择
应用HapMap计划(http://www.hapmap.org/) 的通用基因组浏览器(HapMap Genome Browser) 获得中国人群SNP基因型数据,运行Haploview 4.2 软件,设置最小等位基因频率(MAF)的界值为 0.10,r2>0.8,选择具有潜在功能SNPs进行分析。 1.4 基因分型
采用DNAzol试剂(北京百泰克生物技术有 限公司产品)提取基因组DNA,紫外分光光度 法(OD260/OD280比值)测定DNA的纯度,OD260测定 DNA的浓度。应用TaqMan探针基因分型技术和 ABI-7500荧光定量PCR仪进行rs3734091的基因分 型,基因分型检测试剂盒(包含引物和探针)购 于ABI公司。PCR反应体系为10 ng DNA/10 μl,反 应条件:95℃预变性10 min,95℃变性15 s,60℃ 退火复性1 min,共40个循环。根据PCR扩增后荧 光信号的种类判断基因型。采用聚合酶链反应-限 制性片段长度多态性(PCR-RFLP)技术进行其余 9个位点的基因分型,引物由上海生工生物工程有 限公司设计合成。PCR反应体系均为25 μl,其中 模板DNA 1 μl,上下游引物各1 μl(10 μmol/L), ddH2O 9.5 μl,PCR MIX(北京天根科技有限公 司)12.5 μl。PCR反应条件:94℃预变性5 min, 94℃变性30 s,55℃(58℃)退火30 s和72℃延 伸30 s,35个循环后72℃延伸10 min。取酶切产 物10 μl经琼脂糖凝胶电泳,分析基因型。 1.5 质量控制
流行病学调查采用统一制定的工作手册,培 训调查人员,统一方法和标准。所有调查表由专 人编码,并在复核无误后用Epidata3.1软件进行独 立双录入计算机。实验过程遵循实验操作规范, 防止污染和错误编号。基因检测采用盲法并随机 抽取10%的样本进行复测。 1.6 统计学方法
数据录入与分析分别采用EpiData 3.2和SPSS 18.0软件。χ2检验分析基因型频率分布差异, Kaplan-Meier法估计5年生存率和中位生存时间 (MST)。Log rank检验比较不同组间总生存 (OS)的差异。OS为确诊之日起到死亡或末次随 访的时间。采用Cox比例风险模型进行预后影响 因素的单因素分析和多因素分析,计算调整HR和 95%CI。统计学检验均为双侧概率检验,以P<0.05 为差异有统计学意义。 2 结果 2.1 患者的一般特征及总体生存的单因素分析
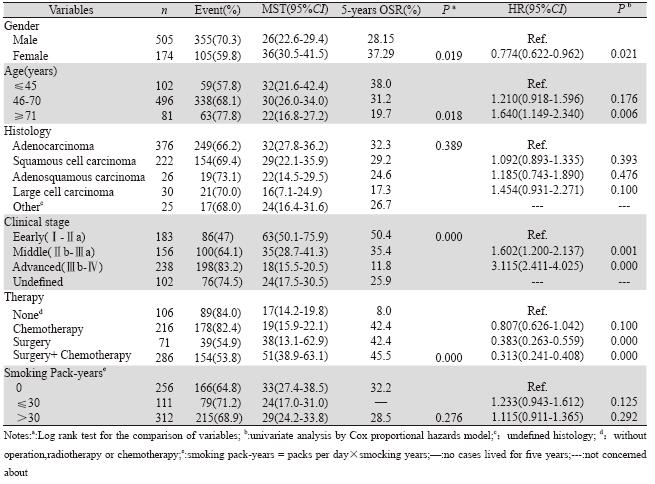
NSCLC 患者共679 例,其中男505 例,占 74.37%,女174例,占25.63%,男女比为:2.9:1; 最小年龄23岁,最大年龄85岁,平均年龄(58± 11.14)岁。存活219例,占32.3%;死亡460例, 占67.7%;随访成功563例,占82.92%;失访者 与未失访者的年龄、性别、临床分期、病理类 型、治疗情况等指标的比较差异无统计学意义 (P>0.05)。患者5年总生存率是29.8%(95%CI: 26.1~33.5)。单因素分析结果显示,性别、年 龄、临床分期、治疗情况与OS有显著关联(P <0.05),见表 1。
 |
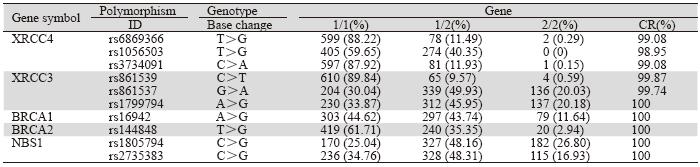
XRCC3、XRCC4、BRCA1、BRCA2、NBS1 基因10个位点的基因型分布见表 2,基因分型成功 率(CR)>98.95%,各基因型分布经检验均符合 Hardy-Weinberg平衡。
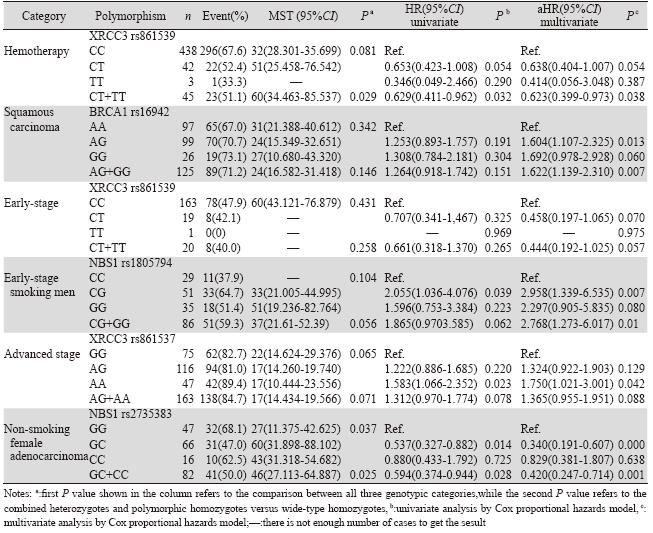
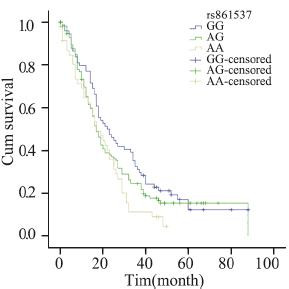
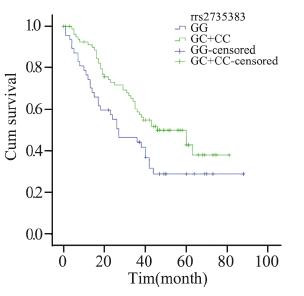
分层分析显示,在化疗的病例中,携带XRCC3 rs861539 CT+TT基因型比携带CC基因型的死亡 风险降低(MST:32月 vs. 60月;HR=0.629, 95%CI:0.411~0.962,P=0.032;aHR=0.623, 95%CI:0.399~0.973,P=0.038)。鳞癌患者携 带BRCA1 rs16942 AG+GG基因型较携带AA基因 型者预后差(MST:24月vs. 31月;aHR=1.622, 95%CI:1.139~2.310,P=0.007);在临床早期病 例中,携带XRCC3 rs861539 CT+TT基因型较携带 CC基因型的死亡风险降低(aHR=0.444,95%CI: 0.192~1.025,P=0.057),男性吸烟的早期病例携 带NBS1 rs1805794 CG+GG基因型比CC基因型的 死亡风险高(aHR=2.768,95%CI:1.273~6.017, P=0.010)。临床晚期病例携带XRCC3 rs861537 A A 基因型较携带G G 基因型的死亡风险高 (aHR=1.750,95%CI:1.021~3.001,P=0.042)。 非吸烟女性腺癌患者携带NBS1 rs2735383 GC+CC 基因型较携带GG基因型的死亡风险低(MST:41 月 vs. 32月;aHR=0.420,95%CI:0.247~0.714, P=0.001),见表 3,图 1~6。
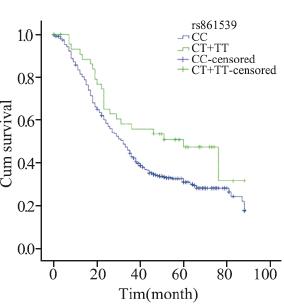
|
| 图 1 rs861539基因多态NSCLC化疗患者Kaplan-Meier生存曲线 Figure 1 Kaplan-Meier overall survival curves of NSCLC patients with rs861539 polymorphism after chemotherapy |
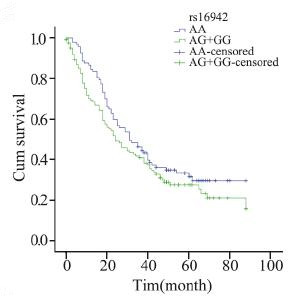
|
| 图 2 rs16942基因多态肺鳞癌患者Kaplan-Meier生存曲线 Figure 2 Kaplan-Meier overall survival curves of squamous cell carcinomas patients with rs16942 polymorphism |
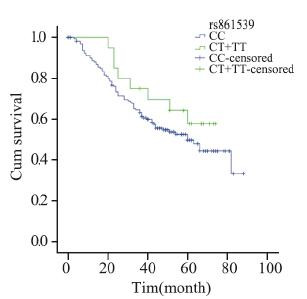
|
| 图 3 rs861539基因多态临床早期NSCLC患者Kaplan-Meier生存曲线 Figure 3 Kaplan-Meier overall survival curves of early-stage NSCLC patients with rs861539 polymorphism |
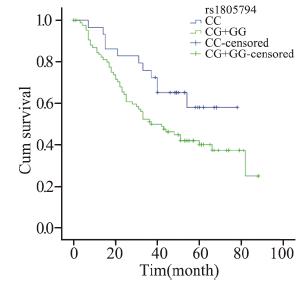
|
| 图 4 rs1805794基因多态男性吸烟临床早期NSCLC患者Kaplan-Meier生存曲线 Figure 4 Kaplan-Meier overall survival curves of smoking male early-stage NSCLC patients with rs1805794 polymorphism |
|
| 图 5 rs861537基因多态晚期NSCLC患者Kaplan-Meier生存曲线 Figure 5 Kaplan-Meier overall survival curves of advanced NSCLC patients with rs861537 polymorphism |
|
| 图 6 rs2735383基因多态女性非吸烟肺腺癌患者Kaplan-Meier生存曲线 Figure 6 Kaplan-Meier overall survival curves of non-smoking female adenocarcinoma patients with rs2735383 polymorphism |
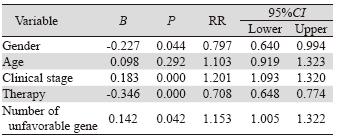
根据上述分析结果,XRCC3 rs861539 CC、rs861537 AG/AA、BRCA1 rs16942 AG/GG、NBS1 rs1805794 CG/GG、rs2735383 GG基因型为不利基 因型(unfavorable genotype),携带不利基因型 患者的预后较差。把携带不利基因型数分组(≤3 个;4个;5个)评价其联合效应,并把单因素分 析中对生存期有影响的因素(性别、年龄、临床 分期、治疗方式)纳入Cox比例风险回归模型进行 多因素分析。结果显示性别、病理类型、临床分 期、治疗情况、携有不利基因数是NSCLC预后的 独立危险因素,见表 4。
DNA修复基因多态性与肺癌易感性的关系被 广泛研究,而与肺癌患者生存结局的关联作用才 开始被关注。目前,DNA双链断裂修复通路与肺癌预后的关系研究较少,且结果不一致。本研究 探讨了5个DNA双链断裂修复基因10个位点多态 性及不利基因联合作用与NSCLC预后的关系。 结果显示DSBR基因位点rs861539、rs861537、 rs16942、rs1805794和rs2735383与NSCLC患者的 OS显著关联。
XRCC3蛋白不仅参与碱基切除修复,也是 DNA双链断裂同源重组(HR)路径的关键酶,参 与因电离辐射和氧自由基等诱导的DNA双链断裂 修复。本研究发现在化疗、临床早期的NSCLC患 者中,携带XRCC3第241位密码子(rs861539 , C>T,Thr to Met)的 CT+TT基因型比携带CC基因 型死亡风险低。这与许多学者的研究结论一致, 有学者报道在用顺铂/吉西他滨治疗的NSCLC患 者中,Met等位基因是预后较好的决定因素[10,11]。 Matullo等[12]认为该SNP与健康者外周血白细胞的 高水平加合物相关,推测Met的转变能降低DNA的 修复能力(DRC),提高化疗患者对药物的敏感 度,从而提高化疗患者的预后。DRC是一把双刃 剑,对于未化疗的其他病例,DRC能力的降低会 增加死亡风险,如Butkiewicz等[2]对术后NSCLC预 后研究中发现241Met/Met基因型显著增加总体死 亡风险,认为XRCC3 rs168539 T/T( Met/Met)基因 型可作为化疗NSCLC患者较易存活的生物标志。
rs1805794多态性是错义突变(Glu185Gln),位 于乳腺癌羧基末端(BRCT)结构域,该结构域 可促进NBS1与BRCA1相互作用,并形成BRCA-1 相关基因监视复合物(BASC),该复合物负责 识别并修复受损DNA[13,14],Glu185Gln转变可干 扰蛋白与蛋白间的相互作用从而影响DNA修复 能力。最近一项Meta分析阐明了rs1805794多态 性与多种癌症的发生有关联[15],然而很少研究报 道此多态性与肺癌预后的关系。欧洲学者对258 例经铂/5-氟尿嘧啶/甲酰四氢叶酸化疗的食管癌 和胃腺癌进行研究,未发现rs1805794与上述两 种癌症的复发和OS相关。Xu等[16]研究NBS1基因 rs1805794多态性与147例化疗的晚期NSCLC患者 临床结局关系,未发现早期NSCLC患者rs1805794 与肺癌预后相关,但发现其与无进展生存期 (PFS)具有显著关联:携带rs1805794 CC或CG 基因型比GG具有更长的PFS(CC/CG vs. GG: aHR=0.62,95%CI:0.39~0.99;CC vs. CG/GG: aHR=0.56,95%CI:0.32~0.97 )。我们的研究发 现了rs1805794 C>G与早期NSCLC患者的预后相 关。早期病例携带CG+GG基因型比CC基因型的 死亡风险高(aHR=2.768,95%CI:1.273~6.017, P=0.010),可能与rs1805794 G等位基因比野生 型C等位基因更能降低MRN(MRE11/RAD50/ NBS1)复合物的水平有关,从而降低DNA的修复 能力影响预后。
BRCA1是一种抑癌基因,其表达的蛋白具 有重要的生物学功能,可影响DNA损伤修复、细 胞周期调节、基因转录调节等。BRCA1与MRN (MRE1/RAD50/NBS1)复合物相互作用,共同 参与DNA双链断裂修复。本研究结果显示,鳞癌 患者携带BRCA1 rs16942 AG+GG等位基因型较携 带AA基因型的预后更差(aHR=1.622,95%CI: 1.139~2.310,P=0.007),提示鳞癌患者较易出 现A>G的突变,从而提高BRCA1mRNA的表达, 增加死亡风险。许多研究表明BRCA1 mRNA的过 表达与NSCLC预后的关联:Rosell等[17]对126例手 术切除患者的研究发现,BRCA1 mRNA过表达可 导致较差的预后。该研究还显示BRCA1 mRNA 的表达在鳞癌患者中显著高于腺癌患者,这与我 们的研究结果一致。目前对于吸烟与肺癌预后的 关联仍然存在争议。一些研究认为吸烟可导致更 差的生存[18,19],也有研究发现吸烟与肺癌预后无 存在关联[20]。本研究虽未发现吸烟与否及吸烟量 与NSCLC预后存在关联,但联合DSBR基因分析 发现,临床早期的吸烟男性携带NBS1 rs1805794 突变基因CG+GG预后较差。而非吸烟女性腺癌 中携有NBS1 rs2735383突变基因GC+CC生存结 局较好。研究显示NBS1 rs1805794基因多态性与 吸烟存在交互作用[7],Kawai等[21]发现吸烟缩短 男性肺癌患者生存。研究报道XRCC3 rs861537、 NBS1rs2735383多态性与肿瘤发病危险性有关,包 括肺癌、乳腺癌、膀胱癌、直肠癌等[22],然而, 较少研究他们与肺癌预后的关系。本研究发现 XRCC3 rs861537、NBS1 rs2735383、rs1805794与 晚期、早期吸烟男性NSCLC患者、非吸烟女性肺 腺癌患者的预后相关,但因分层后样本量较少, 此结果还须在更大样本量人群中进行验证。
国内外有关DNA修复基因多态性相关的生物 标志物与肺癌预后的研究结果尚不一致,需考虑 可能的影响:(1)肿瘤患者的预后涉及多阶段、 多基因通路,单独的任何一种基因多态性不可能 对生存结局产生巨大的效应,因此,基于通路的 联合分析和研究、评估通路中相互影响的多态性 的联合效应很重要。(2)肿瘤细胞可发生多种体 细胞突变,如SNPs、微卫星、插入和(或)缺失突 变、拷贝数变异(CNVs),非整倍体和杂合子丢 失、这些都可导致肿瘤的增长和侵袭等,DNA修 复通路的单系变异在NSCLC的肿瘤表型和临床结 局上不大可能产生广泛的效应[23]。 (3)需较大 的人群样本量,尤其在进行分层分析时。本研究 发现XRCC3、BRCA1、NBS1基因多态性位点与NSCLC预后相关,有可能作为NSCLC患者预后的 参考生物标志物,但其结论仍需更大的队列研究 和功能验证。
| [1] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J].CACancer J Clin,2009,59(4):225-49. |
| [2] | Butkiewicz D, Rusin M, Sikora B, et al. An associationbetween DNA repair gene polymorphisms and survival inpatients with resected non-small cell lung cancer[J]. Mol BiolRep,2011,38(8):5231-41. |
| [3] | Kim M, Kang HG, Lee SY, et al. Comprehensive analysis of DNArepair gene polymorphisms and survival in patients with earlystage non-small-cell lung cancer[J]. Cancer Sci,2010,101(11):2436-42. |
| [4] | Wu W, Li H, Wang H, et al. Effect of polymorphisms in XPD onclinical outcomes of platinum-based chemotherapy for Chinesenon-small cell lung cancer patients[J]. PLoS One,2012,7(3):e33200. |
| [5] | Sun Z, Chen J, Aakre J, et al. Genetic variation in glutathionemetabolism and DNA repair genes predicts survival of small-celllung cancer patients[J]. Ann Oncol,2010,21(10):2011-6. |
| [6] | Brundage MD, Davies D, Mackillop WJ. Prognostic factors in nonsmallcell lung cancer: a decade of progress[J]. Chest,2002,122(3):1037-57. |
| [7] | Fan LH,Chen JL,Cai L. Study on the association betweenDNA double-strand break repair gene NBS1 polymorphisms andsusceptibility on lung cancer[J].Zhonghua Liu Xing Bing Xue ZaZhi,2010,31(2):213-7.[樊丽辉, 陈俊磊, 蔡琳. DNA双链断裂修复基因NBS1多态性与肺癌易感性的关联研究[J]. 中华流行病学杂志,2010,31(2):213-7.] |
| [8] | Qian B, Zhang H, Zhang L, et al. Association of geneticpolymorphisms in DNA repair pathway genes with non-small celllung cancer risk[J].Lung Cancer,2011, 73(2):138-46. |
| [9] | Chen X,Fan LH,Qiu YF, et al.Association of the polymorphisms inDNA double-strand break repair gene XRCC4 with susceptibilityof lung cancer[J].Zhong Liu, 2010,10(30):852-9.[陈星,樊丽辉,邱月锋,等.DNA双链断裂修复基因XRCC4多态性与肺癌易感性的关系[J].肿瘤,2010,10(30):852-9.] |
| [10] | Improta G, Sgambato A, Bianchino G, et al. Polymorphismsof the DNA repair genes XRCC1 and XRCC3 and risk of lungand colorectal cancer: a case-control study in a Southern Italianpopulation[J]. Anticancer Res,2008, 28(5B):2941-6. |
| [11] | Ren S, Zhou S, Wu F, et al. Association between polymorphismsof DNA repair genes and survival of advanced NSCLC patientstreated with platinum-based chemotherapy[J]. Lung Cancer,2012,75(1):102-9. |
| [12] | Matullo G, Dunning AM, Guarrera S, et al.DNA repairpolymorphisms and cancer risk in non-smokers in a cohortstudy[J]. Carcinogenesis,2006, 27(5):997-1007. |
| [13] | Wang Y, Cortez D, Yazdi P, et al. BASC, a super complex ofBRCA1-associated proteins involved in the recognition and repairof aberrant DNA structures[J]. Genes Dev,2000, 14(8):927-39. |
| [14] | Futaki M, Liu JM. Chromosomal breakage syndromes and theBRCA1 genome surveillance complex[J]. Trends Mol Med,2001,7(12):560-5. |
| [15] | Lu M, Lu J, Yang X, et al.Association between the NBS1E185Q polymorphism and cancer risk: a meta-analysis[J]. BMCCancer,2009,9:124. |
| [16] | Xu JL, Hu LM, Huang MD, et al. Genetic variants of NBS1predict clinical outcome of platinum-based chemotherapy inadvanced non-small cell lung cancer in Chinese[J]. Asian Pac JCancer Prev,2012, 13(3):851-6. |
| [17] | Rosell R, Skrzypski M, Jassem E, et al. BRCA1: a novelprognostic factor in resected non-small-cell lung cancer[J]. PLoSOne,2007, 2(11):e1129. |
| [18] | Nakamura H, Haruki T, Adachi Y, et al. Smoking affects prognosisafter lung cancer surgery[J]. Surg Today,2008, 38(3):227-31. |
| [19] | Sardari Nia P, Weyler J, Colpaert C,et al. Prognostic value ofsmoking status in operated non-small cell lung cancer[J]. LungCancer,2005, 47(3):351-9. |
| [20] | Baser S, Shannon VR, Eapen GA, et al.Smoking cessation afterdiagnosis of lung cancer is associated with a beneficial effect onperformance status[J]. Chest,2006, 130(6):1784-90. |
| [21] | Kawai H, Tada A, Kawahara M, et al. Smoking history beforesurgery and prognosis in patients with stage IA non-smallcelllung cancer-a multicenter study[J]. Lung Cancer,2005,49(1):63-70. |
| [22] | Park SL, Bastani D, Goldstein BY, et al. Associations betweenNBS1 polymorphisms, haplotypes and smoking-related cancers[J].Carcinogenesis,2010, 31(7):1264-71. |
| [23] | Manuguerra M, Matullo G, Veglia F,et al. Multi-factordimensionality reduction applied to a large prospectiveinvestigation on gene-gene and gene-environment interactions[J].Carcinogenesis,2007, 28(2):414-22. |
 2014, Vol. 41
2014, Vol. 41