文章信息
- 徐红艳,李向柯,王亚楠,王峰,杨子长,孙燕,樊青霞. 2014.
- XU Hongyan, LI Xiangke, WANG Ya'nan, WANG Feng, YANG Zichang, SUN Yan, FAN Qingxia. 2014.
- 缺氧微环境中Bcl-2干扰对食管癌Ec9706细胞血管生成拟态的影响
- Effects of Bcl-2 Interference on Esophageal Cancer Cell Ec9706 Vasculogenic Mimicry in Hypoxic Microenvironment
- 肿瘤防治研究, 2014, 41(9): 981-984
- Cancer Research on Prevention and Treatment, 2014, 41(9): 981-984
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.006
-
文章历史
- 收稿日期:2013-08-28
- 修回日期:2014-03-24
食管癌全球年新发病约为48万余例,年死亡 40多万例,中国食管癌粗发病率和粗死亡率均居 世界第1位,发病世标率第6位,死亡世标率位于 第12位[1]。Maniotis等[2]首次在高侵袭性葡萄膜黑色素瘤中发现血管生成拟态(vasculogenic mimicry, VM),后相继在肝癌、乳腺癌 [3]、结直肠癌 [4]、肾 透明细胞癌[5]、食管癌 [6]等肿瘤中均发现存在VM 现象,并证实VM形成与肿瘤转移、侵袭、不良预 后明显正相关。已有研究表明缺氧能促进食管癌 VM形成,但其确切机制尚不清楚,Bcl-2介导的 VE-cad过表达可能促进黑色素瘤VM形成。本实 验拟通过在常氧和缺氧微环境下常规培养食管癌 细胞,三维培养观察管道结构形成情况,同时采 用Bcl-2干扰技术,探究其与VM形成相关因子VEcad和MMP-2的联系,探讨食管癌VM形成的可能 机制。 1 材料和方法 1.1 材料
人食管鳞癌细胞株Ec9706为郑州大学肿瘤 中心保存。二氯化钴购自Sig ma公司,胎牛血 清和DMEM培养液购自Gib co公司;基质胶购 自Becton Dickinson公司;Bcl-2-siRNA由上海 英俊生物技术有限公司构建;LipofectamineTM 2000(Invitrogen)、Trizol、反转录酶试剂盒、PCR 试剂盒(全式金)、DNA Marker购自全式金;鼠 抗人血管内皮钙黏蛋白(VE-cad)抗体、鼠抗人抗 凋亡蛋白(Bcl-2)抗体、鼠抗人基质金属蛋白酶 2(MMP2)抗体、鼠抗人β-actin抗体、兔抗鼠二 抗购自Sigma公司;彩色预染标准分子量蛋白购自 Genview。凋亡试剂盒购自南京凯基;标准蛋白浓 度测定试剂盒购自碧云天。 1.2 方法 1.2.1 细胞培养
Ec9706细胞用含10%胎牛血清 的1640培养液,于37℃、5%Co2培养箱中培养。 平均2~3 d传代1次,以保持细胞呈对数生长。 1.2.2 缺氧处理
化学缺氧剂CoCl2用于模拟肿瘤 内缺氧微环境,加入培养液的终浓度是75 μmol/L。 1.2.3 实验分组
本实验分四组,常规环境培养下 的细胞设为常氧对照组,缺氧环境中直接培养的 细胞设为缺氧对照组,缺氧环境中进行载体干扰 的细胞设为缺氧实验组,缺氧环境中进行空载体 干扰的细胞设为缺氧空载体组。 1.2.4 Bcl- 2 - s iRNA转染细胞
取对数生长期 Ec9706细胞4×105个,接种于培养皿中,培养于不 含抗生素的DMEM培养液中,细胞生长至约80% 聚合时开始转染,具体步骤参照Lipofectamine2000 说明书。转染后24 h按1:12的比例传代,48 h后用 含3 μg/ml Blasticidin (筛选浓度在转染前通过杀 伤曲线确定) 的选择性培养液进行筛选,约4周 后挑取克隆在选择性培养液中继续传代,扩大培 养。阴性对照质粒也按相同的办法进行转染。 PCR和Western blot法鉴定并检测单克隆细胞株的 转染效率。 1.2.5 三维培养观察管道结构形成情况
将冻存 的Matrigel原液置于4℃过夜使之溶解,24孔培养 板每孔加入300 μl Matrigel原液,轻轻摇动使之分 布均匀,37℃培养箱内孵育30 min待其凝固。每孔 接种单细胞悬液1ml,浓度为5×105/ml,分别置于 常氧和缺氧条件下继续培养。24 h后终止培养,观 察各组细胞的管状结构排列情况及完整程度。随 机于倒置显微镜下取上、下、左、右、中心5个视 野摄像记录并计数管状结构数量,取每个视野的 均值。实验重复三次。 1.2.6 细胞凋亡检测
干扰前后的细胞以5×105/孔 浓度接种于6孔板内,待细胞长至单层铺满后,用 不含EDTA的胰酶消化后收集细胞,加入染色液 Annexin V-EGFP及Propidium Iodide,作用15 min 后,于流式细胞仪上检测细胞凋亡情况。 1.2.7 RT-PCR检测血管生成拟态相关基因Bcl-2、 VE- cad及MMP2的mRNA表达情况
将处理后 的各组细胞用TRI zol一步法提取总RNA。引物 由上海生工生物有限公司设计并合成,β- actin 上游引物为CTGGGACGACATGGAGAAAA下 游引物为AAGGAAGGCTGGAAGAGTGC, 扩 增片 段 为5 6 4 b p;B c l - 2上 游 引物T G G G A G A A C A G G G T A C G AT A A C,下 游 引 物 是G A A C T C A A A G A A G G C C A C A AT C, 扩 增 片 段 为4 4 8 b p;V E - c a d上 游 引 物 为 A G G A C ATA A C A C C A C G A A A C G,下 游 引 物 为C G G T C A A A C T G C C C ATA C T T, 扩 增 片 段 为1 2 1 b p;M M P 2的 上 游 引 物 为 TACTGGATCTACTCAGCCAGCA,下游引物 为CTTCAGGTAATAGGCACCCTTG,扩增片段 为300 bp。按照反转录试剂盒进行反转录合成 cDNA,并按扩增试剂盒说明书进行扩增,扩增产 物在1%琼脂糖凝胶电泳中以100 V稳压电泳1 h, 进行凝胶成像摄片并分析结果。 1.2.8 Western blot检测血管生成拟态相关基因VEcad、Bcl-2蛋白表达
细胞长至铺满培养瓶时,裂 解细胞并收集上清液于EP管中。采用BCA法测蛋 白浓度。余蛋白加热变性后于−20℃保存备用。制 胶上样,100 V稳压电泳2 h。100 V恒压1 h进行冰 浴电转至PVDF膜上,封闭液封闭1 h后TBST 10 min ×3次。加入一抗(bcl-2 1:1 000,VE-cad 1:1 000, MMP 21:1 000,β-actin 1:2 000),4℃封闭孵育过夜。次日TBST漂洗10 min×3次后,加入HRP标记 的二抗(1:2 000)孵育2 h后TBST漂洗。ECL化学 发光法显色,曝光,分析结果。 1.3 统计学方法
应用统计软件SPSS13.0进行数据处理,所得 数据以x±s表示。Tanon Gis软件对感光胶片条带进 行灰度值扫描,目的条带与内参条带的比值代表 目的基因蛋白的表达水平。多组样本均数的比较 采用单因素方差分析,两组样本均数的比较采用t 检验,以P<0.05为差异有统计学意义。 2 结果 2.1 三维培养体系观察各实验组结果
缺氧对照组(21.2±2.2)比常氧对照组(3.9±1.1) 形成更多的网络样管状结构(P<0.000);而在缺氧 下进行Bcl-2-siRNA干扰的实验组(2.5±1.2)网络样 管腔结构比缺氧对照组(21.2±2.2)和空载体组(19.9 ±2.1)显著减少(P<0.000);而缺氧对照组和空载体 组之间差异无统计学意义(P=0.051),见图 1。

|
| A:normoxia control group;B:hypoxia control group;C:hypoxia empty vector group;D:hypoxia experimental group 图 1 三维培养观察各组细胞管腔样结构形成能力(荧光倒置显微镜 ×200) Figure 1 Luminal-like structures forming ability of cells in each group in three-dimensional culture (Inverted fluorescence microscope ×200) |
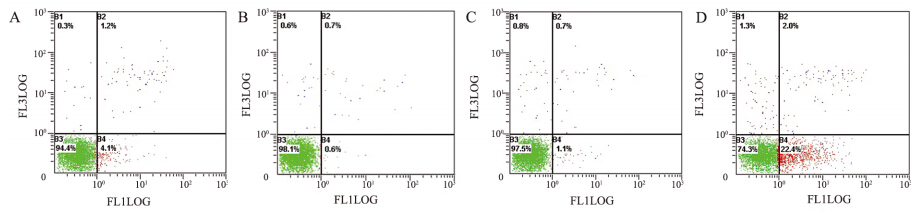
常氧对照组、缺氧对照组、缺氧空载体组和 缺氧实验组细胞的凋亡率分别为(6.17±0.17)、(0.6 ±0.12)、(1.2±0.12)和(22.63±0.37),缺氧对照组 细胞凋亡率明显低于常氧对照组(P<0.05), 缺氧实验组细胞凋亡率显著强于缺氧对照组(P <0.05),见图 2。
|
| A:normoxia control group; B:hypoxia control group; C:hypoxia empty vector group; D:hypoxia experimental group 图 2 流式细胞术检测各组细胞凋亡率 Figure 2 Apoptosis rate in each group detected by flow cytometry |
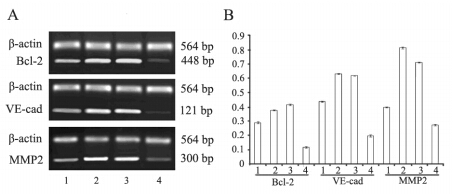
缺氧对照组Bcl-2,VE-cad的mRNA表达情 况均明显高于常氧对照组(P<0.05),缺氧实 验组Bcl-2,VE-cad,MMP2的表达明显降低(P <0.05)。缺氧对照组和缺氧空载体组之间差异无 统计学意义(P>0.05),见图 3。
|
| 1:normoxia control group;2:hypoxia control group;3:hypoxia empty vector group; 4:hypoxia experimental group 图 3 RT- PCR检测不同实验组细胞Bcl- 2、VE- ca d和 MMP2的mRNA表达情况(A)和表达灰度值(B) Figure 3 mRNA expression of Bcl- 2,VE- cad and MMP2(A)and gray value of Bcl-2,VE-cad,MMP2 mRNA expression(B)in different experimental groups detected by RT-PCR |
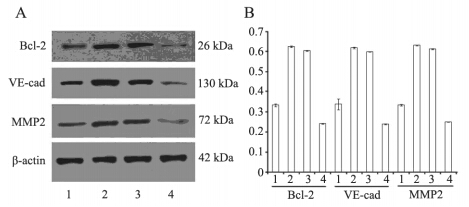
缺氧对照组Bcl-2、VE-cad的蛋白表达情况均 明显高于常氧对照组(P<0.05),缺氧实验组 Bcl-2、VE-cad、MMP2的表达较缺氧对照组明显 降低(P<0.05),缺氧对照组和缺氧空载体组之 间差异无统计学意义(P>0.05),见图 4。
|
| 1:normoxia control group;2:hypoxia control group;3:hypoxia empty vector group;4:hypoxia experimental group 图 4 Western blot法检测各组细胞Bcl-2、VE-cad、MMP2 的蛋白表达情况(A)及各蛋白表达灰度值(B) Figure 4 Prot ein expression of Bcl- 2,VE- cad and MMP2(A) and grayscale scanning(B) detected by Western blot |
食管癌的预后差与血液供应有极大的关系, 以往的治疗主要集中在内皮性血管生成上。然而 其血液供应不仅仅依赖于内皮性血管生成,血管 生成拟态发挥着同样重要的作用。血管生成拟态 的分子机制极其复杂,已有学者证明缺氧能诱导 胶质瘤、恶性黑色素瘤及肝癌细胞的血管生成拟 态,引起血管生成拟态相关分子的高表达[7]。缺氧 亦能诱导食管癌细胞血管生成拟态的形成,并诱 导肿瘤组织对放疗、化疗的耐受性,导致肿瘤生 长、侵袭和转移。Zhao等研究了乳腺癌中,在缺氧 微环境下,Bcl-2高表达促进了VE-cad的高表达, 并由此介导了更多管状结构的形成,以及VM相关 蛋白的高表达 [8]。
VE-cad是广泛表达于内皮细胞的黏合蛋白, 能促进细胞-细胞间的相互作用[9],是内皮细胞黏 附的主要组分,施瑞华等证实VE-cad下调可以抑 制血管生成拟态的形成,并抑制细胞增殖促进细 胞凋亡[10]。Bcl-2是抗凋亡蛋白家族的重要成员之 一,可以和Bax相互作用控制细胞死亡,也可以作 为载体促进转录因子迁移至细胞核内,引起相关 分子的表达甚至高表达[11]。但在我们的研究中, 推测Bcl-2可充当促转录因子来调节VM相关分子 VE-cad表达的上调[12],并由此介导食管癌细胞血 管生成拟态的形成。在本研究中,我们采用RNA 干扰技术沉默Bcl-2的表达,并检测干扰前后细胞 的表达情况。数据表明,缺氧后Bcl-2表达的上调 引起VE-cad表达的上调,同时形成更多的网络样 管状结构,并诱导细胞增殖,降低凋亡率。同时 数据也表明,在缺氧环境中,Bcl-2-siRNA下调 Bcl-2的表达后,VE-cad的表达几乎消失,VM结 构及形态也几近消失,凋亡也明显增多,VM的相 关蛋白的表达也显著降低。
我们研究证实在缺氧微环境中,Bcl-2可能激 活VE-cad的转录调节启动子,介导VE-cad的过表 达,并促进更多VM结构的形成。这可能是缺氧诱 导VM形成的分子机制[13]。这一研究发现为VM形 成的分子机制提供新的视角,可用于寻找新的抗 肿瘤血管生成的药物。
| [1] | Zhang SW, Zhang M, Li GL,et al. An analysis of incidence and mortality of esophageal cancer in China, 2003-2007[J]. Zhongguo Zhong Liu,2012,21(4):241-7.[张思维,张敏,李光 琳,等.2003~2007年中国食管癌发病与死亡分析[J].中国肿 瘤,2012,21(4):241-7.] |
| [2] | Maniotis AJ, Folberg R, Hess A, et al. Vascular channel formation by human melanomoa cells in vivo and in vitro: vasculogenic mimicry[J].Am J Pathol,1999,155(3):739-52. |
| [3] | Guzman G, Cotler SJ, Lin AY, et al. A pilot study of vasculogenic mimicry immunohistoche mical expression in hepatocellular carcinoma[J].Arch Pathol Lab Med,2007,131(12):1776-81. |
| [4] | Baeten CI, Hillen F, Pauwels P, et al. Prognostic role of vasculogenic mimicry in colorectal cancer[J]. Dis Colon Rectum, 2009,52(12):2028-35. |
| [5] | Clemente M, Pérez-Alenza MD, Illera JC, et al. Histological,immunohistological and ultrastructural description of vasculogenic mimicry in canine mammary cancer[J].Vet Pathol,2010,47(2):265-74. |
| [6] | Liu F, Niu J. Investigation of vacuole membrane proteins 1 and relations with carcinomas[J].Zhong Liu Fang Zhi Yan Jiu,2013,40(1):102-4.[刘芬,牛昀.空泡膜蛋白1及其与肿瘤关系的研究进展[J].肿瘤防治研究,2013,40(1):102-4.] |
| [7] | Zhao J,Huang JS,Yang AJ,et al.Three-dimensional cell culture and hustology of vasculogenic mimicry in heatocellular carcinoma[J]. Ai Zheng,2007,26(2):123-6.[赵静,黄江生,杨爱军,等.肝细 胞癌中血管生成拟态的三维细胞培养及细胞学研究[J] .癌 症,2007,26(2):123-6.] |
| [8] | Zhao N,Sun BC,Sun T,et al. Hypoxia-induced vasculogenic mimicry formation via VE-cadherin regulation by Bcl-2[J]. Med Oncol,2012,29(5):3599-607. |
| [9] | Rezaei M, Friedrich K, Wielockx B, et al. Interplay between neural-cadherin and vasular endothelial-cadherin in breast cancer progression[J].Breast Cancer Res, 2012,14(6):R154. |
| [10] | Wang L, Shi RH, Wang P, et al. Effect of down-regulation of vascular endothelial-cadherin on vasculogenic mimicry, proliferation and apoptosis of esophageal squamous carcinoma cells[J]. Wei Chang Bing Xue,2012,17(5):260-5.[王璐,施瑞华,王 频等.血管内皮钙黏附素下调对食管鳞癌细胞血管生成拟态、 增殖和凋亡的影响[J].胃肠病学,2012,17(5):260-5.] |
| [11] | Liu Y, Shen Y, Qin C, et al. Growth inhibition and apoptosis of human B-cell lymphoma in vitro and in vivo by Bcl-2 short hairpin RNA[J]. Oncol Rep,2013,29(1):244-52. |
| [12] | Dong Z, Venkatachalam MA, Wang J, et al. Up-regulation of apoptosis inhibitory protein IAP-2 by hypoxia. Hif-1-independent mechanisms[J]. J Biol Chem,2001,276(22):18702-9. |
| [13] | Fan YZ, Sun W. Molecular regulation of vasculogenic mimicry in tumors and potential tumor-target therapy[J]. World J Gastrointest Surg,2010,2(4): 117-27. |
 2014, Vol. 41
2014, Vol. 41
