文章信息
- 郭丽娟,郑岩,刘鹏飞,王恩彤. 2014.
- GUO Lijuan, ZHENG Yan, LIU Pengfei, WANG Entong. 2014.
- 替沃扎尼抑制甲状腺癌细胞和血管内皮细胞的增殖
- Tivozanib Inhibits Proliferation of Thyroid Cancer Cells and Vascular Endothelial Cells
- 肿瘤防治研究, 2014, 41(9): 976-980
- Cancer Research on Prevention and Treatment, 2014, 41(9): 976-980
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.005
-
文章历史
- 收稿日期:2013-09-09
- 修回日期:2014-01-22
2. 空军总医院耳鼻咽喉头颈外科
2. Department of Otolaryngology-Head and Neck Surgery, Air Force General Hospital
甲状腺癌为常见恶性肿瘤,近20年来其发生 率明显增加[1]。多数甲状腺癌系分化型,治疗效果 及预后较好,虽然甲状腺癌中的髓样癌或未分化 癌所占比例较小,但属难治性甲状腺癌,临床治 疗效果和预后极差,其中位生存时间仅约5月,1年生存率不足20% [2],因此人们对此类难治性甲状 腺癌期待能有更有效的治疗手段。分子靶向治疗是 一种颇具应用前景的新型肿瘤治疗手段[3]。血管生 成(angiogenesis)为肿瘤生长、侵袭和转移的重要 基础,抑制肿瘤的血管生成则成为抗肿瘤治疗的另 一重要途径[4, 5]。一些分子靶向药物可作用于癌细胞 及血管内皮细胞(vascular endothelial cells,VEC), 血管内皮生长因子及其受体(vascular endothelial growth factor receptors,VEGFR)则成为控制肿 瘤生长和肿瘤血管生成的重要生物作用靶点[6]。 VEGFR在许多肿瘤包括甲状腺癌呈过度表达[7], 可促使肿瘤的生长及其血管生成。因此,通过对 肿瘤细胞和VEGFR的靶向抑制作用可以抑制肿瘤 的生长及其血管生成[4, 5, 6]。
近几年来,各种酪氨酸激酶抑制剂(tyrosine kanise inhibitors,TKI)被广泛用于抗肿瘤治疗[8, 9]及 各种甲状腺癌的治疗[10, 11]。替沃扎尼(tivozanib) 为一种新型小分子TKI,可高选择性地靶向作用于 VEGFR [12],已被用于治疗一些肿瘤的Ⅱ、Ⅲ期临床 实验,并收到一定的治疗效果[13],但尚未见有关其 对甲状腺癌作用影响的文献报告。本研究观察了 替沃扎尼对甲状腺未分化癌细胞株SW579和VEC 生长增殖的影响及其作用机制,结果显示替沃扎 尼通过细胞周期休止作用抑制细胞的增殖,提示 替沃扎尼作为一种新型的分子靶向药物有可能通 过抑制甲状腺癌细胞和VEC的生长增殖及肿瘤的 血管生成而发挥其抗肿瘤作用。 1 材料与方法 1.1 主要材料
L - 1 5培 养 液 ( 北 京 钮 因 华 信 公 司 ) , RPMI1640培养液和胎牛血清(美国Hyclone公 司),人未分化型甲状腺癌细胞珠SW579(中国 科学院上海生命科学研究院),人脐静脉内皮细 胞珠HUVEC(中国医学科学院肿瘤研究所)。替 沃扎尼(美国Selleck Chemicals公司),细胞活度 测定试剂盒(CCK-8)(日本Dojindo公司),结 合FITC的抗α微管蛋白鼠单克隆抗体(美国Sigma 公司),细胞周期试剂盒(美国BD公司), FACSCalibur流式细胞仪(美国BD 公司)。 1.2 细胞培养
SW579和HUVEC分别以L-15培养液(100%空 气、37℃)和RPMI1640培养液(5%CO2、37℃) 培养,培养液含10%胎牛血清、100 u/ml青霉素和 100 μg/ml链霉素。细胞经传代培养、液氮冻存备 用。每次实验前将细胞复苏、培养,以一定的细 胞密度接种于96孔板或细胞培养皿用于实验。所 有实验均采用同一代细胞。 1.3 CCK-8法测定细胞活度
将SW579和HUVEC分别培养于96孔板24 h 后,暴露不同浓度的替沃扎尼(1、2、4、8和16 μM),未接受替沃扎尼处理(0 μM)的细胞作 为对照。每种处理置3个复孔。在细胞培养的0、 24、48和72 h,按CCK-8试剂盒说明,通过分光光 度仪测定450 nm吸光度。绘制细胞增殖曲线,估 计细胞半数抑制浓度(IC50)。 1.4 图像系统观察分析细胞增殖情况[14]
将SW579和HUVEC培养24 h后,暴露于各自 IC50的替沃扎尼(分别为4 μM和8 μM),在细胞 培养的0、24、48和72 h,通过图像分析系统采用 连续视野照相,留取同一视野不同时点的系列细 胞图像。分别计数每个视野的细胞数并得到细胞 密度(细胞数/cm2),计算各组细胞每个时点的平均 细胞密度,绘制细胞密度曲线。 1.5 免疫荧光染色及细胞分裂指数测定评价细胞 增殖能力[14]
将SW579和HUVEC培养24 h后,暴露于各自 IC50的替沃扎尼,在细胞培养的24和48 h,细胞以 4%甲醛溶液固定15 min,0.1%三硝基甲苯溶液透化 3 min,以结合有FITC的抗α-微管蛋白抗体(稀释度 1∶100)和1 μg/ml碘化丙啶孵育1 h,进行细胞微 管及细胞分裂纺锤体和DNA染色,荧光显微镜下 连续视野观察计数分裂期和间期细胞,计数细胞 > 1 000个,然后计算细胞分裂指数(mitosis index, MI),MI=(分裂期细胞数/总细胞数)×100%。 1.6 流式细胞仪分析细胞周期[14]
将SW579和HUVEC培养24 h后,暴露于各自 IC50的替沃扎尼,在细胞培养的24和48 h,按细胞 周期分析试剂盒说明,收集细胞(每管>1×106个 细胞),细胞以75%乙醇固定1 h,PBS漂洗后用 含RNA酶(20 μg/ml)及碘化丙啶(20 μg/ml)的 测试缓冲液孵育30 min,通过流式细胞仪进行细胞 DNA 含量及细胞周期时相分析。 1.7 统计学方法
应用SPSS 16.0统计软件进行统计学分析。各 项数据均来自2~3次独立的实验。计量资料以均数 ±标准差表示。两组间均数采用t检验,多组间均 数比较采用方差分析,组间比较采用χ2检验,以 P<0.05为差异具有统计学意义。 2 结果 2.1 替沃扎尼抑制SW579和HUVEC的增殖 2.1.1 细胞活度测定结果
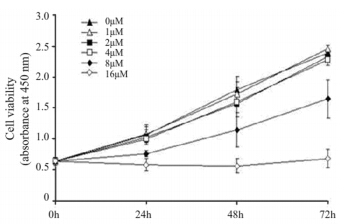
未接受替沃扎尼(0 μM) 处理的对照细胞,细胞活度(吸光度)随培养时间的增加而逐渐增加,而接受替沃扎尼处理的SW579或 HUVEC其吸光度的增加受到抑制,并呈时间和剂量 依赖性,两种细胞的IC50估计值分别为4 μM和8 μM, 见图 1、2。

|
| 图 1 不同浓度替沃扎尼对甲状腺癌SW579细胞活度的影响 Figure 1 Effect of tivozanob at different concentrations on the activity of thyroid cancer cell line SW579 |
|
| 图 2 不同浓度替沃扎尼对血管内皮细胞活度的影响 Figure 2 Effect of tivozanob at different concentrations on the activity of vascular endothelial cell line HUVEC |
未接受替沃扎尼(0 μM)处理的对照细胞其密度随培养时间的增加而 逐渐加大,而暴露于替沃扎尼IC50浓度的SW579或 HUVEC其细胞密度的增加明显减缓,细胞的生长增 殖受到明显抑制见图 3、4。

|
| 图 3 替沃扎尼抑制SW579和HUVEC的生长(×100) Figure 3 Tivozanib inhibited the growth of SW579 and HUVEC (×100) |

|
| 图 4 替沃扎尼抑制SW579和HUVEC的增殖 Figure 4 Tivozanib inhibited the proliferation of SW579 and HUVEC |
此外,SW579和HUVEC在相应IC50的替沃扎 尼作用下(72 h),镜下未见有明显的凋亡细胞, 见图 3。但当两种细胞在大于其IC50的替沃扎尼作 用下,镜下可见到少量的凋亡细胞。 2.1.3 细胞MI分析结果
与相应的对照细胞相比, SW579暴露于IC50的替沃扎尼24 h时,其MI尚无明 显降低,但48 h时其MI有所下降;而HUVEC暴露 于IC50的替沃扎尼24和48 h时,其MI均明显降低, 但差异无统计学意义,见表 1。
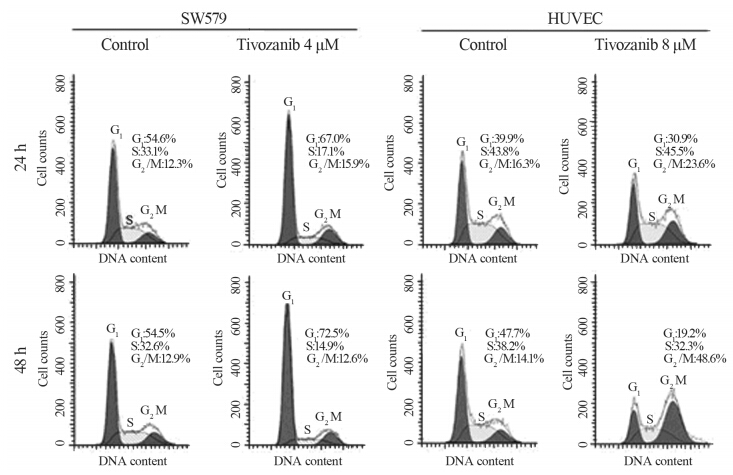
流式细胞仪细胞周期分析显示,SW579和HUVEC 在各自IC50的替沃扎尼作用下均发生明显的细胞周 期休止,但SW579休止于G1期,表现为G1期细胞 比例显著增加,而HUVEC则休止于G2/M期,表现 为G2/M期细胞比例显著增加。与暴露于替沃扎尼 24 h之细胞相比,替沃扎尼作用48 h后,两种细胞 的细胞周期休止效应进一步增强,见图 5。此外, SW579和HUVEC在IC50的替沃扎尼作用下,其DNA 含量分析图上均未提示细胞凋亡的G1前峰。
|
| 图 5 SW579和HUVEC分别被替沃扎尼休止于细胞周期的G1期和G2/M期 Figure 5 Tivozanib arrested cell cycles of SW579 and HUVEC at G1 and G2/M phases respectively |
肿瘤分子靶向治疗因具有选择性强、不良反 应小等优点而成为一种颇具应用前景的新型肿瘤 治疗手段[3]。分子靶向药物除可直接作用于肿瘤 细胞外,VEC也为其作用的靶细胞,肿瘤细胞 和VEGFR则为其抑制细胞生长的重要靶点[6]。VEGFR为跨膜受体蛋白-酪氨酸激酶超家族中的 重要成员,VEGF与其结合并将之激活,活化后 的VEGFR则可转导一系列增殖信号从而促使细 胞的增殖[15]。VEGFR在许多肿瘤包括甲状腺癌常 过度表达[7],从而促使肿瘤的生长及其血管生成, 因此一些分子靶向药物可通过作用于肿瘤细胞和 VEGFR以抑制肿瘤的生长及其血管生成而发挥其 抗肿瘤作用[4, 5, 6]。近些年来,各种TKI已被广泛用于 抗肿瘤治疗[8, 9],包括各种甲状腺癌的治疗[10, 11]。
临床前实验研究显示,作为一种TKI,替沃 扎尼可抑制多种肿瘤细胞和VEC的增殖及肿瘤 血管生成[12]。国内也已完成了该药的实验室合成工作[16]。本研究结果显示,替沃扎尼对SW579和 HUVEC的增殖均具有明显的抑制作用,其生长 抑制作用均呈时间和浓度依赖性,对SW579和 HUVEC的半数生长抑制浓度(IC50)分别约为4 μM和8 μM。SW579和HUVEC在其IC50作用下生长 增殖均受到明显的抑制,MI明显下降。
尽管替沃扎尼已被用于多种肿瘤治疗的Ⅱ、 Ⅲ期临床试验,但其抑制肿瘤生长及血管生成 的作用机制尚不十分清楚。有研究显示,一些 抗细胞增殖药物可通过诱发细胞周期休止或细 胞凋亡从而抑制肿瘤细胞的增殖,其作用受药 物浓度的影响[17]。近来研究显示,TKI范得它尼 (vatalanib)和帕唑帕尼(pazopanib)可诱导慢 性淋巴细胞性白血病细胞发生凋亡,但其致凋亡 作用具有剂量依赖性和细胞特异性,低剂量时癌 细胞的凋亡发生率也较低,而在同样的低剂量 下,癌细胞可发生明显的凋亡,而健康的B淋巴 细胞则较少受到影响[18]。本研究亦显示,当替沃 扎尼剂量高于SW579和HUVEC的IC50时,两种细 胞均可发生一定的凋亡,而在IC50的替沃扎尼作用 下,两种细胞则未发生明显的凋亡。流式细胞仪 细胞DNA含量分析图上也未见到提示细胞凋亡的 G1前峰,但可诱使SW579和HUVEC发生明显的细 胞周期休止,提示替沃扎尼对两种细胞的生长抑 制作用源于其对细胞周期的休止而非诱发细胞凋 亡。细胞增殖受细胞周期的控制。许多控制细胞 增殖的信号作用于G1期[19] ,但亦可作用于S期、G2 期及M期[20]。本研究显示,替沃扎尼对SW579和 HUVEC增殖的抑制均系通过对细胞周期的休止, 但对两种细胞的作用时相有所不同,SW579被休 止于G1期,而HUVEC则被休止于G2/M期。
本研究表明,替沃扎尼对甲状腺癌细胞和血 管内皮细胞的生长增殖均具有显著抑制效应,其 作用是籍对细胞周期的休止作用而实现,但两种 细胞发生细胞周期休止的时相不同,这提示,替 沃扎尼导致两种细胞发生细胞周期休止的内在分 子机制及信号转导通路可能有所不同,其详细机 制尚有待于进一步研究。替沃扎尼作为一种新 型的TKI分子靶向药物,通过高特异性地作用于 VEGFR,有可能通过抑制甲状腺癌细胞和VEC的 增殖及肿瘤的血管生成而发挥其抗肿瘤作用,具 有一定的应用前景。
| [1] | Bray F,Ren JS,Masuyer E,et al.Global estimates of cancer prevalence for 27 sites in the adult population in 2008[J].Int J Cancer, 2013,132(5):1133-45. |
| [2] | Siegel R, DeSantis C,Virgo K,et al.Cancer treatment and sur vivor ship statistics,2012[ J] .CA Cancer J Clin,2012, 62(4):220-41. |
| [3] | Dorsey K,Agulnik M.Promising new molecular targeted therapies in head and neck cancer[J].Drugs, 2013, 73(4):315-25. |
| [4] | Kerbel RS.Tumor angiogenesis[J].N Engl J Med,2008,358(19): 2039-49. |
| [5] | Carmeliet P,Jain RK.Molecular mechanisms and clinical applications of angiogenesis[J]. Nature,2011, 473(7347): 298-307. |
| [6] | Sitohy B, Nagy JA, Dvorak HF. Anti-VEGF/VEGFR therapy for cancer: reassessing the target[J].Cancer Res,2012, 72(8): 1909-14. |
| [7] | Keefe SM,Cohen MA, Brose MS.Targeting vascular endothelial growth factor receptor in thyroid cancer: the intracellular and extracellular implications[J].Clin Cancer Res,2010, 16(3):778-83. |
| [8] | Gotink KJ,Verheul HM.Anti-angiogenic tyrosine kinase inhibitors: what is their mechanism of action?[J].Angiogenesis,2010,13(1): 1-14. |
| [9] | Samant RS, Shevde LA. Recent advances in anti-angiogenic therapy of cancer[J]. Oncotarget, 2011, 2(3):122-34. |
| [10] | Antonelli A, Fallahi P, Ferrari SM, et al. New targeted therapies for thyroid cancer[J]. Current Genomics, 2011, 12(8): 626-31. |
| [11] | Perez CA,Santos ES,Arango BA,et al.Novel molecular targeted therapies for refractory thyroid cancer[J].Head Neck,2012,34(5): 736-45. |
| [12] | Nakamura K, Taguchi E, Miura T, et al. KRN951, a highly potent inhibitor of vascular endothelial growth factor receptor tyrosine kinases, has antitumor activities and affects functional vascular properties[J]. Cancer Res, 2006, 66(18): 9134-42. |
| [13] | Eskens FA, de Jonge MJ, Bhargava P,et al.Biologic and clinical activity of tivozanib (AV-951, KRN-951), a selective inhibitor of VEGF receptor-1, -2, and -3 tyrosine kinases, in a 4-week-on, 2-week-off schedule in patients with advanced solid tumors[J]. Clin Cancer Res, 2011,17(22):7156-63. |
| [14] | Wang E,Yin Y,Zhao M,et al.Physiological electric fields control the G1/S phase cell cycle checkpoint to inhibit endothelial cell proliferation[J]. FASEB J, 2003, 17(3): 458-60. |
| [15] | Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors[J]. Nat Med, 2003, 9(6): 669-76. |
| [16] | Fu Y,Zhang QW.Synthesis of tivozanib hydr ochlor ide monohydrate[J]. Zhongguo Xin Yao Za Zhi,2013,22(1):26-9. [府 莹,张庆文.盐酸替沃扎尼一水合物的合成[J].中国新药杂志, 2013, 22(1): 26-9.] |
| [17] | Schwartz GK. CDK inhibitors: cell cycle arrest versus apoptosis[J]. Cell Cycle, 2002, 1(2):122-3. |
| [18] | Paesler J, Gehrke I, Gandhirajan RK,et al. The vascular endothelial growth factor receptor tyrosine kinase inhibitors vatalanib and pazopanib potently induce apoptosis in chronic lymphocytic leukemia cells in vitro and in vivo[J]. Clin Cancer Res, 2010, 16(13): 3390-8. |
| [19] | Sherr CJ,Roberts JM.CDK inhibitors: positive and negative regulators of G1-phase progression[J].Genes Dev,1999,13(12): 1501-12. |
| [20] | Manchado E,Guillamot M,Malumbres M.Killing cells by targeting mitosis[J].Cell Death Differ, 2012, 19(3): 369-77. |
 2014, Vol. 41
2014, Vol. 41



