[1]。(2)广泛性:
肿瘤组织细胞内外的反常pH梯度主要与肿瘤细胞
的代谢特点相关,是广泛存在于各种肿瘤中的现
象,与病种、转移与否等均无明显关系[2]。
肿瘤细胞体外培养时,培养液的pH值一般在
7.4左右。这一酸碱度和体内肿瘤微环境中的酸碱
度是不符合的。因此,在这一环境下培养的肿瘤
细胞并不能准确反映体内实际生长的肿瘤细胞情
况。本研究拟在符合肿瘤在体情况的pH值环境中
培养肿瘤细胞,观察其生长状况、细胞形态、细
胞凋亡情况、凋亡相关基因表达,探讨微环境外
pH值对肿瘤生长、形态、活力的影响。
1 材料与方法
1.1 实验材料
人大肠癌SW116、LoVo细胞,人胃癌MKN-28
细胞为南京大学医学院附属鼓楼医院肿瘤中心实
验室常规培养。新生牛血清(兰州民海生物);
MTT[溴化-3(4,5-二甲基-2-噻唑基-2,5-二苯基四
氮唑丁)](Amersco,美国);二甲基亚砜(上海
凌峰公司,分析纯浓度);RPMI1640培养液
(Gibco,美国)。 Trizol Reagent(Invitrogen,CA,
美国);反转录试剂盒ExScriptTM RT reagent Kit
(Perfect Real Time) (TaKaRa,日本);荧光定量
PCR 试剂盒( Ex Taq Q-PRC Mix:TaKaRa,日
本);EASY Dilution(TaKaRa,日本)。其余试
剂均为国产分析纯。
1.2 实验方法
1.2.1 细胞培养及药物配制
将SW116、LoVo、
MKN-28细胞分别接种于含10%灭活小牛血清的
RPMI1640培养液中,置培养箱于5%CO2、37℃充
分湿化条件下培养传代,取对数生长期细胞进行
实验。采用1M HCl及NaOH溶液调整细胞培养液
pH值(pHe)分别为6.8和7.4。
1.2.2 MTT法检测肿瘤细胞增殖活力
分别以每
孔5×103的密度将3株细胞接种于96孔板内,培养
液为含10%小牛血清的RPMI1640,以NaOH及HCl
调节培养液pH值7.4及6.8。96孔板置37℃,含5%
CO2培养箱中全湿度培养48 h后,每孔加入1 mg/ml
MTT 20 μl,继续培养4 h后弃去上清液,每孔加
入200 μl二甲基亚砜,置振荡仪上充分混匀,采用
酶标仪以630 nm为参考波长,检测490 nm下吸光
度值,以pHe7.4环境下培养的细胞为对照,计算
pHe6.8环境下培养的细胞生存率,各组肿瘤细胞
抑制率按以下公式算。每组实验均重复3次以上。
细胞生存率=OD实验孔/OD对照孔×100%。
1.2.3 细胞形态观察
在光学显微镜下直接观察不
同pHe值下生长的肿瘤细胞的形态、生长密度等。
1.2.4 凋亡检测
采用Annexin V-FITC Kit (Bender
MedSystems,美国)试剂盒,按照说明书进行操作。
取对数生长期MKN-28细胞接种于6 cm培养皿中,
设定pHe7.4和pHe6.8两组。48 h后胰酶消化,收集
细胞,PBS洗2遍,100 μl结合缓冲液(4℃预冷)
重悬细胞,依次加入Annexin Ⅴ 5 μl和PI 1 μl,混
匀后室温避光孵育15 min后,加入400 μl结合缓冲
液,1 h内流式细胞仪检测分析各组细胞凋亡率。
1.2.5 凋亡相关基因Bcl-2及survivin表达的检测
1.2.5.1 细胞总RNA 提取 取在不同pH值培养液
中生长的细胞,收集肿瘤细胞。参照Trizol的说
明书提取细胞总RNA。主要步骤如下:(1) 每1×
106个细胞加入1 mlTrizol,反复吹打至细胞完全裂
解;(2) 每管中加入0.2 ml氯仿,充分混匀后,4℃,
12 000 g离心15 min,吸取水相上层于另一EP管
中;(3) 于水相中加入0.5 ml 异丙醇,混匀后-20℃
放置至少1 h,4℃,12 000 g离心10 min沉淀RNA;
(4) 弃上清液,加入1 ml70%乙醇洗涤,4℃,7 500
g 离心5 min,弃上清液;(5) 重复一遍70%乙醇洗
涤,晾干;(6) 加入无RNase 水,60℃ 水浴5 min,
重溶RNA,取1 μl在核酸定量仪上定量后将剩余
RNA 反转录为cDNA,-20℃ 保存。
1.2.5.2 cDNA 合成
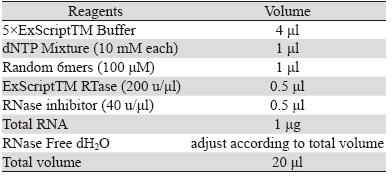
在冰上配制反转录反应液,
体系组成见表 1。反转录反应条件如下:42 ℃
15 min;95 ℃ 2 min。cDNA 于-20℃ 保存。
表 1 RNA反转录反应体系
Table 1 Reagents for RNA reverse transcription
1.2.5.3 实时荧光定量PCR 用EASY Dilution稀
释cDNA。在冰上配制PCR反应液20 μl(2× SYBR
QPCR Mix 10 μl,10×primers 2 μl,cDNA2 μl,
RNase Free dH2O 6 μl)。实时 PCR循环参数:95℃
预变性10 s,95℃ 变性5 s,60℃ 退火/延伸30 s,
45个循环。熔融曲线的循环参数:95℃ 1 min,从
55℃ 到95℃ 以0.1℃/s升温。所有样品均设三个复
孔,以提取的总RNA 为阴性对照。引物序列见表
2。以β-actin 作为内参,药物作用前细胞RNA作为
对照,根据公式2-ΔΔCt计算药物作用前后目的基因
mRNA 表达的变化。
表 2 PCR引物序列
Table 2 Sequences of PCR primers
1.3 统计学方法
采用excel2003统计软件包进行统计学处理。
计量资料的处理采用t检验,P<0.05 定义为差异有
统计学意义。
2 结果
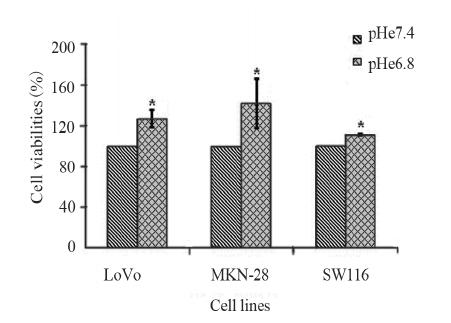
2.1 不同pHe值下细胞活力的变化
3种不同肿瘤细胞在pHe7.4及pHe6.8时的生长
情况,可以看出,与pHe7.4相比,在pHe6.8的环境
中,肿瘤细胞的生长更加旺盛,活力均较pHe7.4
时显著增加(P<0.05),见图 1。
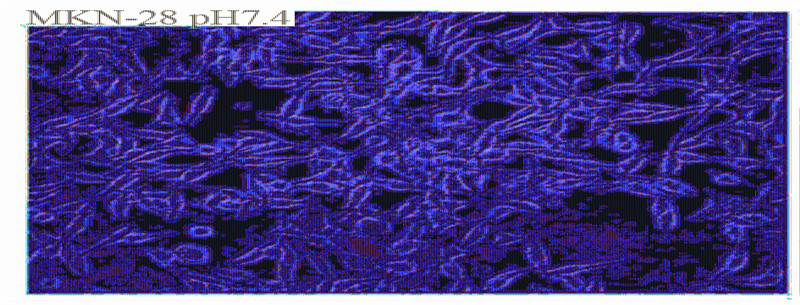
2.2 不同pHe值下肿瘤细胞形态的变化
选取显微镜下观察MKN-28肿瘤细胞的两个
代表性视野,可以看出,与pHe7.4环境下生长的
MKN-28细胞相比,在pHe6.8的环境下,肿瘤细胞
的形态未发生明显变化,但细胞的密度较高。同
样,对于SW116及LoVo细胞,在pHe为6.8时,也
都出现了细胞密度增高,但形态均较pHe7.4时无
明显变化,见图 2。
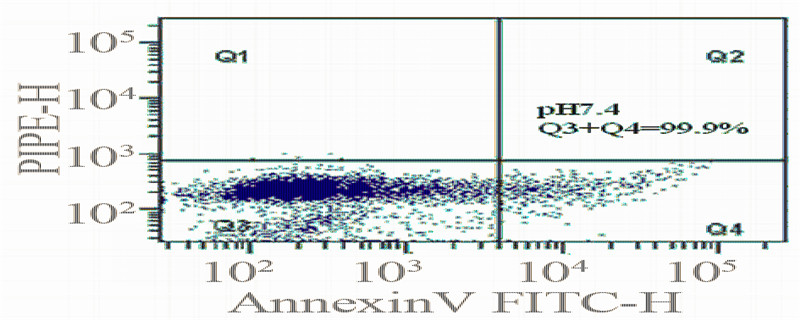
2.3 不同pHe值下细胞凋亡情况的比较
检测不同pH值下MKN-28细胞的凋亡率,可
以看出在pHe7.4及pHe6.8的环境下,细胞活力均良
好,未发生凋亡,见图 3。
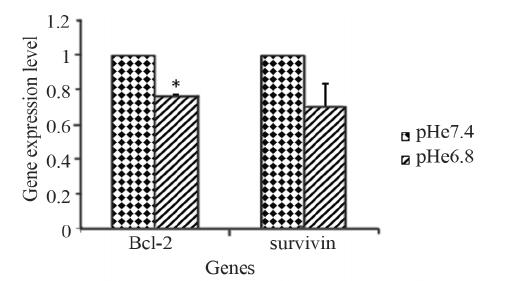
2.4 pHe值对凋亡相关基因表达的影响
检测pHe值对于凋亡相关基因Bcl-2及survivin
表达的影响。以pHe7.4的细胞为对照,检测pHe6.8
环境下细胞凋亡相关基因表达。当pHe从7.4下降
到6.8时,Bcl-2的表达显著性降低(P<0.05),
survivin的表达较pHe7.4时下降,但差异无统计学
意义(P>0.05),见图 4。
3 讨论
作为一个重要的微环境因子,pH异常梯度是
恶性肿瘤的代谢特点所催生的[3]。本实验结果可
以看出,低pHe可促进肿瘤细胞生长,图 1中的3
株肿瘤细胞的活力在pHe6.8环境中均较pHe7.4环
境中有明显增加。肿瘤细胞在生长速度加快的同
时,保持了良好的活力,形态上和pHe7.4时基本
相同。
本实验对于其中的MKN-28胃癌细胞做了更深
入的研究,发现在pHe6.8时,MKN-28细胞不仅保持
了良好的形态,也未发生凋亡。Matsuyama等[4]研究
发现,Caspase的激活在pHe6.8左右是最有效的,
故酸性环境不仅是凋亡细胞的特性,亦为凋亡的
早期促发因素。肿瘤细胞通过维持较高的pHi,实
际上阻碍了细胞凋亡,使肿瘤细胞在旺盛生长的
同时,保持良好的活力。除此之外,细胞内较高
的pH值可以促进糖酵解,从而满足肿瘤细胞对于
能量的高需求,这也是导致低pHe时肿瘤细胞生长
旺盛的原因之一[1,2]。
本实验还观察了凋亡相关基因Bcl-2及survivin
表达的变化,从图 4中可以看出,随着微环境pHe
的降低,Bcl-2的表达显著性降低,而survivin的表
达较pHe7.4时降低,但差异无统计学意义。Bcl-2
及survivin均为抗凋亡蛋白,Bcl-2是凋亡的最终
调控点,通过干扰细胞色素自线粒体的释放而阻
断蛋白酶级联反应的激活,survivin则在Bcl-2的下
游直接抑制细胞凋亡的核心—caspase而阻断肿瘤
细胞的凋亡[5,6]。本实验中Bcl-2的表达水平降低,
可能是因为pHe6.8组中细胞的生长更为旺盛,从
而使凋亡相关蛋白酶的活性反馈性地增强(如
caspase-3),由于Bcl-2与Caspase-3为代表的凋亡
相关蛋白酶之间存在着密切关系,故其表达水平
发生变化[7]。survivin由于是Bcl-2下游的蛋白,故
其活性未受到明显影响。
肿瘤细胞的低pHe和异常pH梯度对肿瘤的恶
性生物学行为具有重要的影响,除了促进肿瘤细
胞生长,亦有文献报道其可促进肿瘤的侵袭和转
移。对于化疗药物,也可导致pH依赖性生理性耐
药[3,8]及导致放疗抵抗。传统的肿瘤基础研究中,
肿瘤细胞的生长环境pHe一般均为中性偏碱,即
pHe7.4左右,这个pHe值与健康人体的内环境pHe
值相似,但却并非肿瘤细胞在人体内生长繁殖时
的环境pHe。从本实验中可以看出,无论是pHe7.4
还是pHe6.8,肿瘤细胞的活力和形态并无明显差
异,提示传统的基于肿瘤细胞的科学研究结论有
一定的可靠性,但由于微环境的不同,pHe7.4环
境下肿瘤细胞的生长速度、某些基因的表达、对
药物的反应、生物学行为等会与pHe6.8环境下的
肿瘤细胞存在差异,这种差异也不可避免地导致
许多研究结果出现某种程度的偏差。因此,在关
于肿瘤的研究中,应当更加关注肿瘤细胞生长的
微环境因子,在实验设计上更加精细化,如调整
肿瘤细胞培养液的pH值,采用多层细胞培养模
型、肿瘤组织块培养模型等,使基础研究的结果
更具有实用价值和临床意义。
 2014, Vol. 41
2014, Vol. 41