胃肠道肿瘤是最常见的一类恶性肿瘤,化疗 是其治疗的重要手段,目前在临床治疗中,5-氟 尿嘧啶(5-Fu)与铂类药物作为一线化疗药物被 广泛应用。然而,不同的个体对相同药物的反应 不尽相同,造成这种化疗敏感度差异的重要原因 之一是遗传变异,这种个体基因的遗传多态性可 改变化疗药物作用的关键酶的表达及其生物学活 性,从而调节化疗药物代谢与作用靶点的功能,最 终影响个体对化疗的反应性[ 1, 2 ]。大量研究已证实 药物疗效与药物代谢酶和DNA修复酶的基因多态 性之间存在密切相关性[ 3, 4, 5 ]。其中,胸苷酸合成酶基 因(thymidylate synthase,TYMS)和切除修复交叉 互补基因1(excision repair cross-complementing 1, ERCC1)最早引起人们关注[ 2,4 ]。TYMS基因常见的 基因型为3R/3R、2R/3R和2R/2R;ERCC1基因常见 的基因型为C/C、T/T和C/T。一直以来,临床上对 TYMS基因和ERCC1基因多态性检测常选用患者 肿瘤组织,但是由于各种原因,获取肿瘤组织存 在一定困难,导致对目的基因多态性检测存在一 定局限性。近年来国内外有研究[ 6, 7, 8, 9 ]报道,在大肠 癌、直结肠癌等消化道肿瘤患者外周血中检测到 TYMS和ERCC1基因多态性,但是对于胃癌患者 外周血中是否能够检测到TYMS和ERCC1基因多 态性,以及这些基因多态性是否与胃癌组织中存 在一致性,目前尚不清楚。本研究首先检测胃癌 患者肿瘤组织与外周血中TYMS和ERCC1基因多 态性,研究此两种基因在肿瘤组织与外周血中的 多态性是否一致,探究外周血基因多态性检测代 替组织检测的可行性。在此基础上,收集经5-Fu 和铂类药物化疗的消化道肿瘤如大肠癌、胃癌、 结肠癌等患者外周血,研究外周血TYMS基因与 ERCC1基因多态性在评估肿瘤患者化疗疗效中的 作用,为肿瘤患者个体化治疗提供一个简便的实 验室评估检测指标。 1 资料与方法 1.1 资料
选取2012年2月—2012年8月在郑州大学第一 附属医院胃肠外科行胃癌切除术的患者43例,其中 男31例,女12例。肿瘤组织经病理学检查证实均 为胃腺癌,所有患者手术前均未行放疗和化疗, 并采集术前外周血。同时收集76例采用5-Fu和铂 类药物进行化疗的大肠癌、胃癌、结直肠癌等胃 肠道肿瘤患者的外周血,按实体肿瘤的疗效评价 标准(RECIST)对化疗患者的近期疗效进行评 价,分为化疗有效组与无效组,有效组包括完全 缓解(CR)和部分缓解(PR),无效组包括病情 无变化(SD)和病情恶化(PD)。 1.2 方法 1.2.1 外周全血基因组DNA的提取
采用血液基 因组柱式小量提取试剂盒(北京)进行外周全血 基因组DNA的提取。 1.2.2 肿瘤组织基因组DNA的提取
采用UNQ-10 柱式动物组织DNA抽提试剂盒(上海)对所得肿 瘤组织标本进行基因组DNA提取。 1.2.3 PCR法检测TYMS基因型
TYMS基因引 物序列:上游:5’-GCGGAAGGGGTCCTG CCA -3’,下游:5’-CGTGCGGTCGTCCTT CCT G -3’。 反应总体系25 μl,95℃预变性5 min;95℃30 s、 63℃ 30 s、72℃ 30 s,40个循环; 72℃延伸5 min。取5 μl PCR产物电泳30 min,凝胶成像扫描 分析。 1.2.4 PCR-RFLP法检测ERCC1基因型
ERCC1基 因引物序列:上游:5’-TGTGGTTATCAAGGGTC ATCC-3’,下游:5’-CAGTCCAGAACACTGGGA CAT-3’。反应体系25 μl,95℃预变性5 min;95℃ 30 s、58℃ 30 s、72℃ 30 s,40个循环;72℃延伸 5 min。将10 μl扩增产物及2 μl Hind Ⅲ内切酶加入 反应管中,37℃水浴4 h后取出,65℃加热5 min终 止反应。消化后行琼脂糖凝胶电泳并观察结果。 1.3 统计学方法
应用SPSS 17.0软件进行统计分析,所得资料 均用样本例数表示,两组间的比较用卡方连续校 正法检验。Spearman进行样本组间相关性分析, Fisher精确检验分析基因型与化疗效果之间的关 系,双侧检验。以P<0.05为差异有统计学意义。 2 结果 2.1 TYMS和ERCC1基因型与患者临床病理因素 相关性分析
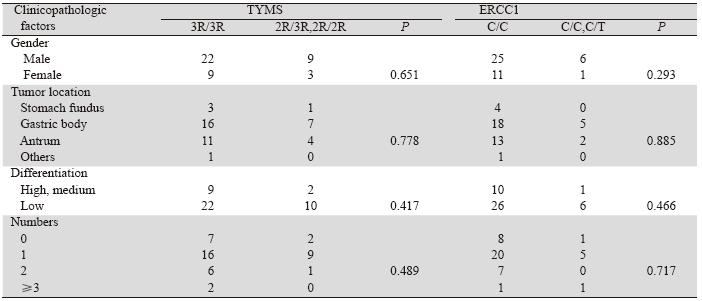
43例胃癌术后患者,TYMS和ERCC1各基因多 态性位点基因型与患者性别、肿瘤部位、肿瘤分 化程度、转移部位个数以及CEA水平方面均无显 著相关性(P>0.05),见表 1。
|
|
表 1 TYMS和ERCC1基因型与患者临床病理因素的相关性(n=43) Table 1 Correlation of TYMS,ERCC1 genotypes and clinicopathologic factors of gastric cancer patients(n=43) |
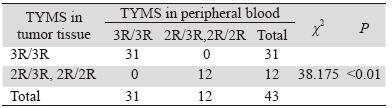
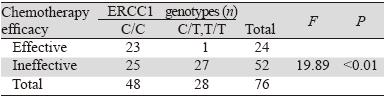
由电泳结果可知,TYMS基因3R/3R基因型扩 增片段为296 bp,2R/2R为268 bp,2R/3R基因型同 时存在268 bp与296 bp两种长度片段,扩增结果与 预期结果相一致。TYMS基因各基因型在外周血 和肿瘤组织中的分布见表 2。统计分析显示,外周 血和肿瘤组织中TYMS基因各基因型具有显著相关 性,且各基因型检出率一致,基因型间差别有统 计学意义(P<0.01),见图 1。
 |
M:marker; 1:2R/3R genotype; 2:2R/2R genotype; 3:3R/3R genotype 图 1 TYMS基因各基因型电泳图 Figure 1 Electrophoretogram of TYMS genotypes |
|
|
表 2 外周血和肿瘤组织TYMS基因各基因型频率 Table 2 Genotype frequencies of TYMS in peripheral blood and tumor tissues |
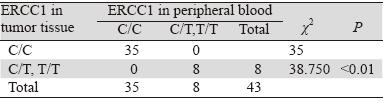
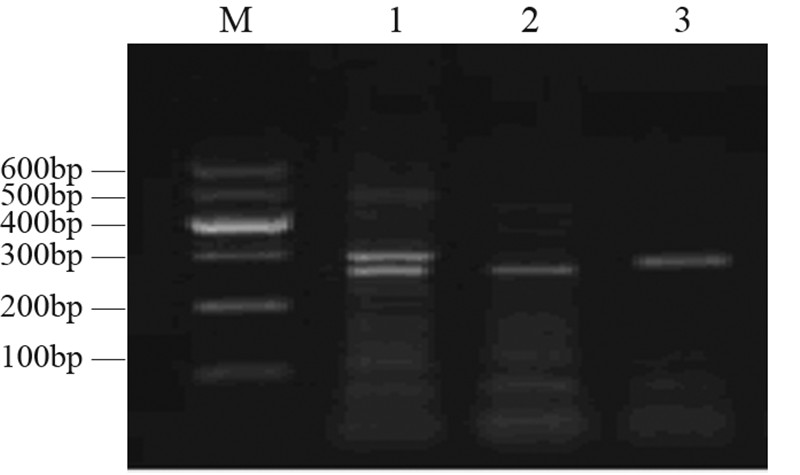
由电泳结果可知,ERCC1基因扩增片段为 240 bp,经酶切之后,C/C基因型片段长度仍为 240 bp,T/T基因型可被酶切为87 bp和153 bp, C/T基因型一部分不被酶切,一部分被酶切为87 bp和153 bp两个片段,其结果显示与预期结果相 一致。ERCC1基因各基因型在外周血和肿瘤组织 中的分布见表 3。统计分析显示,外周血和肿瘤组 织中ERCC1基因各基因型具有显著相关性,且各 基因型检出率一致,基因型间差异有统计学意义 (P<0.01),见图 2。
 |
M:marker; 1:PCR product of ERCC1 gene; 2:C/C genotype; 3:C/T genotype; 4:T/T genotype 图 2 ERCC1基因各基因型电泳图 Figure 2 Electrophoretogram of ERCC1 genotypes |
|
|
表 3 外周血和肿瘤组织ERCC1基因各基因型频率 Table 3 Genotype frequencies of ERCC1 in peripheral blood and tumor tissue |
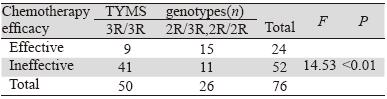
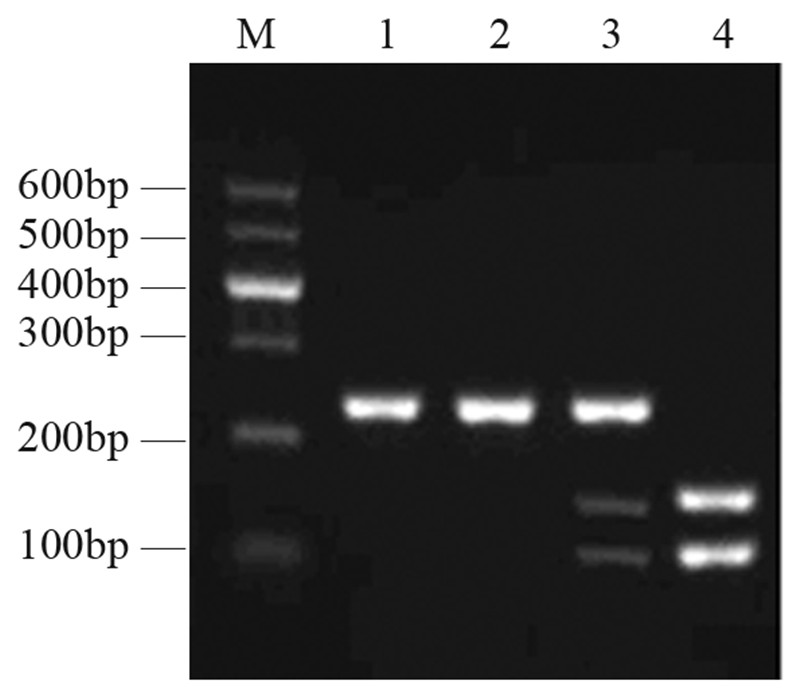
化疗患者中TYMS基因3R/3R、(2R/2R、 2R/3R)基因型检出率分别为65.79%(50/76)、 34.21%(26/76)。携带3R/3R基因型的患者共50 例,其中CR 0例、PR 9例、SD 14例、PD 27例; 化疗有效组9例,无效组41例,化疗有效率为18% (9/50);携带(2R/2R、2R/3R)基因型的患者 共26例,其中CR 0例、PR 15例、SD 4例、PD 7 例;化疗有效组15例,无效组11例,化疗有效 率为57.69%(15/26),见图 3。Spearman法分析 TYMS基因5’端非翻译区各基因型与化疗效果之间 显著相关(P<0.01);Fisher精确检验分析TYMS 基因各基因型与化疗效果之间的差异,2R/3R、 2R/2R基因型携带者化疗效果好于3R/3R基因型携 带者(P<0.01),见表 4。
 |
图 3 TYMS基因各基因型化疗疗效评价 Figure 3 Chemotherapy effects of TYMS genotypes |
|
|
表 4 TYMS基因各基因型化疗疗效比较 Table 4 Comparison of chemotherapy effect of TYMS genotypes |
化疗患者ERCC1基因C/C、(T/T、C/T)基 因型检出率分别为中63.16%(48/76)、36.84% (28/76)。携带C/C基因型的患者共48例,其中CR 0例、PR 23例、SD 10例、PD 15例,化疗有效组23 例,无效组25例,化疗有效率为47.91%(23/48); 携带(T/T、C/T)基因型的患者共28例,其中CR 0 例、PR 1例、SD 8例、PD 19例,化疗有效组1例, 无效组27例,化疗有效率为3.57%(1/28),见图 4。 Spearman分析ERCC1基因各基因型与化疗效果之 间的相关性,显著相关(P<0.01);Fisher检验法 分析ERCC1基因各基因型与化疗效果之间的差别, C/C基因型携带者化疗效果好于C/T、T/T基因型携 带者(P<0.01),见表 5。
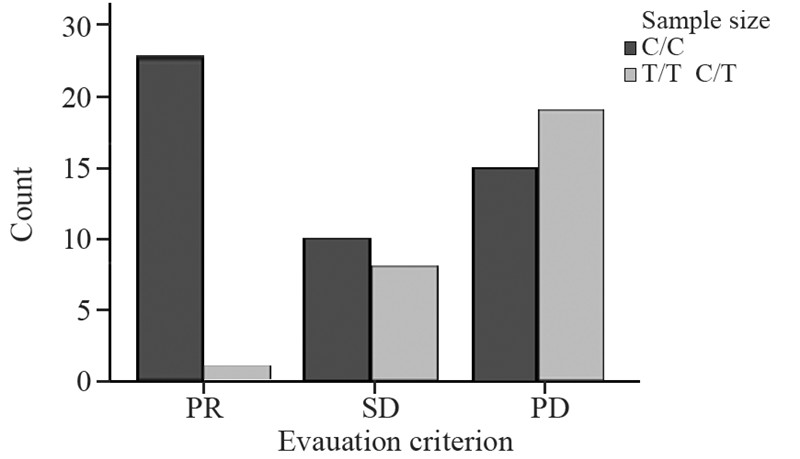 |
图 4 ERCC1基因各基因型化疗疗效评价 Figure 4 Chemotherapy effects of ERCC1 genotypes |
|
|
表 5 ERCC1基因各基因型化疗疗效比较 Table 5 Comparison of chemotherapy efficacy of ERCC1 genotypes |
TYMS基因位于第18号染色体上(18p11.32),长 16 kb,其主要转录起始位点位于起始密码子上游 160~180 bp。现已发现,TYMS基因非翻译区中存 在多态性,即5’非翻译区存在一个28 bp串联重复 序列,根据串联重复序列数目的不同,主要分为 重复两次的2R型和重复三次的3R型,因此,最常 见的基因型为3R/3R、2R/3R和2R/2R[ 10 ]。TYMS 基因影响化疗效果的具体作用机制如下:TYMS 基因表达产物胸苷酸合成酶是叶酸循环中起中心 作用的酶类之一,可将脱氧尿苷酸转变成脱氧 胸苷酸,后者是DNA合成和修复所需胸苷酸唯 一来源,抑制胸苷酸合成酶可导致细胞内胸苷酸 减少,染色体断裂,进而导致细胞死亡。同时, TYMS基因的表达产物是5-Fu发挥作用的重要靶点 之一,此酶在体内的含量可直接影响5-Fu的抗瘤 效应。TYMS在5’非翻译区的多态性可影响mRNA 稳定性和翻译效率,进而影响表达,导致患者体 内TYMS基因表达量的差异,从而改变个体对化疗 药物的敏感度。 3.2 TYMS与胃肠道肿瘤
研究发现,TYMS基因3R/3R基因型患者胸苷 酸合成酶的水平高于2R/3R和2R/2R基因型,且临 床表现也明显严重于后者[ 11 ],说明3R/3R基因型是 肿瘤辅助化疗的危险因素。Morganti等[ 12 ]在对48例 消化道肿瘤患者的研究中发现,携带3R/3R基因型 的患者体内TYMS mRNA表达水平显著高于携带 2R/2R和2R/3R基因型患者。早在2005年时,Yawata 等[ 13 ]提出TYMS拷贝数可作为五氟尿嘧啶药物敏感 度的预测指标。而后Brody等[ 14 ]和Watson等[ 15 ]证实 TYMS基因的5’端28bp核苷酸片段重复多态可影响 5-Fu在肿瘤患者体内的反应。Huang等[ 16 ]通过对116 例以5-Fu为基础化疗的胃癌患者的研究,也得出了 相似结论。 3.2.1 TYMS与胃癌
Cui等[ 17 ]指出中国胃肠道癌 症患者中TYMS基因2R/3R携带者对5-Fu的化疗敏 感度高于3R/3R携带者。 3.2.2 TYMS与结直肠癌
Villafranca等[ 18 ]研究65 例直肠癌患者TYMS基因显示:2R/3R和2R/2R基因 型的化疗降期率较3R/3R基因型的高,且2R/3R和 2R/2R基因型与3R/3R基因型3年无病生存率分别为 81%和41%。Pullarkat等[ 19 ]、Marsh等[ 20 ]、Park等[ 21 ]、 Matasui等[ 22 ]研究表明,TYMS基因2R/2R,2R/3R基 因型对5-Fu化疗敏感度好于3R/3R基因型。本研究 在对TYMS各基因型与5-Fu化疗效果关系的研究中 发现,携带TYMS基因3R/3R基因型的患者化疗有 效率为18%,而携带2R/2R和2R/3R基因型的患者 化疗有效率为57.69%,明显高于前者,说明TYMS 重复序列多态性可作为肿瘤降期的预测指标及预 测5-Fu为基础化放疗方案疗效的新手段。 3.3 ERCC1基因概述
ERCC1即切除修复交叉互不基因,位于第19 号染色体上(19q13.2),全长15 kb,含10个外显 子,其最常见且最有意义的多态性是位于第4号外 显子的第118号密码子中C→T的转变,其基因型可 分为三种:C/C、C/T、T/T。大量研究表明[ 23, 24, 25, 26 ], 携带C/C基因的患者对铂类药物敏感度更高,即 C/C基因型的出现可减低细胞中ERCC1基因的转录 效率及蛋白表达水平,最终减弱ERCC1的DNA修 复能力,进一步影响个体对铂类药物的敏感度; 而DNA损伤修复能力是改变铂类药物疗效的分 子基础,在铂类药物耐药机制中起着关键作用, ERCC1基因表达产物是DNA损伤修复中的关键酶 类之一,与铂类药物抵抗明显相关。 3.4 ERCC1与胃肠道肿瘤
Won等[ 27 ]通过对接受以奥沙利铂为主的一线 化疗的胃癌患者的研究认为,用ERCC1 C118T基 因多态来预测化疗药物的毒性是可行的。刘永萍 等[ 28 ]研究也证实了ERCC1基因多态性可作为预测 以奥沙利铂为主的化疗疗效的可靠因素。2011年 时,Yin等[ 29 ]在对以奥沙利铂化疗为主的胃癌和大 肠癌研究中指出,ERCC1 C118T可作为以奥沙利 铂为主的治疗预测因子。 3.4.1 ERCC1与胃癌
刘永萍等[ 28 ]指出外周血 ERCC1 C/C基因型胃癌患者接受含奥沙利铂方案 辅助化疗生存可能获益。但Ruzzo等[ 30 ]认为C/T,T/T 基因型化疗效果好于前者,但该作者在文章末尾 也指出此结论与大部分文献结论冲突的原因可能 是研究的样本量太小,加之实验的回顾性本质以 及临床情况的异质性。 3.4.2 ERCC1与结直肠癌
Ruzzo等[ 31 ]、贺文兴 等[ 9 ]认为结直肠癌患者ERCC1基因C/C基因型化疗 敏感度优于C/T和T/T基因型。然而,与此同时也 有少数报道与此结论相悖,Viguier等[ 32 ]认为携带 ERCC1 T/T的结直肠癌患者更容易对5-Fu和铂类化 疗药敏感。
本研究在对ERCC1各基因型与铂类药物化疗 效果关系的研究中发现,携带ERCC1基因C/C基 因型的患者化疗有效率为47.91%,而携带T/T和 T/C基因型的患者化疗有效率为57.69%,明显低于 前者,ERCC1各基因型与铂类药物化疗效果差异 有统计学意义,患者体内ERCC1基因型的差异导 致其对铂类药物的敏感度不同,表明肿瘤敏感基 因ERCC1的基因多态性可用于评估铂类药物的疗 效。根据基因型的不同,调整化疗药物,针对可 高表达ERCC1的基因型,选择性地使用高表达耐 药逆转剂,提高抗瘤效果。
然而,临床上某些携带TYMS基因2R/3R,2R/ 2R基因型和ERCC1基因C/C基因型的患者疗效并非 和预期疗效完全相符,提示可能存在其他因素对 化疗效果的影响,如年龄、饮食、器官功能等。
| [1] | Lincz LF, Seorgie FE, Garg MB, et al.Identification of a novelsjngle nueleotide polymorphism in the first tandem repeatquenee of the thymidylate synthase 2R allele[J].Int J Cancer,2007, 120(9):1930-4. |
| [2] | Chen J, Hunter DJ, Stampfer MJ, et al.Polymorphism in thethymidylate synthase promoter enhsncer region modifies therisk and survival of colorectal cancer[J].Cancer EpidemiolBiomarkers Prev,2003,12(10):958-62. |
| [3] | Adleff V, Hitre E, K?ves I,et al.Helerozygote deficiency inthymidylate synthase enhancer region polymorphism genotypedistribution in Hungarian colorectal cancer patients[J].Int JCancer, 2004, 108(6):852-6. |
| [4] | Graziano F,Kawakami K,Watanabe G,et al.Associationof thymidylate synthase polymorphisms with gastric cancersusceptibility[J].Int J Cancer, 2004, 112(6):1010-4. |
| [5] | Mandola MV,Stoehlmacher J,Zhang W, et al.A 6bp polymorphismin the thymidylate synthase gene causes message instability andis associated with decreased intratumoral TS mRNA levels[J].Pharmacogenetics, 2004, 14(5):319-27. |
| [6] | Ruzzo A, Graziano F, Loupakis F, et al. Pharmacogenetic profilingin patients with advanced colorectal cancer treated with first-lineFOLFOX-4 chemotherapy[J]. J Clin Oncol,2007, 25(10):1247-54. |
| [7] | Lamas MJ, Duran G, Gomez A,et al. X-ray cross-complementinggroup 1 and thymidylate synthase polymorphisms might predictresponse tochemoradiotherapy in rectal cancer patients[J]. Int JRadiat Oncol Biol Phys,2012,82(1):138-44. |
| [8] | Lamas MJ, Duran G, Balboa E, et al. Use of a comprehensivepanel of biomarkers to predict response to a fluorouraciloxaliplatinregimen in patients with metastatic colorectal cancer[J]. Pharmacogenomics, 2011, 12(3):433-42. |
| [9] | He WX, Li DM, Zhou WH, et al. Relationship between ERCC1gene polymorphism and oxaliplatin-based chemotherapeutic effectin colorectal cancer[J]. Guangdong Yi Xue,2012,33(10):1408-10.[ 贺文兴, 李冬梅, 周伟华, 等. ERCC1 基因多态性与结直肠癌奥沙利铂为基础方案化疗疗效的关系[J] . 广东医学,2012,33(10):1408-10. ] |
| [10] | Danenberg PV, Malli H, Swenson S. Thymidylate synthaseinhibitors[J]. Semin Oncol,1999,26(6):621-31. |
| [11] | Ishida Y, Kawakami K, Tanaka Y, et al. Association of thymidylatesynthase gene polymorphism with its mRNA and proteinexpression and with prognosis in gastric cancer [J].AnticancerRes,2002,22(5):2805-9. |
| [12] | Morganti M, Ciantelli M, Giglioni B, et al. Relationships betweenpromoter polymorphisms in the thymidylate synthase gene andmRNA levels in colorectal cancers[J]. Eur J Cancer,2005,41(14):2176-83. |
| [13] | Yawata A, Kim SR, Miyajima A, et al. Polymorphic tandemrepeat sequences of the thymidylate synthase gene correlates withcellular-based sensitivity to ?uoropyrimidine antitumor agents[J].Cancer Chemother Pharmacol, 2005, 56(5):465-72. |
| [14] | Brody JR, Hucl T, Gallmeier E,et al. Genomic copy numberchanges affecting the thymidylate synthase (tyms) gene incancer: a model for patient classification to aid fluoropyrimidinetherapy[J]. Cancer Res, 2006, 66(19):9369-73. |
| [15] | Watson RG, Muhale F, Thorne LB, et al. Ampli?cation ofthymidylate synthetase in metastatic colorectal cancer patientspretreated with 5-?uorouracil-based chemotherapy[J]. Eur JCancer, 2010, 46(18):3358-64. |
| [16] | Huang ZH, Hua D, Li LH. The polymorphisms of TS andMTHFR predict survival of gastric cancer patients treatedwith Xuorouracil-based adjuvant chemotherapy in Chinesepopulation[J]. Cancer Chemother Pharmacol,2009,63(5):911-8. |
| [17] | Cui YH, Liu TS, Zhuang RY, et al. Polymorphism of thymidylatesynthase gene and chemosensitivity of 5-fluorouracil regimen inmetastatic gastrointestinal cancer[J]. J Dig Dis,2009,10(2):118-23. |
| [18] | Villafranca E,Okruzhnov Y,Dominguez MA, et al .Polymorphisms of the repeated sequences in the enhancerregion of the thymidylate synthase gene promoter may predictdownstaging after preoperative chemoradiation in rectal cancer [J].J Clin Oncol, 2001, 19 (6):1779-86. |
| [19] | Pullarkat ST, Stoehlmacher J, Ghaderi V, et al. Thymidylatesynthase gene polymorphism determines response and toxicity of5-FU chemotherapy[J]. Pharmacogenomics J, 2001,1(1): 65-70. |
| [20] | Marsh S, McKay JA, Cassidy J, et al. Polymorphism in thethymidylate synthase promoter enhancer region in colorectalcancer[J]. Int J Oncol, 2001, 19(2):383-6. |
| [21] | Park DJ, Stoehlmacher J, Zhang W,et al. Thymidylate synthasegene polymorphism predicts response to capecitabine in advancedcolorectal cancer[J]. Int J Colorectal Dis,2002, 17(1):46-9. |
| [22] | Matasui T, OmuraK, Kawakami K,et al. Genotype of thymidylatesynthase likely to affect efficacy of adjuvant 5-FU basedchemotherapy in colon cancer[J]. Oncol Rep,2006,16(5):1111-5. |
| [23] | Kakimoto M, Uetake H, Osanai T, et al. Thymidylate synthaseand dihydropyrimidine dehydrogenase gene expression in breastcancer predicts 5-FU sensitivity by a histocultural drug sensitivitytest[J]. Cancer Lett,2005,223(1): 103-11. |
| [24] | Ulrich CM, Bigler J, Velicer CM, et al. Searching expressedsequence tag databases: discovery and confirmation of a commonpolymorphism in the thymidylate synthase gene[J]. CancerEpidemiol Biomarkers Prev, 2000, 9(12): 1381-5. |
| [25] | Mandola MV, Stoehlmacher J, Muller-Weeks S,et al. A novelsingle nucleotide polymorphism within the 5’tandem repeatpolymorphism of the thymidylate synthase gene abolishes USF1binding and alters transcriptional activity[J]. Cancer Ras, 2003, 63(11): 2898-904. |
| [26] | Ulrich CM, Bigler J, Bostick R, et al. Thymidylate synthasepromoter polymorphism interaction with folate intake and risk ofcolorectal adenomas[J]. Cancer Ras, 2002, 62(12): 3361-4. |
| [27] | Won DY, Kim SH, Hur H, et al. Chemotherapeutic responsibilityaccording to polymorphism of ercc1, xrcc1 and gstp1 in gastriccancer patients receiving oxaliplatin based chemotherapy[J]. JKorean Surg Soc, 2010, 78(6): 350-6. |
| [28] | Liu YP, Ling Y, Zhang YP, et al. Predictive values of platinumrelatedgene polymorphisms in gastric cancer patients onoxaliplatin-based adjuvant chemotherapy[J]. Zhonghua Yi Xue ZaZhi,2011,91(4):256-9.[刘永萍,凌杨,张亚萍,等.铂类化疗药物相关基因多态性对含奥沙利铂方案辅助化疗胃癌患者疗效的影响[J].中华医学杂志, 2011, 91(4):256-9.] |
| [29] | Yin M, Yan J, Martinez-Balibrea E, et al. ERCC1 and ERCC2polymorphisms predict clinical outcomes of oxaliplatin-basedchemotherapies in gastric and colorectal cancer: a systemic reviewand meta-analysis[J]. Clin cancer Res,2011,17(6):1632-40. |
| [30] | Ruzzo A, Graziano F, Kawakami K,et al. Pharmacogeneticprofiling and clinical outcome of patients with advanced gastriccancer treated with palliative chemotherapy[J].J Clin Oncol,2006,24(12):1883-91. |
| [31] | Ruzzo A, Graziano F, Loupakis F,et al. Pharmacogenetic profilingin patients with advanced colorectal cancer treated with first-lineFOLFOX-4 chemotherapy[J]. J Clin Oncol,2007,25(10):1247-54. |
| [32] | Viguier J, Boige V, Miquel C, et al. ERCC1 codon 118polymorphism is a predictive factor for the tumor response tooxaliplatin/5-fluorouracil combination chemotherapy in patientswith advanced colorectal cancer[J]. Clin Cancer Res,2005,11(17):6212-7. |
 2014, Vol.41
2014, Vol.41