食管癌是最常见的八大恶性肿瘤之一,其致 死率在恶性肿瘤中排第六位,在我国食管癌的死 亡率约为17.38/10万[1]。食管癌多隐匿性起病,大 多数患者就诊时已处于中晚期。虽然目前对食管 癌采取了手术、化疗与放疗相结合的综合治疗方 式,但五年生存率仍只有15%~25%,约75%的患 者多在确诊后一年内死亡[1, 2]。因此,提高食管癌 早期诊断率以降低其死亡率,寻找更有效的生物 学标志物是十分必要的。
微小RNA (microRNA,miRNA) 是一类内源 性的单链非编码小分子RNA,约17~25 bp大小, miRNA主要是通过与靶基因mRNA 3’-UTR结合, 导致靶基因mRNA降解或转录后翻译抑制,从而 调控靶基因的表达[3]。大量研究表明,miRNA在 肿瘤细胞的生物学行为以及肿瘤的发生发展中发 挥重要作用,包括细胞的增殖、分化、侵袭、凋亡 和转移等[4]。目前研究发现,miR-21在多种人肿瘤 细胞中均有较高的表达,并影响肿瘤细胞的生物 学行为[5, 6]。本文作者通过实时定量PCR方法检测 miR-21在食管鳞癌组织和周围正常食管组织中的 表达,并分析其与临床病理之间的关系。
1 资料与方法 1.1 临床资料本研究中72例食管癌患者的肿瘤组织和邻近 正常食管组织样本由湖北省肿瘤医院在2004年3月至2008年12月间活检或手术切除取得,所有患 者术前均未行放疗和化疗。临床资料和相关病理 信息从患者的病历和本院病理报告中获得。所有 患者均知晓其资料信息用于本实验研究,见表 1。 其中,男40例,女32例,年龄35~67岁,平均年龄 51.5岁。胸上段食管癌13例,中段35例,下段24 例。组织学为低分化16例,中分化22例,高分化34 例。术中取肿瘤中心(去除坏死组织后)及距肿 瘤边缘至少5 cm的食管切缘组织,病理确认食管残 端为正常食管黏膜上皮,组织类型均为鳞癌。本 研究中所有患者均获随访,随访从手术后第一天开 始,以患者死亡或失随访的时间为截止时间,至 2012年3月止,时间1~72月,平均为37.5月。
1.2 方法 组织样本均在液氮中研碎,总RNA由TaqMan miRNA Isolation Kit (美国Life公司)提取,RNA样 品A260/A280吸光度值在1.8左右为合格。合格的RNA 样品运用M-MLV First-Strand Synthesis System for qRT-PCR (美国Life公司) 进行反转录反应,反 应条件如下:16℃ 30 min,42℃ 30 min,85℃ 5min。利用二步法M-MLV Platinum® SYBR® Green qPCR SuperMix-UDG试剂盒(美国Life公司) 进行 PCR扩增,反应条件为50℃ 2 min,95℃ 10 min预 变性,95℃ 15 s,60℃ 30 s,共40个循环。以U6 作为内参基因,每样本重复3孔,对比内参U6的 Ct值分别计算其2-ΔΔct。 1.3 统计学方法采用SPSS18.0软件进行处理,组间差异通过t 检验和χ2检验,生存分析采用Kaplan-Meier和Cox 回归分析。P<0.05为差异有统计学意义。
2 结果 2.1 miR-21在食管癌组织和邻近食管组织中的表达运用实时定量P C R 方法检测所有组织中 miR-21的表达,结果表明miR-21在所有组织中均 有表达,且在72例食管癌组织中有63例miR-21的 表达,明显高于邻近的正常食管组织,两者之间 差异有统计学意义 (P=0.001),见图 1。
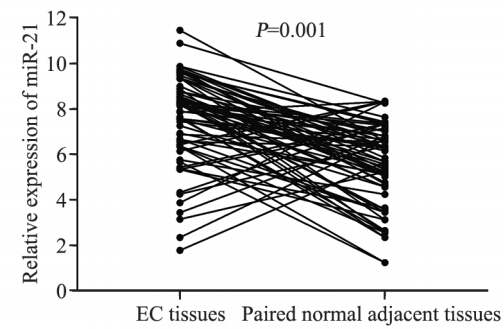 |
图 1 miR-21在食管癌和正常食管组织中的表达 Figure 1 miR-21 expression in 72 pairs of EC and adjacent normal esophageal tissues detected by quantitative realtime polymerase chain reaction (qRT-PCR) analysis |
2.2 miR-21的表达与食管癌患者临床病理之间的关系
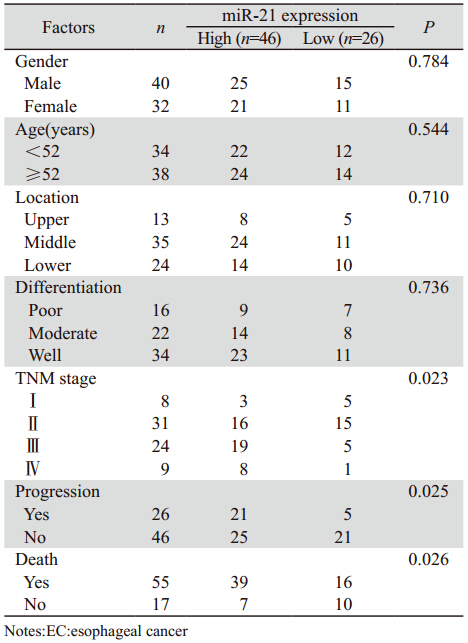
根据miR-21表达的中位值[(7.562±1.072), 内参为U6],将72名患者分为两组,其中高表 达组46例,低表达组26例。经统计分析发现, miR-21的表达与患者的肿瘤TNM分期和进展恶化 明显相关,患者miR-21表达越高,TNM分期越晚 (P=0.023),恶化的可能性越高(P=0.025)。而 与患者的性别、发病年龄、肿瘤的部位、肿瘤组织 类型以及分化程度无关,见表 1。
|
|
表 1 miR-21在食管癌组织中的表达及其与临床病理因素之间的关系 Table 1 Association between miR-21 expression and conventional clinicopathologic parameters in 72 EC patients |
2.3 miR-21在食管癌患者预后中的意义
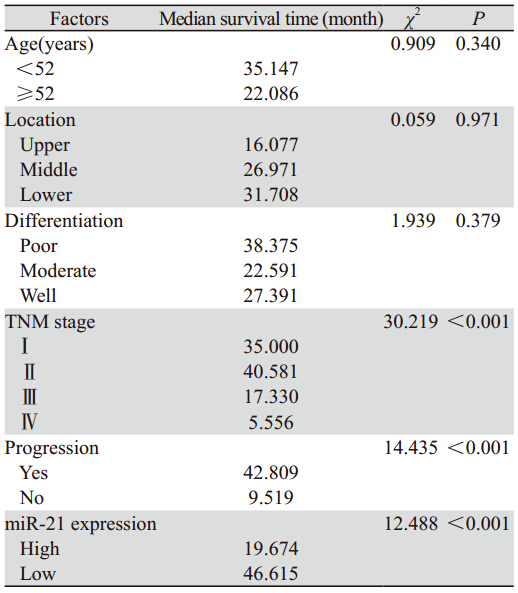
在随访中,我们定义术后肿瘤复发或/和发生 转移为恶化,通过对比复查时CT与术前CT的表现 来进行判定。在随访过程中,有26例患者发生恶化,其中21例是miR-21高表达患者,5例是miR-21 低表达患者。高表达组5年生存率为15.22%,低表 达组为38.46%。根据Kaplan-Meier生存分析表明, 高表达miR-21的食管癌患者相比低表达的患者5年 生存率更低(P=0.004),见图 2;同时发现TNM 分期越晚(P=0.005)、病情恶化(P=0.011)的患 者5年生存率越低,见表 2。
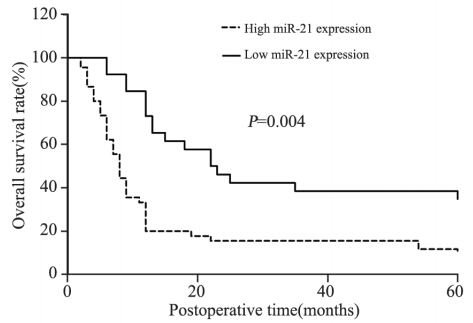 |
图 2 食管癌患者miR-21表达和生存时间之间的关系 Figure 2 Correlation between miR-21 expression and survival time in 72 EC patients |
|
|
表 2 miR-21及一般临床病理因素在食管癌患者预后中的单因素分析 Table 2 Univariate analysis of miR-21 expression and general clinicopathologic parameters in the prognosis of EC patients |
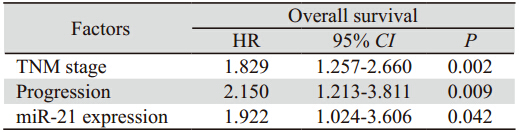
进一步多元Cox回归分析表明,miR-21表达 (P=0.042)、TNM分期(P=0.002)和病情恶化(P=0.009)均是食管癌患者预后的独立指标,见表 3。
|
|
表 3 miR-21及一般临床病理因素在食管癌患者预后中的多因素分析 Table 3 Multivariate analysis of miR-21 expression and general clinicopathologic parameters in the prognosis of EC patients |
3 讨论
miRNAs最早由Lee等[7]在秀丽隐杆线虫中首 次发现。目前超过1 000种miRNA被发现,其在动 物、植物和病毒中广泛表达。在动物体内miRNA 主要通过与靶基因3’端非编码区(3’-UTR)不完全 配对,从而抑制靶基因mRNA翻译来参与细胞分 化、增殖、侵袭、凋亡等生物学过程[8, 9]。近年大 量研究发现miRNA在多种恶性肿瘤组织中与其相 应正常组织表达存在显著差异[10, 11],同时大量研 究表明miRNA在肿瘤中的表达高低与肿瘤的发生 发展有密切关系[12, 13]。
目前发现多种miR在食管癌中均有明显的表 达,与食管癌的发生发展有密切关系[14]。同时, 最近研究证实miR-21是唯一在多种实体肿瘤肺 癌、胃癌、前列腺癌、结肠癌、食管癌、胰腺癌 等中高表达的miRNA。但关于miR-21与肿瘤临床 病理因素之间关系的研究少有报道。本实验中运 用实时定量PCR方法检测miR-21在食管癌组织和 邻近正常食管组织中的表达,证实了miR-21在食 管癌组织和周围相邻正常食管组织中表达存在明 显差异,且miR-21在食管癌组织中也呈明显的高 表达,该结论与以前的一些相关研究一致[5, 6, 15]。 在miR-21对肿瘤发生发展机制研究方面也有较多 的报道,Ziyan等[5]也证实在骨肉瘤MG-63细胞中 miR-21通过直接作用RECK基因促进肿瘤的侵袭和 转移。Song等[15]发现在乳腺癌细胞中miR-21通过 调节TIMP3基因来调节乳腺肿瘤细胞的侵袭。
通过术后的随访统计结果,发现高表达 miR-21的患者有着更差的预后,说明miR-21可以 作为食管癌患者一个有效预后的指标。同样在其 他研究中也有类似的报道,Gu等[10]发现miR-372 的高表达与肝癌患者术后生存时间存在明显的正 相关。同样在膀胱癌患者中减少的miR-31表达也 证实和术后生存时间缩短有明显的关系[12]。近期 Markou等[16]报道miR-21高表达可以作为非小细胞肺癌患者总生存率一个独立的预后因素。
肿瘤的形成是一个非常复杂的过程,包括从 起初的基因改变引起的恶性转变到最后的肿瘤形 成,甚至远处转移。在这些过程中,不同的肿瘤 都有着独特的分子事件,因此肿瘤的预后往往 取决于不同基因之间的相互作用。Qian等[17]发现 miR-21在344例乳腺癌病例中均有表达,但高表达 的miR-21与患者预后无明显相关性。同样,在食 管癌形成的过程中,miR-21并不是唯一一个发生 改变的基因,因此进一步研究的重点是发现更多 发生改变的基因,研究他们相关的机制,从而为 更好理解食管癌的发生发展以及为预后提供理论 支持。
总之,在本研究中发现miR-21在食管癌组织 的表达明显高于邻近正常食管组织,高表达的 miR-21与食管癌的进展和预后呈明显的相关性。 miR-21可作为食管癌患者总生存率一个独立的预 后因素。
| [1] | Enzinger PC, Mayer RJ. Esophageal cancer[J]. N Engl J Med,2003,349(23): 2241-52. |
| [2] | Xing D, Tan W, Lin D. Genetic polymorphisms and susceptibilityto esophageal cancer among Chinese population (review) [J].Oncol Rep, 2003,10(5): 1615-23. |
| [3] | Cho WC. OncomiRs: the discovery and progress of microRNAs incancers[J]. Mol Cancer, 2007, 6: 60. |
| [4] | Croce CM, Calin GA. miRNAs, cancer, and stem cell division[J].Cell, 2005, 122(1): 6-7. |
| [5] | Ziyan W, Shuhua Y, Xiufang W, et al. MicroRNA-21 is involvedin osteosarcoma cell invasion and migration[J]. Med Oncol,2011,28(4): 1469-74. |
| [6] | Chan JA, Krichevsky AM, Kosik KS. MicroRNA-21 is anantiapoptotic factor in human glioblastoma cells[J]. Cancer Res,2005,65(14): 6029-33. |
| [7] | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarityto lin-14[J]. Cell, 1993,75(5): 843-54. |
| [8] | Villanueva A, Hoshida Y, Toffanin S, et al. New strategies inhepatocellular carcinoma: genomic prognostic markers[J]. ClinCancer Res, 2010,16(19): 4688-94. |
| [9] | Milazzo M, Fornari F, Gramantieri L. MicroRNA andhepatocellular carcinoma: biology and prognostic significance[J].Minerva Gastroenterol Dietol, 2011,57(3): 257-71. |
| [10] | Gu H, Guo X, Zou L, et al. Upregulation of microRNA-372associates with tumor progression and prognosis in hepatocellularcarcinoma[J]. Mol Cell Biochem, 2013,375(1-2): 23-30. |
| [11] | Liu M, Wang Z, Yang S, et al. TNF-α is a novel target of miR-19a[J]. Int J Oncol, 2011, 38(4): 1013-22. |
| [12] | Wang S, Li Q, Wang K, et al. Decreased expression ofmicroRNA-31 associates with aggressive tumor progression andpoor prognosis in patients with bladder cancer[J]. Clin TranslOncol, 2013, 15(10):849-54. |
| [13] | Yan LX, Huang XF, Shao Q, et al. MicroRNA miR-21overexpression in human breast cancer is associated withadvanced clinical stage, lymph node metastasis and patient poorprognosis[J]. RNA, 2008, 14(11): 2348-60. |
| [14] | Liu SG, Qin XG, Zhao BS, et al. Differential expression ofmiRNAs in esophageal cancer tissue[J]. Oncol Lett, 2013, 5(5):1639-42. |
| [15] | Song B, Wang C, Liu J, et al. MicroRNA-21 regulatesbreast cancer invasion partly by targeting tissue inhibitor ofmetalloproteinase 3 expression[J]. J Exp Clin Cancer Res,2010,29: 29. |
| [16] | Markou A, Tsaroucha EG, Kaklamanis L, et al. Prognostic valueof mature microRNA-21 and microRNA-205 overexpression innon-small cell lung cancer by quantitative real-time RT-PCR[J].Clin Chem,2008,54(10): 1696-704. |
| [17] | Qian B, Katsaros D, Lu L, et al. High miR-21 expression inbreast cancer associated with poor disease-free survival in earlystage disease and high TGF-beta1[J]. Breast Cancer Res Treat,2009,117(1): 131-40. |
 2014, Vol.41
2014, Vol.41