2. 南方医科大学肿瘤中心 ;
3.南方医科大学中西医结合医院肿瘤科
2. Cancer Center of Southern Medical University;
3.Cancer Center of Hospital of Integrated Traditional Chinese and Western Medicine, Southern Medical University
皮肤癌是临床较常见的皮肤恶性肿瘤,多 发生在面、颈部等长期暴露的皮肤。皮肤癌主 要分为鳞状细胞癌(squamous cell cancer,SCC) 、 基底细胞癌(basal cell cancer,BCC)和恶性黑素瘤 (malignant melanoma,MM)三大类,其中,SCC 和BCC统称为非黑色素瘤皮肤癌(non melanoma skin cancer,NMSC),占皮肤癌的绝大部分。MM 在皮肤癌中所占比例小,但其恶性程度高,易早 期发生转移。目前,皮肤癌的发病率呈逐年增高 趋势[1]。
非甾体类抗炎药具有解热、镇痛、抗炎等作 用,在临床上广泛用于发热、炎症和各种疼痛的 缓解。已有证据证明,服用非甾体抗炎药可显著 降低结直肠癌、乳腺癌等的发病风险[2]。体外研究 和动物实验表明,非阿司匹林类非甾体类抗炎药可能降低皮肤癌发病风险[3]。而目前的关于非阿司 匹林类非甾体抗炎药与皮肤癌的发病风险的多个 临床研究对该类药物能否降低皮肤癌发病率存在 争议[4, 5, 6, 7, 8, 9, 10, 11, 12, 13]。本文基于多项临床研究,分析非阿司匹 林类非甾体抗炎药与皮肤癌发病风险的关系。
1 资料与方法 1.1 文献检索策略外文数据库以“nsaids”、“non-steroidal antiinflammatory agents”、“skin cancer”、“skin tumor”、“melanoma skin cancer”、“nonmelanoma skin cancer”、“squamous cell carcinoma”、“basal cell carcinoma”为关键词或主题词,对PubMed (Medline),EMBASE,BIOSIS,Cochrane图书 馆进行系统检索;中文数据库以非甾体抗炎药、皮 肤癌、皮肤肿瘤、鳞状细胞癌、基底细胞癌、黑色 素瘤、非黑色素瘤皮肤癌等为主题词或关键词, 在中国知网数据库(CNKI)中进行检索。限于人 类研究,不限定语言种类。检索时间为建库初始 到2013年5月。同时手工检索所有综述及原始文献 的参考文献,阅读文献的标题和摘要确定其相关性. 如果不能确定,则浏览全文决定是否纳入。
1.2 文献纳入标准(1)关于非阿司匹林类非甾体抗炎药与皮肤 癌发病风险相关性的临床一次研究文献;(2)报 告了非阿司匹林的使用情况;(3)报告了皮肤癌 的诊断;(4)分析资料完整,报告了OR或RR值 及95%置信区间。如样本人群相同而文献多于1篇 者,则选择纳入人数最多、最新的文献。
1.3 数据提取和文献质量评估数据提取内容包括:研究者姓名,研究发表 年份,地区,样本量,非阿司匹林非甾体类抗炎药 的暴露评定,使用药物的具体种类和使用频率、 年限,皮肤癌的种类及评定方法,OR值或RR值及 95%置信区间。RCT质量评价采用Jadad量表[14],依 照4条质量评价标准进行评价:(1)随机序列的 产生;(2)随机方法的隐藏;(3)盲法;(4) 退出和失访。病例对照和队列研究采用Newcastle- Ottawa Scale(NOS)量表进行质量评价[15],包括对 象的选择,可比性,结局或暴露三个方面。Jadad 评分>3分,NOS评分≥5分的文献认为是高质量文 献。2位评阅人独立进行文献检索、数据提取和质 量评估。如有分歧,通过讨论或提交第三位研究 者协助解决。
1.4 统计学方法用Stata10.0软件对纳入文献进行分析,选择 OR值和95%CI作为评估非阿司匹林类非甾体抗炎 药是否与皮肤癌发病相关的效应指标。采用Q检验 和I2检验来评价研究的异质性。Q检验P≥0.05,I2 ≤50%,认为异质性可以接受,用固定效应模型进 行合并。用漏斗图来定性评估纳入研究是否存在 发表偏倚。用Begg’s秩相关检验[16]和Egger’s线性回 归模型[17]定量分析文献的发表偏倚,P>0.10时认 为不存在发表偏倚。
2 结果 2.1 文献检索结果依据检索策略,共检索出相关文献521篇,排 除非人类研究后初步纳入文献317篇,通过阅读文 题与摘要,排除304篇非相关文献,删除重复数据的 研究3篇,最终纳入文献10篇,包含12个独立研究。
2.2 纳入研究的特点和质量评价所纳入的12个研究中,1个为随机对照研究,4 个为队列研究,7个为病例对照研究,共有482 264 名皮肤癌患者。研究分别在美国、荷兰和丹麦进 行,研究对象均为白种人。纳入研究的基本特点 见表 1。随机对照研究的Jadad评分为6分,其中随 机序列的产生1分,随机化隐藏2分,盲法2分,退 出与失访1分。病例对照研究和队列研究的NOS评 分在6~9分,见表 2。所有纳入研究均认定为具有 较高质量。
|
|
表 1 纳入文献的基本特征 Table 1 General characteristics of studies included in the meta-analysis |
|
|
表 2 纳入文献病例对照研究和队列研究方法学质量评估 Table 2 Methodologic quality assessment of case-control studies and cohort studies |
2.3 主要结果和偏倚分析
12个研究的异质性检验示P=0.07,I2=40.7%, 异质性可以接受,采用固定效应模型进行合 并,合并OR值=1.00,95%CI:0.98~1.02,说 明非阿司匹林类非甾体抗炎药与皮肤癌发病风 险无相关性,见图 1。发表偏倚检测的倒置漏 斗图较对称,见图 2。Egger ’s检验,P=0.17, Begg's检验,P=0.30,结果均提示没有明显的发 表偏倚,Meta分析结论的可信度较高。采用逐 一排除的方法进行敏感度分析,结果提示Jeter 2012可能对最终结果有较大影响。排除该研究 后,异质性有所下降,而结论不变(OR=0.98, 95%CI:0.95~1.02,P=0.08,I2=40.0%),说明Meta分 析的稳定性较好。
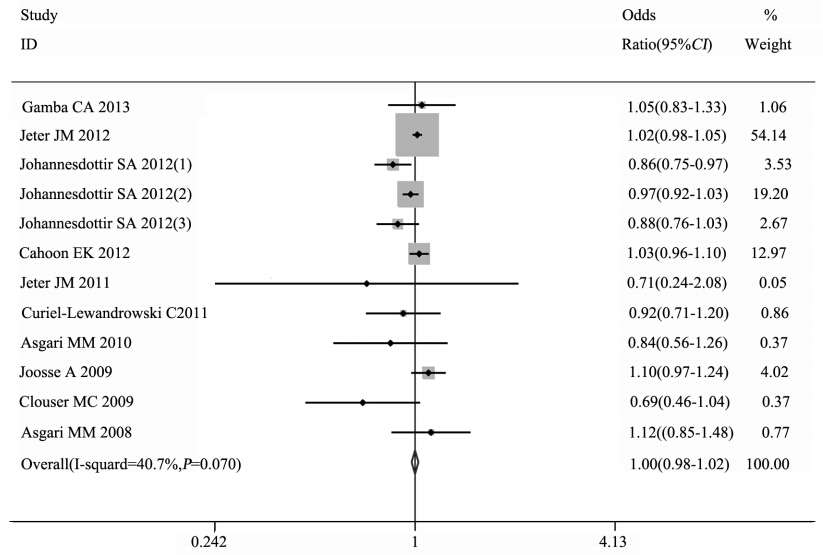 |
图 1 服用非阿司匹林类非甾体抗炎药与皮肤癌发病风险的Meta分析森林图 Figure 1 Forest plot of overall meta-analysis on the association between non-aspirin non-steroidal anti-inflammatory drugs intake and risk of skin cancer |
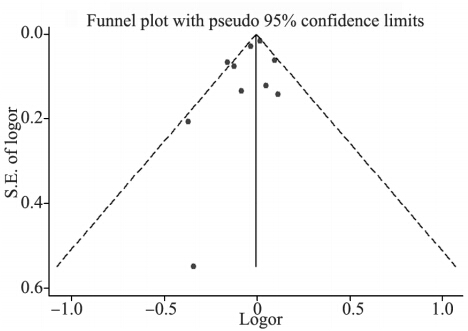 |
图 2 纳入本研究的漏斗图 Figure 2 Funnel plot of the potential publication bias for studies included in the meta-analysis |
2.4 亚组分析结果
按照皮肤癌的种类进行亚组分析,其结果 示,服用非阿司匹林类非甾体类抗炎药可能减小 SCC的发病风险,但无统计学意义;而服用该类 药物与BCC和MM发病风险无关。按照研究类型进行亚组分析,病例对照研究结果显示,服用非阿 司匹林类非甾体类抗炎药可能具有减小皮肤癌发 病风险的效应,但无统计学意义。队列研究未提 示服用非阿司匹林类非甾体抗炎药与皮肤癌发病 风险相关,见表 3。
|
|
表 3 服用非阿司匹林类非甾体抗炎药与皮肤癌发病风险的亚组分析结果 Table 3 Subgroup analysis results of the association between non-aspirin non-steroidal anti-inflammatory drugs intake and risk of skin cancer |
3 讨论
非甾体类抗炎药主要通过抑制环氧合酶 (cyclooxygenase,COX)发挥解热、镇痛和抗炎 的作用,可分为阿司匹林和非阿司匹林类非甾体 抗炎药两大类。非阿司匹林类非甾体抗炎药包括 对乙酰氨基酚、布洛芬、塞来昔布等,主要抑制 环氧合酶2(COX-2)的活性。已有研究表明, COX-2在炎症、肿瘤等病理过程中被诱导表达[18], 其高表达与皮肤癌的发生、发展密切相关[19, 20, 21]。体 外研究提示,非阿司匹林类非甾体类抗炎药可通 过抑制抑制COX-2的形成来发挥抗皮肤肿瘤的肿 瘤作用[22]。而对非阿司匹林类非甾体抗炎药是否 具有降低皮肤癌发生的效应的临床研究结果并不 一致。
本文对目前已有的临床研究数据进行Meta分 析,可提高检验效能。研究结果显示服用非阿司 匹林类非甾体抗炎药不能降低皮肤癌发病风险, 该结论与Silva等[2]的研究结果一致。值得一提的 是,Silva等纳入了Vogel等[23]对丹麦人群的研究, 而本文排除了Vogel等[23]的研究,纳入了来自同一 人群,但样本量更大的Josse等[5]的研究。我们也排 除了Silva等[2]纳入的一项研究对象为具有皮肤癌癌 前病变的人群的研究[24]。
根据研究类型进行亚组分析后,队列研究结 果与总体Meta分析结论一致。而病例对照研究的 结果显示,非阿司匹林类非甾体抗炎药可能具有 降低皮肤癌发病风险的效应,但无统计学意义。 然而,该结果的解释需谨慎。首先,部分病例对照研究为小样本研究,较大样本研究相比,更 容易高估药物的效用;其次,病例对照研究可能 存在回忆偏倚,夸大药物的效用[25];再次,部分 病例对照研究的药物暴露是通过患者自报告来确 定,对药物暴露情况的确定可能不准确。
根据疾病类型的亚组分析,我们发现非阿司匹 林类非甾体抗炎药可能对SCC具有一定的保护效 应,而对BCC和MM并无保护效应。这可能是由于 Cox-2在SCC中存在表达较高相关[26]。但由于该结 论并无统计学意义,且纳入该亚组的研究数目较 少,该结果的解释需谨慎。
综上所述,我们的研究表明,非阿司匹林类 非甾体抗炎药与皮肤癌发病风险无统计学相关 性。然而,在分层分析中,亚组的研究样本较 少,对其结果的解释需谨慎。且本文仅纳入1个 RCT研究,其余均为观察性研究,该结论有待多 中心、大样本的随机临床试验的证实。
| [1] | Marks R. An overview of skin cancers. Incidence and causation[J].Cancer, 1995, 75(2 Suppl): 607-12. |
| [2] | Silva MT, Galvao TF, Zimmerman IR,et al. Non-aspirinnon-steroidal anti-inflammatory drugs for the primarychemoprevention of non-gastrointestinal cancer: summary ofevidence[J].Curr Pharm Des, 2012, 18(26): 4047-70. |
| [3] | Grau de Castro JJ.COX-2 inhibitors in cancer prevention[J].RevClin Esp, 2005, 205(9): 446-56. |
| [4] | Asgari MM, Maruti SS, White E. A large cohort study ofnonsteroidal anti-inflammatory drug use and melanomaincidence[J].J Natl Cancer Inst, 2008, 100(13): 967-71. |
| [5] | Joosse A, Koomen ER, Casparie MK, et al. Non-steroidal antiinflammatorydrugs and melanoma risk: large Dutch populationbasedcase-control study[J].J Invest Dermatol, 2009, 129(11):2620-7. |
| [6] | Clouser MC, Roe DJ, Foote JA, et al. Effect of non-steroidal antiinflammatorydrugs on non-melanoma skin cancer incidence inthe SKICAP-AK trial[J].Pharmacoepidemiol Drug Saf, 2009,18(4): 276-83. |
| [7] | Asgari MM, Chren MM, Warton EM, et al. Association between nonsteroidal anti-inflammatory drug use and cutaneous squamouscell carcinoma[J].Arch Dermatol, 2010, 146(4): 388-95. |
| [8] | Curiel-Lewandrowski C, Nijsten T, Gomez ML, et al. Long-termuse of nonsteroidal anti-inflammatory drugs decreases the riskof cutaneous melanoma: results of a United States case-controlstudy[J].J Invest Dermatol, 2011, 131(7): 1460-8. |
| [9] | Jeter JM, Bonner JD, Johnson TM, et al. Nonsteroidal antiinflammatorydrugs and risk of melanoma[J].J Skin Cancer, 2011,2011: 598571. |
| [10] | Jeter JM, Han J, Martinez ME, et al. Non-steroidal antiinflammatorydrugs, acetaminophen, and risk of skin cancer inthe Nurses' Health Study[J].Cancer Causes Control, 2012, 23(9):1451-61. |
| [11] | Johannesdottir SA, Chang ET, Mehnert F, et al. Nonsteroidal antiinflammatorydrugs and the risk of skin cancer: a populationbasedcase-control study[J].Cancer, 2012, 118(19): 4768-76. |
| [12] | Cahoon EK, Rajaraman P, Alexander BH, et al. Use ofnonsteroidal anti-inflammatory drugs and risk of basal cellcarcinoma in the United States Radiologic Technologists study[J].Int J Cancer, 2012, 130(12): 2939-48. |
| [13] | Gamba CA,Swetter SM,Stefanick ML,et al. Aspirin is associatedwith lower melanoma risk among postmenopausal Caucasianwomen: The Women's Health Initiative[J].Cancer, 2013,119(8):1562-9. |
| [14] | Jadad AR, Moore RA, Carroll D, et al. Assessing the quality ofreports of randomized clinical trials: is blinding necessary?[J].Control Clin Trials, 1996, 17(1): 1-12. |
| [15] | Cota GF, de Sousa MR, Fereguetti TO, et al. Efficacy of antileishmaniatherapy in visceral leishmaniasis among HIV infectedpatients: a systematic review with indirect comparison[J].PLoSNegl Trop Dis, 2013, 7(5): e2195. |
| [16] | Begg CB, Mazumdar M. Operating characteristics of a rankcorrelation test for publication bias[J].Biometrics, 1994, 50(4):1088-101. |
| [17] | Egger M, Davey SG, Schneider M, et al. Bias in meta-analysisdetected by a simple, graphical test[J].BMJ, 1997, 315(7109):629-34. |
| [18] | Masferrer JL, Leahy KM, Koki AT, et al. Antiangiogenic andantitumor activities of cyclooxygenase-2 inhibitors[J].Cancer Res,2000, 60(5): 1306-11. |
| [19] | Denkert C, Köbel M, Berger S, et al. Expression ofcyclooxygenase 2 in human malignant melanoma[J].Cancer Res,2001, 61(1): 303-8. |
| [20] | An KP, Athar M, Tang X, et al.Cyclooxygenase-2 expression inmurine and human nonmelanoma skin cancers: implications fortherapeutic approaches[J].Photochem Photobiol, 2002, 76(1):73-80. |
| [21] | Fischer SM. Is cyclooxygenase-2 important in skin carcinogenesis[J].J Environ Pathol Toxicol Oncol, 2002, 21(2): 183-91. |
| [22] | Fürstenberger G, Marks F, Müller-Decker K.Cyclooxygenase-2and skin carcinogenesis[J].Prog Exp Tumor Res, 2003, 37: 72-89. |
| [23] | Vogel U, Christensen J, Wallin H, et al. Polymorphisms in COX-2,NSAID use and risk of basal cell carcinoma in a prospective studyof Danes[J].Mutat Res, 2007, 617(1-2): 138-46. |
| [24] | Elmets CA, Viner JL, Pentland AP, et al. Chemoprevention ofnonmelanoma skin cancer with celecoxib: a randomized, doubleblind,placebo-controlled trial[J].J Natl Cancer Inst, 2010,102(24): 1835-44. |
| [25] | Hassan E. Recall bias can be a threat to retrospective andprospective research designs[J]. Int J Epidemiol, 2005, 3(2): 4-4. |
| [26] | Asgari M, White E, Chren MM. Nonsteroidal anti-inflammatorydrug use in the prevention and treatment of squamous cellcarcinoma[J].Dermatol Surg, 2004, 30(10): 1335-42. |
 2014, Vol.41
2014, Vol.41





