2.医学生物学研究所分子生物室
2. Department of Molecular Biology, Institute of Medical Biology
近年来,我国乳腺癌的发病率呈增长趋势。 乳腺癌的病因尚未完全清楚,但有研究表明, 细胞骨架连接质膜蛋白 [solute carrier family 9 (sodium/hydrogen exchanger),member 3 regulator 1,SLC9A3R1]与肿瘤尤其是乳腺癌的进展有密 切关系[ 1, 2 ],若抑制SLC9A3R1高表达的乳腺癌 细胞系T47D和MCF7中的SLC9A3R1表达,乳腺 癌细胞的增殖能力增强[ 3 ]。磷酸化肿瘤抑制基因 PTEN(phosphatase and tensin homology deleted on chromosome ten)是一个抑癌基因,具有磷酸酶的 活性,可参与细胞周期调控、促进细胞凋亡及抑 制肿瘤的发生。SLC9A3R1的表达可影响PTEN蛋 白的表达,并通过影响其相关信号转导通路进一 步影响乳腺癌的恶性表型[ 4 ]。SLC9A3R1基因突变 是否是乳腺癌恶性表型发生的主要原因,目前还 没有明确报道。MDA-MB-231细胞中的SLC9A3R1 基因发生突变几乎不表达SLC9A3R1,因此恶性 程度高且具有很强的迁移能力[ 5 ]。为了明确这些特 性是否与SLC9A3R1基因的突变有密切关系,本 研究在SLC9A3R1基因突变的MDA-MB-231乳腺 癌细胞系中,通过转染SLC9A3R1质粒并用G418 筛选,获取稳定表达SLC9A3R1的细胞系,观察 SLC9A3R1过表达是否可使其恶性表型(不受控制 的细胞生长和侵袭转移行为)发生逆转,恢复正常 表型。 1 材料与方法 1.1 材料与试剂 菌株E. coli DH5α、MDA-MB-231细胞、真核表 达质粒pBK-CMV-HA和重组表达质粒pBK-CMVHA- SLC9A3R1wt为天津市放射医学与分子核医学 重点实验室保存和构建。
各种限制性内切酶购自Takara公司。1640培 养液、小牛血清和青/链霉素购自Hyclone公司。 FuGENE转染试剂购自Roche公司。anti-HA抗体购 自MBL公司。HRP标记的羊抗鼠和羊抗兔二抗均 购自北京中杉金桥公司。ECL化学发光试剂盒购 自Pierce Biotech公司。CCK-8试剂盒购自上海同仁 化学研究所。低熔点琼脂糖购自Invitrogen公司。 凋亡检测试剂盒购自北京宝赛生物技术有限公 司。其他试剂均为国产分析纯。 1.2 方法 1.2.1 真核表达载体的构建
质粒的提取、酶切及DNA片段的回收、连接 和转化参照Pan等[ 3 ]的方法进行。将表达载体pBKCMV- HA和已连接于T载体的SLC9A3R1-wt片段分 别用EcoRⅠ和XhoⅠ双酶切成粘端,凝胶电泳后切 胶回收,连接,转化大肠杆菌DH5α,抗性筛选。 获取阳性克隆后,提取质粒进行测序,确证所得 的pBK-CMV-HA-SLC9A3R1-wt阳性克隆具有正确 的序列及读码框。 1.2.2 细胞培养及稳定转染细胞系的建立
MDA-MB-231细胞在含10%小牛血清及1%青 霉素和链霉素的1640培养液中,于37℃、5%CO2 的培养箱中培养。
以2 μg重组质粒DNA通过FuGENE介导转 染MDA-MB-231细胞,用含有浓度为350 μg/ml G418(Geneticin,庆大霉素的氨基糖苷)的筛选培养 基筛选3~4周后得到抗性细胞克隆。消化分离后用 G418的维持培养液进行培养和传代。 1.2.3 细胞生长曲线测定(酶标仪Molecular Devices, SPECTRA max M2,450 nm波长)
细胞接种于96孔板,每孔细胞数为2.5×103 个。每隔24 h以CCK-8试剂盒测定细胞数,连续测 定7 d,每次设置4个平行样本,至少重复3次。 1.2.4 Western blot检测
取各组细胞裂解液20 μl,经8% SDS-PAGE电 泳后,转移到硝酸纤维素膜上,封闭1 h。抗HA 抗体4℃过夜,偶联有辣根过氧化物酶的羊抗兔二 抗室温反应1 h,采用ECL显色方法进行显色。用 Image J图像分析系统对Western blot实验结果进行 分析。 1.2.5 集落形成分析(soft agar assay)
用三蒸水分别制备1.2%和0.7%两个浓度的低 溶点琼脂糖液体,高压灭菌后,40℃维持,使之 保持溶解状态。无菌制备2×1640培养液(含2×抗 生素和20%小牛血清),保存在37℃中。按1:1混合 1.2%的琼脂糖和2×1640培养液后,取1 ml混合液 注入直径35 mm的培养皿中,待冷却凝固后,置 入培养箱中备用。消化指数增殖期的细胞,用培 养液制成细胞悬液,计数。按1:1比例将0.7%琼脂 糖和2×1640培养液在无菌试管中混合后,再向管 中加入0.2 ml单细胞悬液,充分混匀、注入已铺有 1.2%琼脂糖的培养皿中,加入量同上,每皿接种 5 000个细胞,待上层琼脂糖凝固后,置入培养箱 中,培养10~14 d。LEICA DMIRB显微镜观察细胞 克隆形成情况,计数直径>25 μm的集落,3复孔算 均值,集落形成率=集落数/接种细胞数×100%。 1.2.6 细胞凋亡分析
Annexin V-FITC/PI双染流式细胞仪分析检测 细胞凋亡率。接种细胞后24 h收集并洗涤细胞,以 500 μL结合缓冲液悬浮细胞,加入10 μL Annexin V-FITC混匀,室温避光反应10 min,加入5 μL PI 混匀,室温避光反应5 min,1 h内用流式细胞仪 (BECKMAN COULTER Cell,EPICS XL)分析。
以上所有实验重复3次。 1.3 统计学方法
采用SPSS 11.5统计软件分析结果。生长曲线 测定结果用重复测量t检验进行分析。集落形成和 凋亡结果采用独立样本t检验进行统计学分析。 P<0.05为差异有统计学意义。 2 结果 2.1 稳定转染MDA-MB-231细胞系的Western blot 法鉴定
分别将转染了pBK-CMV-HA-SLC9A3R1重组 质粒及pBK-CMV-HA载体的MDA-MB-231细胞 接种于35 mm细胞培养皿,接种数为1×106,待细 胞贴壁后用上样缓冲液刮取细胞并超声裂解,取 10 μl经8% SDS-PAGE电泳后,转移到硝酸纤维 素膜上,通过HA抗体进行蛋白质印迹实验,用 Image J图像分析系统对Western blot实验结果进行 扫描分析,确保获得稳定表达SLC9A3R1的阳性 克隆,见图 1。将空载细胞命名为HA231,将含有 SLC9A3R1蛋白的细胞命名为E231。
 |
1:cells tranfected with vector-HA231;2:cells transfected with recombinant plasmid-E231 图 1 Western blot检测SLC9A3R1在MDA-MB-231细胞系 的稳定表达 Figure 1 Stable SLC9A3R1 expression in MDA-MB-231 cell line detected by Western blot |
CCK-8试剂盒测试结果显示,SLC9A3R1可使 MDA-MB-231细胞的增殖能力明显减弱,达50% 以上。E231细胞与低表达SLC9A3R1的231及空载 对照HA231相比,第5、6及7天均有明显差异(第5 天P=0.0016,第6天P=0.002,第7天P=0.006),而 231细胞与HA231相比,在实验天数内没有差异, 见图 2。
 |
*:P<0.01,the proliferative ability of E231 cell with SLC9A3R1 overexpression was significantly inhibited,compared with either 231 cells or HA231 cells,especially on day 5,6 and 7 图 2 稳定表达SLC9A3R1的MDA-MB-231细胞系的生长 曲线 Figure 2 Growth curves of MDA-MB-231 cell line with stable SLC9A3R1 expression |
软琼脂集落形成实验结果表明,MD A - MB-231细胞、整合了空载体的细胞和整合了 SLC9A3R1的细胞集落形成率分别为(2.9±0.47)%、 (2.52±0.08)%和(1.33±0.33)%。表明SLC9A3R1过 表达可使MDA-MB-231细胞系锚定无关的增殖能 力(anchorage-independent growth)明显减弱,达 47%(P=0.007)。 2.4 SLC9A3R1过表达的MDA-MB-231细胞系凋 亡百分比的变化
将HA231细胞和E231细胞接种于90 mm的培 养皿,过夜培养,用Annexin V-FITC/PI双染方法 结合流式细胞仪对其凋亡细胞百分比进行检测, 共进行3次独立实验。选其中典型凋亡结果见图 3。结果显示,所检测的细胞坏死率均较低,符 合凋亡检测所要求的坏死比率。整合了空载体的 MDA-MB-231细胞和整合了SLC9A3R1的细胞凋亡 百分比分别为(2.23±1.41)%和(9.23±2.97)%。表明 SLC9A3R1过表达可使MDA-MB-231细胞系凋亡百 分比明显增多,见图 3,达4倍以上 (P=0.018)。
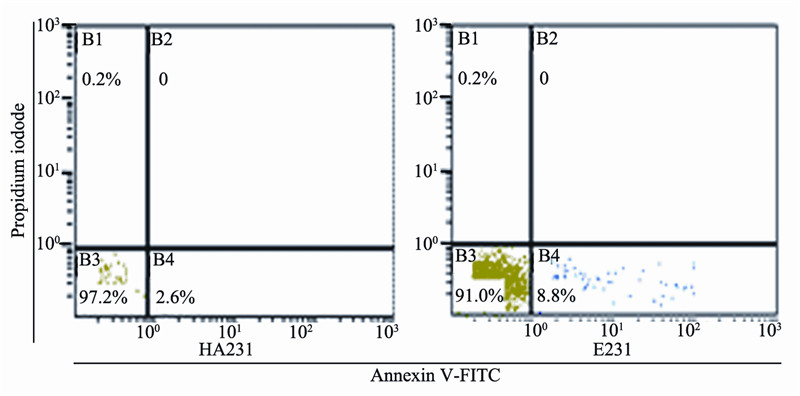 |
图 3 稳定表达SLC9A3R1的MDA-MB-231细胞系凋亡百分比 Figure 3 Apoptosis percent of MDA-MB-231 cell line with stable SLC9A3R1 expression |
随着我国乃至全球乳腺癌发病率和死亡率的 增加,人们对乳腺癌发病机制和治疗的研究日益 深入。各种证据表明,SLC9A3R1与肿瘤发生发展 关系密切,可能是一个潜在的抑癌蛋白[ 6 ],尤其在 乳腺癌中[ 2, 3 ]。近期有研究指出,利用SLC9A3R1蛋 白的表达情况可提高预测Ⅱ级侵袭性乳腺癌临床结 果的准确性,对于乳腺癌的诊断有显著作用[ 2, 3 ]。 细胞质内SLC9A3R1蛋白表达水平的改变在确定肿 瘤发生、发展及侵袭程度方面扮演重要角色。此 外,SLC9A3R1蛋白的过表达还与肿瘤组织学等级 的增加、临床症状的加重、预后不良及肿瘤组织 缺氧的严重程度有关[ 2, 7, 8 ]。因此,证实SLC9A3R1 是抑癌蛋白将为肿瘤的诊断、治疗和药物研发提 供新靶标。在各种乳腺癌细胞系中,SLC9A3R1的 表达水平差异较大。抑制SLC9A3R1高表达的乳腺 癌细胞系中的SLC9A3R1表达后,可明显促进乳腺 癌细胞的增殖能力[ 3,8 ]。而将SLC9A3R1表达质粒转 入SLC9A3R1表达缺失的乳腺癌细胞,是否可减缓或 逆转乳腺癌细胞的恶性表型是本研究的主要目的。
SLC9A3R1作为一种细胞支架蛋白,其功 能将会由于结合蛋白的不同而具有明显的多样 性。SLC9A3R1抑癌作用的分子机制也较为多 样。SLC9A3R1能够与质膜上不同部位的膜受体 结合;SLC9A3R1能够在细胞间黏附连接(adherens junctions,AJs)处与EGFR和NF2形成蛋白复合体[ 9 ], 从而阻止EGFR的内化和信号转导;SLC9A3R1也能 与PDGFR结合,并且和NF2形成信号转导复合体[ 10 ], 减弱PDGFR的信号转导。而活化的PDGF信号能够 阻止细胞在上皮细胞向间质细胞的转变过程中发 生凋亡,促进乳腺癌的发展和转移[ 11 ]。PTEN抑癌 蛋白是一种磷酸肌酸磷酸酶,能够拮抗磷脂酰肌 醇3磷酸激酶PI3K[ 12 ],SLC9A3R1在鼠胚成纤维细 胞[ 7 ]和乳腺癌细胞[ 13 ]中结合PDGFR和PTEN抑癌蛋 白,形成信号转导复合体,从而抑制PDGFR的信 号转导,同时可促进细胞凋亡。由SLC9A3R1介导 形成的信号转导复合体在PDGF刺激下抑制了PI3K 通路的活性。
某些乳腺癌细胞系如T47D、MCF7中,本身 即存在SLC9A3R1的表达,但并未体现出肿瘤抑制 作用,如果SLC9A3R1的表达被抑制后,这些细胞 系的恶性表型都得到明显的增强[ 3 ]。表明这些肿瘤 细胞系中SLC9A3R1的表达水平并未达到抑制肿瘤 增殖的水平。此外,已发现SLC9A3R1有30多种 结合蛋白[ 14 ],而这些肿瘤细胞中较低的SLC9A3R1 表达水平将会导致它无法与肿瘤抑制蛋白结合, 难以发挥它的抑癌功能。另一个原因则可能是不 同的细胞系和组织具有不同的遗传背景,即使 SLC9A3R1达到了相同的表达水平,在不同的遗传 背景下,SLC9A3R1也可能会与不同的结合蛋白结 合,而产生不同的功能。
本实验所采用的MDA-MB-231乳腺癌细胞系 不表达SLC9A3R1,我们通过质粒转染使其表达 SLC9A3R1。结果表明SLC9A3R1过表达能够抑 制肿瘤细胞的增殖。SLC9A3R1过表达的MDAMB- 231细胞增殖速度要低于空质粒转染组。同 时,在软琼脂中,SLC9A3R1过表达的细胞系比 MDA-MB-231细胞和转染了pBK-CMV-HA空质粒 的细胞集落形成率明显降低,表明SLC9A3R1过表 达能够抑制乳腺癌细胞的锚定非依赖生长。本实 验并未发现SLC9A3R1可导致明显的细胞周期阻 滞,但在SLC9A3R1过表达细胞的G1峰前出现亚 G1峰,表明SLC9A3R1可能诱导了细胞的凋亡。进 一步的实验表明,SLC9A3R1的确造成了细胞凋亡 比例的上升。细胞凋亡与细胞增殖、分化都是细 胞的基本生命活动,三者密切相关,其平衡失调 与肿瘤的发生发展有关[ 15 ]。细胞凋亡在肿瘤的发 生发展中主要起负调控作用,可抑制肿瘤细胞生 长。因此本研究表明SLC9A3R1可能是通过促进肿 瘤细胞凋亡来抑制肿瘤细胞增殖的。Pan等[ 3 ]的研 究表明,抑制SLC9A3R1表达将促进细胞的G1~S周 期转换和增强乳腺癌细胞的cyclin E的表达,使细 胞增殖能力增强。此结论与本研究的实验结果可 相互佐证。
总之,本研究表明SLC9A3R1过表达可显著 抑制MDA-MB-231细胞的恶性生物学行为(增殖能 力、集落形成能力),此结果与Pan[ 3 ]和Takahashi[ 7 ] 的结果一致。此外,SLC9A3R1过表达可显著促 进MDA-MB-231细胞的凋亡。因此,有理由认为 SLC9A3R1具有抑制乳腺癌MDA-MB-231细胞增 殖的作用,并且其抑制乳腺癌增殖的作用与促进 MDA-MB-231细胞凋亡有关。尽管我们能够通 过生长因子及其受体与SLC9A3R1抑癌蛋白形成 复合体或是促进β-catenin蛋白稳定于膜表面来解 释SLC9A3R1抑制肿瘤增殖的作用[ 16, 17 ],但尚需 研究其他相关跨膜配体,因为它们同样可能增强 SLC9A3R1的抑癌作用。综上所述,本研究结果进 一步明确了SLC9A3R1的抑癌作用,有望成为一种 候选乳腺癌抑制蛋白,为乳腺癌的临床治疗提供 新的药物靶标。
| [1] | Georgescu MM, Morales FC, Molina JR,et al. Roles of NHERF1/EBP50 in cancer[J]. Cur Mol Med, 2008,8(6):459-68. |
| [2] | Malfettone A, Saponaro C, Paradiso A, et al. Peritumoral vascularinvasion and NHERF1 expression define an immunophenotype ofgrade 2 invasive breast cancer associated with poor prognosis[J].BMC cancer,2012,12:106. |
| [3] | Pan Y, Wang L, Dai JL. Suppression of breast cancer cell growthby Na+/H+ exchanger regulatory factor 1 (NHERF1)[J]. BreastCancer Res, 2006,8(6):R63. |
| [4] | Cuello-Carrión FD, Cayado-Gutiérrez N, Natoli AL, et al. InMMTV-Her-2/neu transgenic mammary tumors the absenceof caveolin-1-/- alters PTEN and NHERF1 but not β-cateninexpression[J]. Cell Stress Chaperones, 2013,18(5):559-67. |
| [5] | Dai JL, Wang L, Sahin AA, et al. NHERF (Na+/H+ exchangerregulatory factor) gene mutations in human breast cancer[J].Oncogene, 2004,23(53):8681-7. |
| [6] | Karn T, Ruckh?berle E, Hanker L, et al. Gene expressionprofiling of luminal B breast cancers reveals NHERF1 as a newmarker of endocrine resistance[J]. Breast Cancer Res Treat,2011,130(2):409-20. |
| [7] | Takahashi Y, Morales FC, Kreimann EL, et al. PTEN tumorsuppressor associates with NHERF proteins to attenuate PDGFreceptor signaling[J]. Embo J, 2006,25(4):910-20. |
| [8] | Bellizzi A, Malfettone A, Cardone RA, et al. NHERF1/EBP50in breast cancer: clinical perspectives[J]. Breast Care(Basel),2010,5(2):86-90. |
| [9] | Curto M, Cole BK, Lallemand D, et al. Contact-dependentinhibition of EGFR signaling by Nf2/Merlin[J]. J Cell Biol,2007,177(5):893-903. |
| [10] | James MF, Beauchamp RL, Manchanda N, et al. A NHERFbinding site links the betaPDGFR to the cytoskeleton andregulates cell spreading and migration[J]. J Cell Sci, 2004,117(Pt14):2951-61. |
| [11] | Malavaki CJ, Roussidis AE, Gialeli C, et al. Imatinib as a keyinhibitor of the platelet-derived growth factor receptor mediatedexpression of cell surface heparan sulfate proteoglycansand functional properties of breast cancer cells[J]. FEBS J,2013,280(10):2477-89. |
| [12] | Govatati S, Kodati VL, Deenadayal M, et al. Mutations in thePTEN tumor gene and risk of endometriosis: a case-controlstudy[J]. Hum Reprod, 2014,29(2):324-36. |
| [13] | Pan Y, Weinman EJ, Dai JL. Na+/H+ exchanger regulatory factor1 inhibits platelet-derived growth factor signaling in breast cancercells[J]. Breast Cancer Res, 2008,10(1):R5. |
| [14] | Georgescu MM, Morales FC, Molina JR, et al. Roles of NHERF1/EBP50 in cancer[J]. Cur Mol Med, 2008,8(6):459-68. |
| [15] | Cazzaniga M, Decensi A, Pruneri G, et al. The effect of metforminon apoptosis in a breast cancer presurgical trial[J]. Br J Cancer,2013,109(11):2792-7. |
| [16] | Kreimann EL, Morales FC, de Orbeta-Cruz J, et al. Corticalstabilization of beta-catenin contributes to NHERF1/EBP50 tumorsuppressor function[J]. Oncogene, 2007,26(36):5290-9. |
| [17] | Wheeler DS, Barrick SR, Grubisha MJ, et al. Direct interactionbetween NHERF1 and Frizzled regulates beta-catenin signaling[J].Oncogene, 2011,30(1):32-42. |
 2014, Vol.41
2014, Vol.41



