肝癌(hepatocelluiar carcinoma,HCC)是全球 最常见的恶性肿瘤之一,其死亡率居消化系统第 三位,每年导致50万~100万人死亡[ 1 ]。我国肝癌患 者占全世界的58.7%,在所有恶性肿瘤中,肝癌的 发病率和死亡率一直占据前列[ 2 ]。临床研究数据表 明糖尿病可使肝癌的患病风险增加2~3倍[ 3, 4 ],但这 一机制因缺乏深入研究至今仍未明确。趋化因子 CCL5(RANTES)是一种可诱导的分泌型小分子 量炎症细胞因子,经病毒感染后的正常细胞和部 分肿瘤细胞均能分泌CCL5[ 5 ],近年来发现其与肿 瘤细胞的侵袭和转移有密切的关系,体内高表达 的CCL5可诱发恶性肿瘤[ 6, 7 ]。本研究通过不同糖浓 度培养人肝癌细胞株HepG2和鼠源性肝癌细胞株 H22,检测高糖对细胞中CCL5mRNA表达的影响, 对比糖尿病小鼠和正常血糖小鼠的成瘤能力,并且 检测瘤组织中CCL5的表达,由此来验证CCL5在糖 尿病模型鼠致肝癌的发生、发展起重要作用。 1 材料和方法 1.1 材料
清洁级BALB/c小鼠60只,雄性,5周龄,体 质量(25±3)克,由南昌大学实验动物科学部提 供,动物合格证号: SYXK(赣)2010-0002。人 肝癌细胞株HepG2和小鼠肝癌细胞株H22均来自 南昌大学第二附属医院分子实验室;低糖DMEM 培养液[含葡萄糖(glucose,Glu)5.5 mmol/L]、高糖 DMEM培养液(含Glu25 mmol/L)、10%胎牛血 清购自北京Gibco公司;RNA提取试剂盒购自美国 OMEGA公司;反转录试剂盒由广州复能公司提 供;PCRmix试剂盒购自上海近岸生物公司;PCR 引物由上海生工生物工程公司合成。链脲佐菌素 (STZ)购由美国Sigma公司,稳步血糖仪及试纸 由美国强生公司提供;鼠源性CCL5免疫组织化学 抗体购自美国Abcam公司。 1.2 方法 1.2.1 细胞划痕实验
取长势良好的HepG2细胞,将计数调整至1×105/ml。 将细胞接种到含有低糖培养液(含Glu 5.5 mmol/L)、中 糖培养液(含Glu 15 mmol/L )、高糖培养液(含Glu 25 mmol/L )的六孔板中,待细胞贴壁后取10 μl无菌枪头 在六孔板中分别划线,PBS清洗两遍,加入培养液后继 续培养48 h观察细胞的迁移能力。 1.2.2 不同糖浓度培养HepG2细胞检测CCL5 mRNA表达
低糖、高糖培养人肝癌HepG2细胞2周,离心 获得细胞。根据RNA提取试剂盒说明书分别提取 总RNA,紫外分光光度仪下测A值A260/A280大于1.8, 证明提取到的总RNA纯度符合实验要求。各样品采 用反转录试剂盒进行反转录cDNA合成。PCR扩增 CCL5基因,上游引物序列:5’-CGCTGTCATCCTC ATTGCTA-3’;下游引物序列:5’-GCACTTGCCAC TGGTGTAGA-3 ,目的片段长度148 bp 。以GAPDH 为内参基因,上游引物序列:5’-ACAGTCAGCCG CATCTTCTT-3’;下游引物序列:5’-GACAAGCT TCCCGTTCTCAC-3’,目的片段长度256 bp。采用 PCRmix试剂盒,取3 μlcDNA,加入PCR mix 25 μl、 上下游引物各1 μl、ddH2O 20 μl配制总体积至50 μl 体系。经94℃灭活90 s,30个循环,94℃ 30 s、56℃ 30 s、72℃ 30 s进行PCR扩增。琼脂糖凝胶电泳,软 件分析条带亮度。 1.2.3 不同糖浓度培养H22细胞检测CCL5 mRNA 表达
低糖、高糖培养小鼠肝癌H 2 2 细胞株2 周,离心获得细胞后提取总R N A ,反转录 cDNA,小鼠CCL5 基因引物序列: 上游引物: 5’-CCCTCACCATCATCCTCACT-3’;下游引物: 5’-CTTCTTCTCTGGGTTGGCAC-3’,目的片 段长度218 bp。小鼠看家基因SDHA上游引物: 5’-AGGTATCAATGCTGCTCTGG-3’;下游引物: 5’-AAGTAGGTTCGCCCGTAG-3’,目的片段长度 477 bp,PCR步骤同上一步。人肝癌细胞株HepG2 和鼠肝癌细胞株H22在低糖(含Glu 5.5 mmol/L) 和高糖(含Glu 25 mmol/L)培养2周后离心获得细 胞。产物扩增于2%琼脂糖凝胶电泳。 1.2.4 荷瘤小鼠的构建
BALB/c小鼠购进后自然光照,自由进水进 食。随机分为两组:A组为糖尿病模型鼠共30只; B组为正常对照组共30只。 A组喂养2周后通过链 脲佐菌素(STZ)腹腔小剂量多次注射构建糖尿病鼠 模型,注射前8 h禁食,正常进水。 STZ溶于柠檬 酸缓冲液(0.1 mol,pH4.5)配成的注射液,小鼠 称重后按80 mg/kg注射入腹腔,连续注射5 d;B组 一次性注入同样剂量的柠檬酸缓冲液,并喂以普 通饮食。腹腔注射后不同时间(3天、1周、2周) 点取A组鼠尾静脉血,经快速血糖仪检测,连续3 次测得空腹血糖≥16.7 mmol/L,并出现多饮、多 食、多尿和体重减轻,即可确定糖尿病鼠模型构 建成功。测B组空腹血糖≤6.9 mmol/L,为正常普 通鼠。BALB/c小鼠肝癌模型造模方法:取长势良 好的鼠源性肝癌细胞株H22,经过离心收集细胞。 用4℃无血清培养液稀释细胞,并调整细胞计数至 2×107,且尽量在30 min内用完保持细胞活性。小 鼠胸壁5~6肋间皮下注射各组细胞悬液0.2 ml。两 组小鼠模型种植肿瘤细胞株后,继续以正常饮食 喂养,每日观察成瘤情况,待模型成瘤15天后全 部灭杀。剖腹暴露,用游标卡尺测量各组成瘤体 积(V=ab2/2),切取肿块后并称重。10%中性福 尔马林液固定72 h,脱水、石蜡包埋。 1.2.5 瘤组织免疫组织化学检测CCL5表达
石蜡切片放入65℃烤箱30 min,常规脱蜡、水 化,PBS漂洗3次;抗原微波修复,PBS漂洗3次; 3%H2O2甲醛溶液覆盖10 min灭活内源性过氧化物 酶,PBS清洗3次,CCL5一抗4℃孵育12 h,PBS 漂洗3次;二抗37℃孵育30 min,PBS漂洗3次后使 用DAB显色,显微镜下观察后蒸馏水清洗终止染 色,苏木精对比染色细胞核,经分化、脱水、透 明、中性树脂封片。每张免疫组织化学切片显微 镜下放大400倍随机拍取8个视野,利用Image-pro plus 6.0软件进行图像分析,校正吸光度后软件自 动选取阳性的细胞标上颜色[ 8 ],并得出各组切片中 阳性细胞平均密度数据。 1.3 统计学方法
采用SPSS20.0统计软件进行数据处理,两者 间均数比较用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 不同糖浓度HepG2细胞迁移能力
细胞铺板划线48 h后观察HepG2细胞株融合随 糖浓度的增加而加快,见图 1,且发现高糖培养液 颜色呈黄色,低糖培养液呈酚红色。
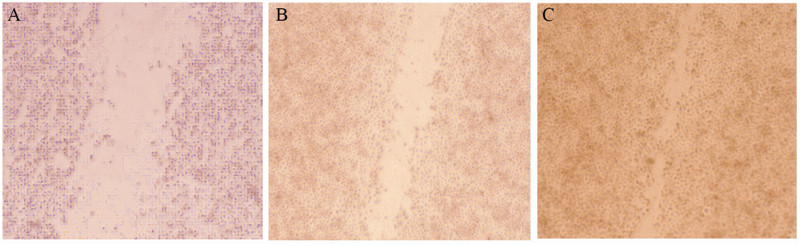 |
M:A:Cells were cultured with 5.5 mmol/L of Glu for 48 h;B:Cells were cultured with 15 mmol/L of Glu for 48 h;C:Cells were cultured with 25 mmol/L of Glu for 48 h 图 1 不同糖浓度培养HepG2细胞的迁移能力(SP×100) Figure 1 Migration of HepG2 cells cultured with different concentrations of glucose(SP×100) |
高糖(含Glu 25 mmol/L )培养人肝癌细胞株 HepG2的CCL5 mRNA条带亮度高于低糖(含Glu5.5 mmol/L)培养,见图 2A。高糖(含Glu 25 mmol/L ) 培养小鼠H22细胞的CCL5 mRNA条带亮度同样高 于低糖(含Glu 5.5 mmol/L)培养,见图 2B。
 |
M:marker;1,3:internal references of CLL5;2:amplification products
of CCL5 in cells cultured with high concentrations of glucose;4:
amplification products of CCL5 in cells cultured with low
concentrations of glucose A:murine H22 cells;B:HepG2 human hepatoma cells 图 2 小鼠H22细胞和HepG2人肝癌细胞CCL5 PCR电泳结果 Figure 2 PCR electrophoresis results of CCL5 in murine H22 cells and HepG2 human hepatoma cells |
两组小鼠皮下注射H22细胞后,均可见明显的 肿瘤生成,糖尿病小鼠和正常小鼠的平均体质量 分别为(2.21±0.52)、(1.63±0.68)g(P<0.05), 肿瘤的平均体积分别为(3.4±0.42)、(2.18± 0.55)cm3(P<0.05)。可见肿瘤已与皮肤充分 融合,并且出现坏死,切开皮肤可见肿瘤呈圆形 或椭圆形,瘤表面呈现结节状且与皮肤粘连,表 面毛细血管丰富,切面呈灰白色、鱼肉状,见大 量坏死,远处淋巴结未见转移。镜下观察成瘤组 织,可见瘤细胞大小较为均匀,细胞核大深染, 大小形态不规则,核染色不均匀,胞质少,偶见 病理性核分裂相,部分小淋巴细胞浸润,见图 3。 免疫组织化学显示CCL5在各组均有散在表达, IPP6.0分析吸光度数据,单因素方差分析(LSD 法),结果显示A组CCL5的表达高于B组,见图 3,两者间比较差异均有统计学意义(P<0.05)。
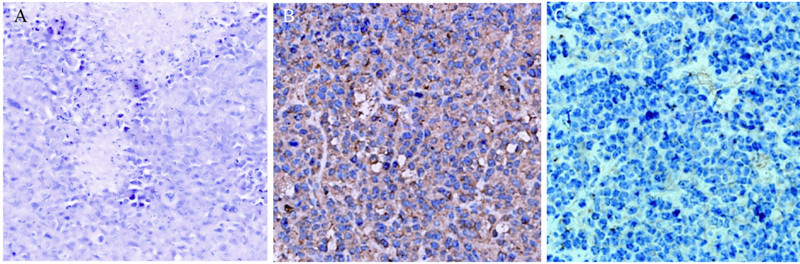 |
A:mass laminar necrosis with heterocysts and mitotic images(HE ×400);B:positive claybank staining in the cytoplasm in a scattered or flaked distribution(IHC×400);C:light yellow staining in the cytoplasm(IHC ×400) 图 3 CCL5在瘤组织中的HE染色和免疫组织化学染色结果 Figure 3 HE and immunohistochemical staining of the expression patterns of CCL5 in different tumor tissues |
肿瘤的侵袭和转移是肿瘤细胞与外基质之 间一系列复杂的多因素的相互过程。目前研究表 明,肝癌的预后和复发率与糖尿病有密切的关 系,糖尿病合并肝癌患者手术切除后复发率和死 亡率显著高于非糖尿病患者[ 8, 9 ]。糖尿病可增加肝 癌的患病风险并加快肿瘤生长转移,其中的机制 非常复杂,大量的文献报道了体内高糖可刺激细 胞DNA损伤,导致细胞变异诱发肿瘤[ 10, 11 ]。正常 的血糖可通过有氧和无氧代谢为机体提供能量, 而高浓度的血糖可在肿瘤细胞内进行无氧酵解, 为肿瘤细胞提供能量来源。我们在细胞培养过程 中发现,高糖培养人肝癌细胞株HepG2中培养液 呈黄色,而低糖培养为酚红色,这表明高糖培养 的HepG2细胞代谢能力强,释放含酸物种增多, 耗尽培养液中的营养物种。于是,我们设想高糖 是否刺激了某种因子使肿瘤细胞生长旺盛,导致 了糖尿病患肝癌的发生增加。
我们利用Gene Sifter在线软件和BRB- Array Tools 对公共基因芯片数据库GEO(Gene Expression Omnibus)分析肝癌病人瘤细胞的基因 芯片表达数据的统计学差异,发现趋化因子CCL5 (RANTES)可能在糖尿病诱发肝癌起重要作 用。实验数据也表明体外高糖培养肿瘤细胞中的 CCL5含量显著高于低糖培养,说明高血糖可使 肿瘤细胞中的CCL5含量增高,而体内高表达的 CCL5可通过聚集和活化肿瘤细胞中基质金属蛋 白酶(matrix metalloproteinase,MMP),特别是 MMP中的MMP9,可以促进肿瘤血管的生成和生 物活性,从而加快肿瘤的生长于转移[ 7 ]。最近有研 究还发现CCL5可被肿瘤细胞或炎症细胞分泌到肿 瘤组织中,在体内的恶性肿瘤的发展、浸润中扮 演重要角色,同时参与肿瘤组织内血管的生成[ 6 ]。
本实验通过不同糖浓度培养人肝癌细胞株 HepG2证实了高糖可使细胞的迁移能力增强,且 高糖培养可使细胞内CCL5呈现较高表达,动物实 验也表明糖尿病BALB/c小鼠更易于肝癌的生长, 检测糖尿病鼠瘤组织中CCL5含量高于正常血糖 鼠,较高表达的CCL5会对肿瘤的生长、转移发挥 促进作用,从而为CCL5为糖尿病促进肝癌细胞的 生长、转移奠定实验基础。由于BALB/c小鼠基因 组与人类同源性达90%以上,小鼠肿瘤在组织形 态、临床过程方面都与人类肿瘤有着相似之处[ 12 ]。 因此,本实验将为研究人体糖尿病诱发肝癌发生 提供可靠的理论依据。因实验组未能收集到足够 的糖尿病合并肝癌患者的组织标本,所以没有进 行肿瘤组织内的CCL5检测。下一步,我们将对比 糖尿病合并肝癌患者肿瘤组织与单纯患肝癌瘤组 织内的CCL5表达的差异,进一步证明趋化因子 CCL5在糖尿病合并肝癌患者中发挥重要作用,为 糖尿病合并肝癌的防治提供新思路。
| [1] | Saxena V,Gupta A,Nagana Gowda GA,et al.1H NMR spectroscopy for the prediction of therapeutic outcome in patients with fulminant hepatic failure1H NMR spectroscopy for the prediction of therapeutic out come in patients with fulminant hepatic failure[J]. NMR Biomed,2006,19(5):521-526. |
| [2] | Chen WQ.Estimation of cancer incidencee and mortality in China in 2004-2005[J].Zhonghua Zhong Liu Za Zhi,2009,31(9):664-8.[陈万青.2004-2005年中国恶性肿瘤发病与死亡的估计[J].中华肿瘤杂志,2009,31(9):664-8.] |
| [3] | El-Serag HB,Hampel H,Javadi F.The association between diabetes and hepatocellular carcinoma:a systematic review of epidemiologic evidence [J].Clin Gastroenterol Hepatol,2006,4(3):369-80. |
| [4] | Davila JA,Morgan RO,Shaib Y,et a1.Diabetes increases the risk of hepatocellular carcinoma in the United States: a population based case control study[J].Gut,2005,54(4):533-9. |
| [5] | Marino AP,Silva AA,Santos PV,et al.CC-chemokine receptors: a potential therapeutic target for Trypanosoma cruzi-elicited myocarditis[J].Mem Inst Oswaldo Cruz, 2005,100 Suppl 1: 93-6. |
| [6] | Soria G,Ben-Baruch A.The inflammatory chemokines CCL2 and CCL5 in breast cancer[J].Cancer Lett,2008,267(2):271-85. |
| [7] | Adler EP,Lemken CA,Katchen NS,et al.A dual role for tumorderived chemokine RANTES (CCL5)[J].Immunol Lett,2003, 90(2-3):187-94. |
| [8] | Kraan MC,Smith MD,Weedon H,et al.Measurement of cytokine and adhesion molecule expression in synovial tissue by digital image analysis[J].Ann Rheum Dis,2001,60(3):296-8. |
| [9] | Kawamura Y,Ikeda K,Arase Y,et al.Diabetes mellitus worsens the recurrence rate after potentially curative therapy in patients with hepatocellular carcinoma associated with nonviral hepatitis[J].J Gastroenterol Hepatol,2008,23(11):173946. |
| [10] | Amarapurkar DN,Patel ND,Kamani PM.Impact of diabetes mellitus on outcome of HCC[J].Ann Hepatol,2008,7(2):148-51. |
| [11] | Brownlee M.The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes,2005,54(6):1615-25. |
| [12] | Bemardi R,Grisendi S,Pandolfi PP.Modelling haematopoietic malignancies in the mouse and therapeutical implications[J]. Oncogene,2002,21(21):3445-58. |
 2014, Vol.41
2014, Vol.41



