利用光来治疗疾病已有上千年的历史,随 着光医学的发展,光动力学疗法的理念逐步建 立[1],近40年来,光动力疗法(photodynamic therapy,PDT)在治疗恶性肿瘤的领域得到认可 并成为新的肿瘤治疗方法。PDT是利用光敏剂和 相应波长的光线来引起靶组织(肿瘤细胞)的细 胞凋亡、细胞坏死、血管破坏以及局部免疫作 用,从而诱导细胞毒性作用的治疗方法[2]。可以 说光敏剂的开发和发展在PDT的建立和发展中起 着关键性作用。第一代光敏剂有血卟啉衍生物 (hematoporphyrin derivative,HPD)、二血卟啉酯 或Porfimer sodium(Photofrin)等,第二代光敏剂 主要有卟啉类的衍生物、外源性卟啉。第二代光 敏剂具有组成和结构明确、体内代谢快、作用光 波的波长较长、靶组织选择性高等优点,部分克服了第一代光敏剂的缺点。
本研究将水溶性良好的Photodithazine(二氢 卟吩e6葡萄糖衍生物)作为光敏剂[3, 4],对小鼠B细 胞淋巴瘤进行光动力学治疗。通过体内外实验, 观察Photodithazine/PDT对A20细胞的杀伤效应及 A20淋巴瘤动物模型的抗肿瘤效果,并探讨其可能 的作用机制。 1 材料与方法 1.1 细胞培养
A20细胞株是小鼠B细胞淋巴瘤,获赠于韩国 汉阳大学Joong-Soo Han教授。细胞培养液用添加 10% fetal bovine serum(FBS,Gibco-BRL),0.37% sodium bicarbonate(Amresco,Solon,Ohio), streptomycin/penicillin(Gibco-BRL)的RPMI 1640 培养液,并在37℃ CO2下培养。 1.2 体外光动力学治疗和光学显微镜下观察
光敏剂是水溶性二氢卟吩e6衍生物Photodithazine(ZAO Veta,Moscow,Russia)获赠 于JeongHuan Lee教授(Diatech Korea)。在96孔 细胞培养板中按每孔6×103个细胞种植,24 h后将 浓度为0.125、0.25、0.5、0.75、1.0 μg/ml光敏剂和 培养液的混合液来置换原有培养液。在培养液里 避光培养12 h后,去除含有光敏剂的培养液。再暗 室照射6 J/cm2的663 nm激光。体外光动力学治疗 24 h后,在光学显微镜(Olympus,Japan)下观察 细胞形态的变化。 1.3 水溶性四氮唑(WST-1)细胞增殖检测
体外光动力学治疗后,在96孔细胞培养板的 每个孔加入10μl WST-1溶液 (Beyotime)。37℃ 培养1 h后将96孔细胞培养板在振动器上轻轻搅匀 10 s,酶标仪在450 nm处测吸光度值,检测连续进 行4日。 1.4 体外光动力学治疗后细胞凋亡的检测
采用Annexin V/PI双染色法和流式细胞仪来 检测。 体外光动力学治疗48 h后,离心弃去培 养液的方法收集细胞。每样本细胞数为(1~5)×106/ml,900 g/min离心5 min。 用孵育缓冲液 (10 mmol/L HEPES/NaOH,pH 7.4,140 mmol/L NaCl,5 mmol/L CaCl2)洗涤1次,900 g/min离心 5 min。用孵育缓冲液重悬细胞,添加5 μl Annexin V-FITC solution(BD,Flanklin Lakes,NJ)室温下 避光孵育(10~15)min。900 g/min离心5 min, 沉淀细胞孵育缓冲液洗1次。加入10 μl PI solution (100 μg/ml,BD)溶液4℃下孵育20 min,避光并 不时振动。流式细胞仪分析:流式细胞仪激发光 波长用488 nm,用一波长为515 nm的通带滤器 检测FITC荧光,另一波长大于560 nm的滤器检 测PI。 1.5 动物模型的建立和体内PDT
1×106的A20细胞种植在雌性Balb/c小鼠皮下。 待肿瘤直径平均约8 mm时随机分为4组:对照组、 光敏剂组、照射组及PDT组(即光敏剂+照射)。 PDT实施后每2~3 d用caliper测定肿瘤的长轴(a), 短轴(b),高度(c),肿瘤的体积按a×b×c来计 算,肿瘤大小来分析PDT效果。体内PDT实施方 法:静脉内注射每公斤体重10 mg的光敏剂,3 h后 用光纤维导出相应波长的激光,照射于肿瘤上, 来激活堆积在肿瘤上的光敏剂。所使用的激光总 照射量为300 J/cm2,照射直径为1 cm,照射时间为 10 min。一部分实验动物在PDT治疗48 h后死亡, 采集肿瘤组织,立即放入液氮,待提取蛋白质。 部分动物分别在左右侧各种植细胞,一侧未进行 PDT治疗,另一侧进行PDT治疗,以便肉眼直接观 察肿瘤大小变化。 1.6 蛋白质提取和Western blot
将肿瘤组织用预冷的PBS冲洗2次,擦干水 分后加入液氮捣碎组织。将组织粉末移入1.5 ml microtube后加入细胞裂解液,4℃静置30 min。 12 000 r/min离心10 min,取上清液,用Brad-ford 法进行蛋白定量。总蛋白经SDS-PAGE分离后,转 移至PVDF膜上。用5%脱脂奶粉封闭1 h。随后分 别加入P21、P53、PARP及b-actin(santacruz)等 抗体,室温孵育2 h,用TBST漂洗3次,再加入相 应的二抗,孵育1 h,用TBST漂洗3次。电化学发 光(ECL),暗室曝光,洗片显示蛋白条带。 1.7 统计学方法
所有数据采用SPSS 11.0统计软件进行分析。 数据以均数±标准差(x±s)表示,两组间均数比 较采用t检验,各组间比较采用析因分析,P<0.05 差异有统计学意义。 2 结果 2.1 A20细胞的特性
A20 细胞起源于一个网状细胞肿瘤,属Balb/c 小鼠的B细胞淋巴细胞系,以淋巴母细胞的形态生 长。B细胞特异性抗体CD45R在A20细胞高表达, 见图 1A、1B。A20细胞的形态均匀,在400倍光学 显微镜下显示为表面光滑,中心部较暗边缘明显 的球形细胞,见图 1C。
 |
CD45R was highly expressed on the surface of A20 cells(A:isotype antibody;B:CD45R antibody). Morphology of A20 cells before and after PDT were observed(C:control;D:PDT). Cellular swelling(red arrow) and shrinkage(yellow arrow) were observed simultaneously in the same field, 24h after 0.50 μg/ml Photodithazine/PDT treatment. Bar:50 μm 图 1 A20细胞株中CD45R的表达及形态学变化 Figure 1 CD45R expression and morphological changes in A20 cell line |
体外研究中PDT后A20细胞形态有了明显的变 化:细胞表面出现伪足,细胞肿胀或收缩,见图 1D。作为对照,设置了三种细胞:分别为对照组 (未进行任何处理的细胞),照射组(仅进行激 光照射的细胞),光敏剂组(只添加0.5 μg/ml光敏 剂而未进行激光照射的细胞)。此三组细胞形态 在光学显微镜下均未见明显变化。体外光动力治 疗的细胞,即不同浓度光敏剂处理后激光照射的 细胞中不同程度出现了细胞数目的减少和形态变 化。PDT治疗24 h后,在低浓度0.125 μg/ml PDT组 中细胞的形态学变化也不明显,自0.25 μg/ml开始 PDT后上述变化比较明显,0.75 μg/ml PDT及以上 浓度PDT后几乎全部细胞形态变形。使用不同浓 度光敏剂,PDT后A20细胞体外增长均受到抑制, Photodithazine浓度越大,所测定出的OD吸光度越 小。24 h后0.50 μg/ml浓度以上PDT组的细胞生长 受到了抑制(P<0.05),48 h后0.25 μg/ml浓度组 细胞生长较对照组也明显抑制(P<0.01)。治疗24 h 后对照组、照射组及光敏剂组的增殖十分相近, 与对照组相比0.125、0.25、0.5、0.75、1.0 μg/ml 光敏剂PDT治疗组的细胞生长率分别为(103.0± 3.4)%,(99.7±4.6)%,(77.5±4.2)%,(38.9 ±8.6)%,(9.9±2.1)%;48 h后分别为(95.0± 3.0)%,(88.8±2.9)%,(58.1±3.1)%,(21.8 ±0.7)%,(7.0±0.9)%,见图 2。
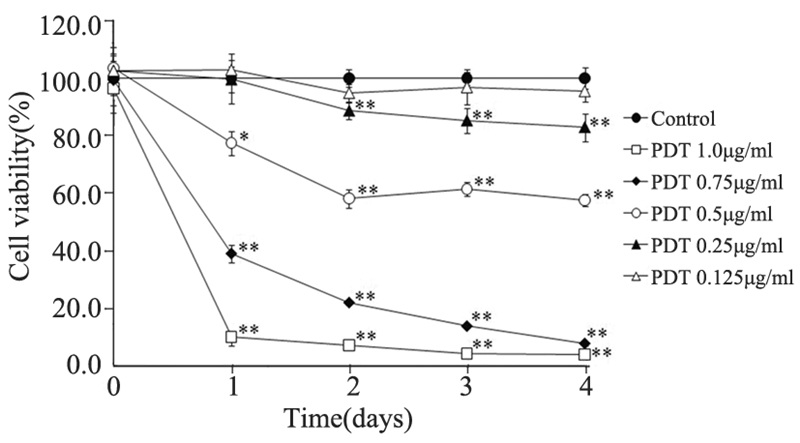 |
A20 cells ( 1×106) were incubated with variousdoses of Photodithazine(0.125-1.0μg/ml)for 12 h at 37℃ and exposed to 6.25 J/cm2 of laser light. The treated cells were further incubated at 37 ℃ for 4 days for WST-1 assay. (*:P< 0.05, **:P<0.01 in t-test with the control group) 图 2 Photodithazine/PDT 实施后淋巴瘤细胞的生存率 Figure 2 The survival rate of lymphoma cells after Photodithazine/PDT |
PDT后24 h,Annexin V/PI双染色流式细胞分 析用于区分凋亡及坏死细胞。流式细胞仪结果, 见图 3。右下象限代表早期凋亡细胞,右上象限 代表晚期凋亡细胞和坏死细胞。在对照组、照射 组、光敏剂组、各浓度PDT治疗组中早期细胞凋 亡率分别为3.5%、4.9%、3.8%、5.5%、8.5%、 8.8%、8.8%、0.4%;除左下象限外三个象限所 占细胞比率为13.3%、14.3%、14.2%、16.7%、 21.7%、36.1%、60.1%、93.9%。
 |
图 3 Annexin V/PI染色后各组A20细胞的细胞凋亡及坏死 Figure 3 Apoptosis and necrosis of A20 cells in each group after Annexin V/PI staining |
自种植1×106的A20细胞4日起可触及皮下结 节,约16日时肿瘤长轴可达8 mm,边界清楚, 见图 4A、4B。形成肿瘤后处死部分实验动物, 提取种植物进行了形态学观察。HE染色显示: 光学显微镜下瘤细胞大小比较一致,弥漫分布, 核大深染,核圆形、卵圆形或不规则形,核染色 质不均匀,胞质极少;用CD45R免疫组织化学染 色后见:所有肿瘤细胞表面深染为棕色,强表达 CD45R,见图 4C、4D。
 |
A: typical large B-cell lymphoma(HE staining); B: atypical lymphoid cells in all regions were clearly stained by CD45R(Immunohistochemistry staining of CD45R). Scale bar: 500μm. The tumor volume was reduced with PDT(C,D left side) compared with that without PDT(C,D right side) 图 4 肿瘤组织的镜下形态及PDT治疗后肿瘤的生长变化 Figure 4 Microscopic findings of tumor tissues and growth changes after PDT |
光动力治疗后,对照组肿瘤仍继续增大, 各径线变长,较对照组PDT组平均肿瘤生长缓 慢,自2周始肿瘤体积减小,差异有统计学意义 (P<0.05),见图 5。从肿瘤组织中提取的蛋白质 表达分析示:P21、P53、Bax 等蛋白的表达比对 照组增加。
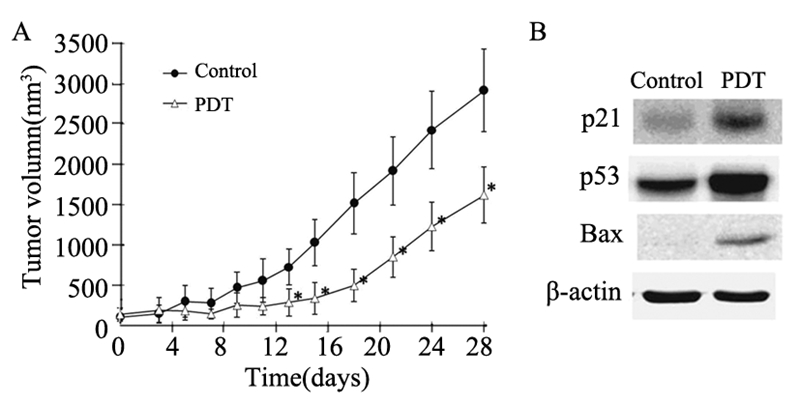 |
A: Tumor volume was measured and calculated every 2-3 days. Tumor growth was inhibited in PDT group versus that in control group ( *:P<0.05);B:Western blot analysis was performed to detect the expression of apoptosis-assotiated protein in tumor tissues, after Photodithazine/PDT treatment for 48h 图 5 Photodithazine/PDT实施后肿瘤的生长曲线及肿瘤组织的蛋白表达 Figure 5 Tumor growth curves and protein expression of tumor tissues after Photodithazine/PDT |
PDT在肿瘤治疗中,通过利用光敏剂和特定 波长光照射后,一系列光动力反应所产生的单线 态氧来选择性破坏肿瘤的。PDT以化学、光物理 学、生理学为基础,结合其他领域的多学科综合性很强的自然学科。为了提高光敏剂的吸收、增 强选择性及快速代谢,各国研究者致力于新的光 敏剂的开发和研究。Photofrin是第一个被批准应用 的光敏剂,目前已在十多个国家获得政府药监部 门批准,用于食管癌、肺癌、膀胱癌、宫颈癌与 皮肤癌的治疗。第二代光敏剂中对5-氨基酮戊酸 (5-ALA)的研究较多,它是血红素的前体,在机 体内经一系列酶促作用,转化为光敏性强的原卟啉 Ⅸ衍生物(PPⅨ),聚集在肿瘤细胞内的PPⅨ,经 激光照射后发生光动力反应,杀伤肿瘤细胞。
本研究选用俄罗斯开发研制的Photodithazine (化学名:N-dimethyl glucamine chlorin),属于 第二代光敏剂,在较长的红色区域有密集的吸收带 (663 nm)[3, 4]。Photodithazine在TC-1小鼠肺癌细 胞中主要被溶酶体吸收,小部分被线粒体吸收[5]。 在此项研究中经6.25 J/cm2的激光照射24 h后,对 照组细胞存活率在0.25、0.5、0.75 μg/ml浓度时分 别约为84.1%、69.2%、28.0%,这与本次结果较 相近,但在各个浓度中对TC-1治疗效果更好,第 一,这可能与细胞形态有关:较A20细胞TC-1的细 胞体积大,附着于培养皿底部生长的有突起的细 胞,A20是球形表面光滑的浮游生长的细胞,故 在细胞表面积上有差异,接收照射面积有差异; 第二,由于A20细胞的形态和生长方式,在同样 的细胞存活研究中增加了起初种植细胞数目为每 孔6×103细胞,最后是照射装备的不同可能小部分 影响到结果。但整体来说,Photodithazine/PDT抑制了肿瘤细胞的生长,且与光敏剂浓度增加而增 强。同样,对照组、照射组和光敏剂组三组的体 外各项实验效果十分相近,对A20细胞均无明显影 响[5]。PDT治疗后电子显微镜下可观察到凋亡细胞 及坏死细胞;Annexin V/PI双染色流式细胞分析中 也观察到右下象限代表早期凋亡细胞,在各浓度 Photodithazine-PDT 后凋亡细胞和坏死细胞数目明 显增加。
A20细胞是B淋巴细胞系,通过尾静脉注射或 皮下注射细胞的方法,用作白血病或淋巴瘤的动物 模型来使用[6, 7, 8]。在本研究中皮下注射1×106的A20 细胞,成瘤率为100%,肿瘤组织形态学检查发现 呈典型的淋巴瘤,且高表达CD45R。因该模型造 模简单、肿瘤边界清楚、易测得肿瘤体积,是理 想的淋巴瘤动物模型。实际PDT应用中光的照射 方法对疗效起着很重要的作用。体内的照射方法 可分为:表面照射(Superficial illumination)、 间质内照射(Interstitial illumination)、管腔内 照射(Intraluminal illumination)、空洞内照射 (Intracavitary illumination)。根据肿瘤生长的方 式,选择合适的照射方法,大多数实验动物模型 采用的是皮下造模方式,故一直以来研究者多采 用间质内照射或表面照射方法[9, 10, 11]。本研究中进 行体内照射方法是投药3 h后一次性表面照射, 照射范围为直径10 mm的圆形区域(肿瘤长径<8 mm)。实施体内PDT48 h后,见大多数肿瘤表面 中央部塌陷,肿瘤生长较对照组缓慢,但基底部 及部分边缘肿瘤组织仍有生长活性继续生长。若 此现象在临床中出现,第二期治疗中应该更改照 射方向或照射方法,治疗效果会更加明显。事实 上在PDT领先国家PDT光传导物质的研究和针对不 同部位肿瘤治疗的照射头研究也是非常积极和细 分化的。结果显示,不仅在体内实验中PDT后肿 瘤体积受到控制,肿瘤组织中提取的蛋白质经蛋 白印记法分析高表达抑癌因子及凋亡因子,分别 为P21、P53、Bax,这与其他光敏剂诱导的PDT在 各种肿瘤的治疗中通过调整P21、P53等蛋白的结 果是相近的[12, 13],也是一个预测中的结果。
PDT作为治疗肿瘤领域中兴起的治疗方法,因 其具有创伤小、毒性低、选择性和适用性好、可 重复治疗等多个优点,而受到越来越多的重视。 光敏剂、光源等核心要素的发展是PDT领域的关 键。世界各国的研究者正积极研发水溶性更好、 选择性更强、代谢更快、稳定性更好的第三代光 敏剂[11, 14, 15],而第三代光敏剂大多数是第二代光敏 剂的衍生物。只有掌握更多关于第一代、第二代 光敏剂对不同肿瘤的特性、效能和机制,才能将 其有效地应用最大化。
| [1] | Moan J, Peng Q. An outline of the hundred-year history of PDT[J]. Anticancer Res, 2003, 23(5A): 3591-600. |
| [2] | Allison R, Moghissi K, Downie G, et al. Photodynamic therapy (PDT) for lung cancer[J]. Photodiagnosis Photodyn Ther, 2011,8(3):231-9. |
| [3] | Tran Thi Hai Yen, Ignat’eva EV, Polozkova AP, et al. Qualitative and quantitative analysis of a new lyophilized liposomal formulation of photodithazine[J]. Pharma Chem J, 2010, 44(6):337-40. |
| [4] | Romanko YS, Tsyb AF, Kaplan MA, et al. Relationship between antitumor efficiency of photodynamic therapy with photoditasine and photoenergy density[J]. Bull Exp Biol Med, 2005,139(4): 460-4. |
| [5] | Wen LY, Bae SM, Do JH, et al. The effects of photodynamic therapy with Photodithazine on HPV 16 E6/E7 associated cervical cancer model[J]. J Porphyrins Phthalocyanines, 2011,15(3):174-80. |
| [6] | Wen LY, Bae SM, Ahn WS. Establishment of leukemia mouse model using mouse-derived A20 leukemic cells, and detection of tumor cells in bone marrow[J]. Lab Anim Res, 2010, 26(4):415-23. |
| [7] | Wen LY, Bae SM, Chun HJ, et al. Therapeutic effects of systemic photodynamic therapy in a leukemia animal model using A20 cells[J]. Lasers Med Sci, 2012,27(2):445-52. |
| [8] | Heier I, Hofgaard PO, Brandtzaeg P, et al. Depletion of CD4+ CD25+ regulatory T cells inhibits local tumour growth in a mouse model of B cell lymphoma[J]. Clin Exp Immunol, 2008, 152(2):381-7. |
| [9] | Ferrario A, von Tiehl KF, Rucker N, et al. Antiangiogenic treatment enhances photodynamic therapy responsiveness in a mouse mammary carcinoma[J]. Cancer Res, 2000, 60(15):4066-9. |
| [10] | Bae BC, Na K. Self-quenching polysaccharide-based nanogels of pullulan/folate-photosensitizer conjugates for photodynamic therapy[J]. Biomaterials, 2010, 31(24):6325-35. |
| [11] | Lim DS, Bae SM, Kwak SY, et al. Adenovirus-mediated p53 treatment enhances photodynamic antitumor response[J]. Hum Gene Ther, 2006, 17(3):347-52. |
| [12] | Chan WH. Photodynamic treatment induces an apoptotic pathway involving calcium, nitric oxide, p53, p21-activated Kinase 2, and c-Jun N-terminal Kinase and inactivates survival signal in human umbilical vein endothelial cells[J]. Int J Mol Sci, 2011, 12(2):1041-59. |
| [13] | Wei XQ, Ma HQ, Liu AH, et al. Synergistic anticancer activity of 5-aminolevulinic acid photodynamic therapy in combination with low-dose cisplatin on Hela cells[J]. Asian Pac J Cancer Prev, 2013, 14(5):3023-8. |
| [14] | Ling D, Bae BC, Park W, et al. Photodynamic efficacy of photosensitizers under an attenuated light dose via lipid nanocarrier-mediated nuclear targeting[J]. Biomaterials, 2012, 33(21):5478-86. |
| [15] | Tran TH, Bae BC, Lee YK, et al. Heparin-folate-retinoic acid bioconjugates for targeted delivery of hydrophobic photosensitizers[J]. Carbohydr Polym, 2013, 92(2):1615-24. |
 2014, Vol.41
2014, Vol.41
