胃癌是第二大癌症死亡原因[1]。由于早期缺乏 典型症状和体征,85%的患者明确诊断往往已达进 展期[2],失去手术机会,早期行根治性手术切除的 患者50%也会出现局部复发或远处转移。联合化疗是晚期胃癌的主要治疗方法。但迄今为止,进展 期胃癌仍无标准的治疗方案,故寻找有效的治疗 方法是目前亟待解决的问题。我们对2010年3月— 2011年9月入住皖南医学院弋矶山医院肿瘤内科的 52例进展期胃癌患者采用奥沙利铂联合卡培他滨 (XELOX)与奥沙利铂联合替吉奥(SOX)两种方案治 疗,以观察临床疗效和不良反应,现报道如下。 1 资料和方法 1.1 临床资料选择
2011年3月—2012年3月,共入组52例患者。 入组患者年龄均大于18岁,XELOX组25例,其中 男14例,女11例,年龄29~80岁,中位年龄56岁; SOX组27例,其中男13例,女14例,年龄25~83 岁,中位年龄59岁。所有患者均经病理组织学证 实为胃癌,可自主进食,化疗前经体格检查、影 像学证实至少存在一个可测量的病灶。既往未经 过化疗或接受化疗后出现疾病进展者,化疗前1 月内未进行抗肿瘤治疗。患者化疗前血常规、肝 肾功能、心电图检查无化疗禁忌证。预计生存期 大于3月,ECOG评分0~2分。所有患者均签署知 情同意书。两组患者临床资料差异无统计学意义 (P>0.05),见表 1。
|
|
表 1 XELOX组与SOX组临床资料对比 Table 1 Comparison of clinical characteristics between XELOX group and SOX group |
XELOX组:奥沙利铂130 mg/m2,加入5%葡萄 糖溶液500 ml,静脉滴注2 h,使用前后以葡萄糖溶 液冲管,第1天;卡培他滨 1 000 mg/m2,每日2次口 服(早晚各一次,餐后30 min内用水吞服),第1~14 天,21天为一周期;SOX组:奥沙利铂同XELOX组 用法,S-1 40 mg/m2,每日2次口服 (早晚各一次,餐 后30 min内用水吞服),第1~14天,21天为一周期。 所有患者均接受2~6周期化疗,治疗过程中予以胃 复安、5-HT3受体拮抗剂、地塞米松止吐,化疗前 后及治疗过程中定期复查血常规、肝肾功能、心电 图、CT、MRI等,治疗期间不进行预防性升白,出 现骨髓抑制,根据病情予以G-CSF支持或化疗药物 减量。每两周期进行疗效评价及毒性评价。 1.3 疗效及毒性反应评价 1.3.1 疗效评价标准
根据RECIST标准,计算所 有靶病灶的最长径之和,与基线状态的最长径之 和相比,肿瘤客观疗效评价标准如下:完全缓解 (CR): 所有靶病灶消失并保持最少4周;部分缓解 (PR):靶病灶的最长径之和,与基线状态相比, 至少减少30%,并保持4周以上;稳定(SD):介 于部分缓解和疾病进展之间;进展(PD):靶病灶 的最长径之和与治疗开始后所记录到的最小靶病 灶最长径之和比较,增加20%,或者出现一个或 多个新病灶。肿瘤无进展生存期(progression-free survival,PFS)指化疗开始到肿瘤出现进展的时间。 总生存期(overall survival,OS)指化疗开始到患者死 亡或末次随访时间。 1.3.2 毒性评价标准
根据WHO不良反应分度标 准分为0~Ⅳ度。 1.4 统计学方法
采用SPSS19.0统计学软件,疗效比较采用χ2检 验、Fisher's精确检验,疗效相关因素采用Logistic 回 归,不良反应采用秩和检验,P=0.05为检验标准。 2 结果 2.1 近期疗效
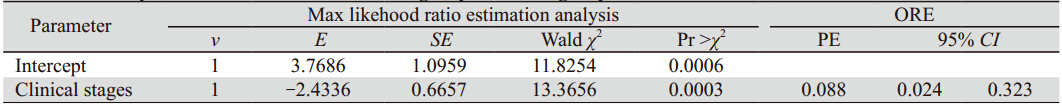
两组患者共有5 2例,均按要求完成至少2 周期以上化疗,所有患者均可评价疗效,其中 XELOX组中CR 0例(0),PR 13例(52.0%),SD 7例 (28.0%),PD 5例(20.0%),RR 52.0%;SOX组CR 1 例(3.7%),PR 12例(44.4%),SD 8例(29.6%),PD 6 例(22.2%),RR 48.1%。两组有效率相比差异无统计学意义 (P>0.05),见表 2。两组之间近期疗效与 年龄、性别、转移部位、转移数目、临床分期、 病理分级、既往化疗情况等的关系见表 3。我们发 现两组患者中临床分期Ⅲ期者疗效明显优于Ⅳ期 者 (P<0.01),见表 4。
|
|
表 2 XELOX组与SOX组近期疗效对比 Table 2 Comparison of response rates between XELOX group and SOX group |
|
|
表 3 XELOX组与SOX组患者近期疗效与相关因素的对比 Table 3 Comparison of response rates and related factors between XELOX group and SOX group |
|
|
表 4 XELOX组与SOX组疗效与影响因素的分析 Table 4 Efficacy and related factors of XELOX group and SOX group |
对入组52例病例进行随访,随访至2013年5 月31日。其中XELOX组存活2例,SOX组存活3 例。XELOX组PFS范围是2~19月,中位PFS 6.9 月,95%CI为5.105~8.695月;SOX组PFS范围是 2~22月,中位PFS 7.2月,95%CI为3.468~10.932 月。两组间无进展生存期相似,差异无统计学意 义(P=0.467),见图 1;XELOX组OS范围为3.8~21 月,中位OS为12.1月,95%CI为7.857~16.343月; SOX组OS范围是3~22月,中位OS 11.2月,95%CI 为6.790~15.610月。两组间OS相似,差异无统计学 意义(P=0.924),见图 2。
 |
图1 SOX组与XELOX组患者无进展生存期比较 Figure 1 Comparison of progression-free (PFS) between curves of XELOX group and SOX group |
 |
图2 SOX组与XELOX组患者总生存期比较 Figure 2 Comparison of overall survival (OS) between XELOX group and SOX group |
两组最主要的不良反应以骨髓抑制、胃肠 道反应、口腔黏膜炎、手足综合征、神经毒性 最为常见。两组白细胞和血小板下降的发生率 较低,为2 4 %~ 3 7 %,贫血的发生率较高,达 85.2%~88%,多为Ⅰ~Ⅱ度,两组间差异无统计学 意义 (P>0.05);XELOX组的口腔黏膜炎明显高于 SOX组,发生率分别为48%和25.9%,但无统计学 意义(P>0.05);XELOX组的手足综合征的发生率 为44%,明显高于SOX组的22.2%(P<0.05);SOX 组的恶心、呕吐、乏力等发生率略高于XELOX组 (P>0.05);XELOX组的神经毒性发生率达52%,高 于SOX组的33.3%(P>0.05)。其他不良反应如肝功 能损害等,一般反应较轻,均可耐受,见表 5。
|
|
表 5 XELOX组和SOX组患者不良反应的对比 Table 5 Comparison of adverse reactions between XELOX group and SOX group |
胃癌是最常见的恶性肿瘤之一,统计资料显示 胃癌的发病率仅次于肺癌居第二位。全球每年新发 病例约115万,每年约有70余万因胃癌死亡[3]。手术 为胃癌首选的治疗手段,但绝大多数患者就诊时已 达晚期,失去手术机会。因此,以化疗为主的综合 治疗成为进展期胃癌治疗的主要方式。
胃癌的化疗以氟尿嘧啶、顺铂为基础,联合 化疗疗效优于单药治疗[4]。传统化疗方案疗效差。 近年来,随着新药的不断出现,以氟尿嘧啶(5-Fu) 前体口服制剂、奥沙利铂、紫杉类药物、伊立替 康等为主的化疗方案均取得了较好的疗效。
奥沙利铂为第三代铂类化合物,以DNA为作 用部位,阻断DNA的复制和转录,产生细胞毒作 用和抗肿瘤活性。体内和体外研究均表明奥沙利 铂与顺铂及卡铂无交叉耐药,这可能与OXA所含 有的二氨环己烷基团避开了某些耐药机制有关[5]。 其骨髓抑制、胃肠道反应发生率较低,主要不良 反应是神经毒性,停药后可恢复[6]。
卡培他滨为一种对肿瘤细胞有选择性活性的 口服细胞毒性制剂。其本身无细胞毒性,主要在 肝脏和肿瘤组织内首先通过羧酸脂酶转化为5’-脱 氧-5-氟胞苷,然后再通过胞苷脱氨酶转化为5’-脱 氧-5-氟尿苷,在胸腺磷酸化酶(TP)的作用下转化 为5-氟尿嘧啶,提高癌组织细胞内药物浓度而达 到高效的组织靶向治疗目的,并且最大程度地降 低了5-氟尿嘧啶对正常组织的损害[7],明显减少了 全身的毒性作用。故临床上逐渐有卡培他滨取代 5-氟尿嘧啶的趋势。此外,研究发现,紫杉类、 奥沙利铂、伊立替康等可以上调TP [8,9],提示与卡 培他滨联合治疗有协同作用。Lee等[10]报道指出卡 培他滨单药治疗进展期胃癌的RR、PFS、OS分别 为27.2%、4.7月、9.5月,而联合奥沙利铂后RR、 PFS、OS分别为63%,5.8月,11.9月[11]。本研究 中XELOX组治疗进展期胃癌RR、PFS、OS分别为 52%、6.9月、12.1月,疗效与同类研究结果类似。
S-1是一种新型的口服氟嘧啶组成的5-Fu前 体药物[12],它是一种复方制剂,主要由替加氟 (FT-207)、吉美嘧啶(CDHP)、奥替拉西钾(Oxo)按 照1∶0.4∶1的摩尔比组成。FT-207口服后经肝脏 线粒体P-450代谢酶系的作用,在体内逐渐转化成 5-氟尿嘧啶(5-Fu) [13]。CDHP通过抑制存在于肝脏 的5-Fu分解代谢酶DPD(二氢嘧啶脱氢酶)的活性 从而抑制FT分解,增加血液中5-Fu的浓度[14],从 而增强抗肿瘤作用。Oxo口服后分布于胃肠道, 可选择性抑制乳清酸磷酸核糖转移酶,抑制5-Fu 在胃肠道中的磷酸化,减轻胃肠道不良反应[15]。 国内外几项多中心临床研究确立了S-1在晚期胃癌治疗中的地位。SPIRITS [16]及SC-101研究[17]均显 示SP(S-1+DDP)组的OS、RR、PFS均高于单药S-1 组,但联合化疗组的Ⅲ~Ⅳ级血液学毒性及胃肠道 反应较单药组显著增加。因此如何选择更好的含 S-1的组合方案值得进一步探讨。Park等[18]联合S-1 与奥沙利铂一线治疗进展期胃癌RR、PF、OS分别 为55.3%、6.6月、12.5月,疗效优于SP组,血液学 毒性及胃肠道反应明显较SP方案减轻。
我们比较了XELOX与SOX两种方案治疗进展 期胃癌的疗效及安全性,结果表明XELOX组和 SOX组的有效率分别为52%和48.1%,PFS分别为 6.9月和7.2月、OS分别为12.1月和11.2月,两组间 差异无统计学意义(P>0.05)。两组间ECOG评分较 好者疗效优于ECOG评分较差者;既往未接受化疗 者疗效优于既往接受化疗者,但差异无统计学意 义(P>0.05);两组患者中临床分期为Ⅲ期者疗 效明显优于Ⅳ期者,差异有统计学意义(P<0.01)。
XELOX组和SOX组耐受性较好,无治疗相关性死 亡。主要不良反应为骨髓抑制、胃肠道反应、神 经毒性、口腔黏膜炎及手足综合征。两组患者的 白细胞及血小板下降率较低,约24%~37%,而贫 血的发生率较高,达85%以上,多为Ⅰ~Ⅱ度,组 间比较差异无统计学意义 (P>0.05);SOX组的恶 心、呕吐发生率略高于XELOX组,XELOX组的腹 泻、口腔黏膜炎发生率高于SOX组,但差异均无 统计学意义 (P>0.05);XELOX组的神经毒性发生 率达52%,低于国外报道[19],SOX组神经毒性发生 率达33.3%。两组比较差异无明显意义 (P>0.05); 手足综合征的发生率XELOX组明显高于SOX组 (P<0.01)。这可能与卡培他滨的代谢途径相关,TP 酶参与卡培他滨转化为氟尿嘧啶,而二氢嘧啶脱 氢酶(DPD)参与氟尿嘧啶的分解代谢。Milano 等[20]研究发现,人体皮肤部位的TP酶的表达较 高,DPD酶表达相对较低,这可能导致卡培他滨 代谢产物在这些部位蓄积;Saif等[21]认为手、足等 部位的汗腺系统较为丰富,这些部位的毛细血管 易于被卡培他滨的代谢产物损坏而导致炎症型反 应,易发生手足综合征。其他反应如乏力、肝功 能损害等两组发生率相近,症状较轻,经过相应 处理后可以完成治疗。
综上所述,Xelox方案和SOX方案治疗进展期胃 癌,患者近期疗效确切,不良反应较低,易于处理,患者 耐受性好,均可作为治疗进展期胃癌的首选方案之一。
| [1] | Leung WK,Wu MS, Kakugawa Y, et al. Screening for gastric cancer in Asia: current evidence and practice[J]. Lancet Oncol,2008,9(3):279-87. |
| [2] | Varadhachary G, Ajani JA. Gastric cancer[J]. Clin Adv Hematol Oncol,2005,3(2):118-24. |
| [3] | Rosati G, Ferrara D, Manzione L. New perspectives in the treatment of advanced or metastatic gastric cancer[J]. World J Gastroenterol,2009,15(22):2689-92. |
| [4] | Tanabe K, Suzuki T, Tokumoto N, et al. Combination therapy with docetaxel and S-1 as a first-line treatment in patients with advanced or recurrent gastric cancer: a restrospective analysis[J]. World J Surg Oncol,2010,8:40. |
| [5] | O’Dwyer PJ, Johnson SW. Current status of oxaliplatin in colorectal cancer[J]. Semin Oncol,2003,30(3 Suppl 6):78-87. |
| [6] | Ajani JA, Rodriquez W, Bodoky G, et al. Multicenter phase Ⅲ comparison of cisplatin/S-1 with cisplatin/infusiona1 fluorouracil in advanced gastric or gastroesophageal adenocarcinoma study: the FLAGS trial[J]. J Clin Oncol,2010,28(9):1547-53. |
| [7] | Saeki T, Takashima S. Mechanism and possible biochemical modulation of capecitabine (Xeloda), a newly generated oral fluoropyrimidine[J]. Gan To Kagaku Ryoho,1999,26(4):447-55. |
| [8] | Cassidy J,Tabernero J,Twelves C,et al. XELOX (capecitsbine plus oxaliplatin): active first-line therapy for patients with metastatic colorectal cancer[J]. J Clin Oncol,2004,22(11):2084-91. |
| [9] | Twelves C, Boyer M, Findlay M, et al. Capecitabine (Xeloda) improves medical resource use compared with 5-fluorouracil plus leucovorin in a phase Ⅲ trail conducted in patients with advanced colorectal carcinoma[J]. Eur J Cancer,2001,37(5):597-604. |
| [10] | Lee JL, Kang YK, Kang HJ, et al. A randomised multicentre phase II trial of capecitabine vs S-1 as first-line treatment in elderly patients with metastatic or recurrent unresectable gastric cancer[J]. Br J Cancer,2008,99(4):584-90. |
| [11] | Park YH, Lee JL, Ryoo BY, et al. Capecitabine in combination with Oxaliplatin (XELOX) as a first-line therapy for advanced gastric cancer[J]. Cancer Chemother Pharmacol,2008,61(4): 623-9. |
| [12] | Maehara Y. S-1 in gastric cancer: a comprehensive review[J]. Gastric Cancer,2003,6 Suppl 1:2-8. |
| [13] | Tanaka F, Fukuse T, Wada H, et al. The history, mechanism and clinical use of oral 5-fluorouracil derivative chemotherapeuic agents[J]. Curr Pharm Biotechnol,2000,1(2):137-64. |
| [14] | Terashima M, Fujiwara H, Takagane A, et al. Rediction of sensitivity to fluoropyrimidines by metabolic and target enzyme activities in gastric cancer[J]. Gastric Cancer,2003,6 Suppl 1:71-81. |
| [15] | Yoshisue K, Hironaga K, Yamaguehi S, et al. Reduction of 5-fluorou-racil(5-FU) gastrointestinal(GI) toxicity resulting from the protection of thymidylate synthase (TS) in GI tissue by repeated simultaneous administration of potassium oxonate(Oxo) in rats[J]. Cancer Chemother Pharmacol,2000,46(1):51-6. |
| [16] | Koizumi W, Narahara H, Hara T, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial): a phase Ⅲ trial[J]. Lancet Oncol,2008,9(3):215-21. |
| [17] | Jin M, Lu H, Li J, et al. Randomized 3-armed phase Ⅲ study of S-1 monotherapy versus S-1/CDDP(SP) versus 5-FU/CDDP ( FP) in patients(pts) with advanced gastric cancer(AGC):SC101 study[J]. J Clin Oncol,2008,26:(Abstr:4533). |
| [18] | Park I, Lee JL, Ryu MH,et al. PhaseⅠ/Ⅱ and pharmacokinetic study of S-1 and oxaliplatin in previously untreated advanced gastric cancer[J]. Cancer Chemother Pharmacol,2010,65(3):473-80. |
| [19] | Kim C, Lee JL, Ryu MH, et al. A prospective phaseⅡstudy of cetuximab in combination with XELOX (capecitabine and oxaliplatin) in patients with metastatic and/or recurrent advanced gastric cancer[J]. Invest New Drugs,2011,29(2):366-73. |
| [20] | Milano G, Etienne-Grimaldi MC, Mari M, et al. Candidate mechanisms for capecitabine-related hand-foot syndrome[J]. Br J Clin Pharmacol,2008,66(1):88-95. |
| [21] | Saif MW. Capecitabine and hand-foot syndrome[J]. Expert Opin Drug Saf,2011,10(2):159-69. |
 2014, Vol.41
2014, Vol.41