胃癌是世界范围内最常见恶性肿瘤之一,我 国是胃癌发病率和死亡率最高的国家之一。由于 早期胃癌的诊断率仍很低,我国多数胃癌患者确 诊时已为进展期,全身化疗是其主要治疗手段, 胃癌的最佳一线化疗方案国际上并未达成共识。 在进展期胃癌中使用的化疗药物如氟尿嘧啶类、 铂类、蒽环类和紫杉类药物的各种联合,均已成 为胃癌姑息一线化疗的选择[1]。5-Fu是治疗消化 道肿瘤的基础药物,替吉奥(S-1)作为5-氟尿嘧啶 (5-Fu)的衍生物,与5-Fu相比,具有能维持较高 的血药浓度和抗癌活性、明显减少药物的不良反应 以及给药方便的优势。多项临床研究表明:S-1是目 前治疗进展期胃癌最有效的抗肿瘤药物之一[2,3]。本 研究回顾性分析新疆医科大学附属肿瘤医院2010 年1月至2012年11月采用S-1联合紫杉醇或奥沙利铂 治疗进展期胃癌患者的临床资料,对两方案的疗 效及不良反应结果总结如下。 1 资料和方法 1.1 病例选择
入组标准:(1)病理证实无法手术的Ⅲ或 Ⅳ期胃腺癌患者;(2)未接受过化疗或术后辅 助化疗结束6月以上出现肿瘤复发或转移;(3) 有可评价病灶,如B型超声、CT或MRI等;(4) ECOG≤2,预计生存期3月以上;(5)治疗前血常规、肝肾功能、心电图基本正常,无明显化疗 禁忌证。 1.2 一般资料
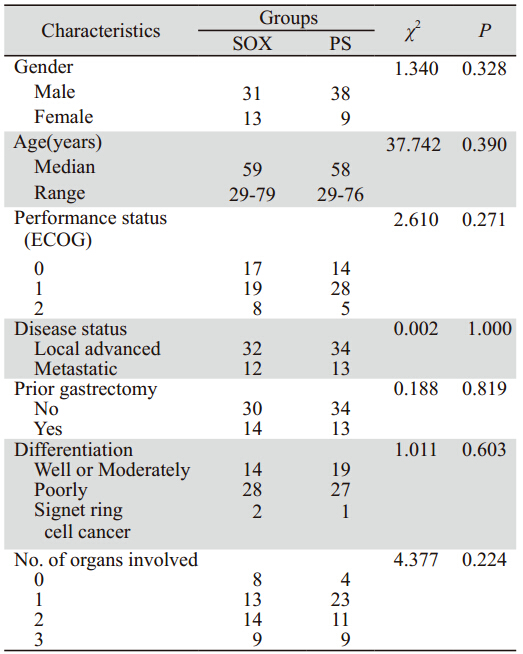
选取2010年1月1日—2012年11月30日新疆医 科大学附属肿瘤医院符合入组标准的91例进展期 胃癌患者。所有患者接受替吉奥联合化疗,SOX 组:接受S-1+奥沙利铂化疗方案,PS组:接受 S-1+紫杉醇化疗方案。患者中位年龄58岁(29~79 岁),其中男性69例(75.8%),13例(14.3%) 患者ECOG评分2分,27例(29.7%)患者接受手 术切除(其中2例行姑息性切除),20例(22%) 患者接受辅助化疗。43例(47%)患者有2个或2个以 上部位转移,转移部位多见腹腔淋巴结、肝和腹 膜。患者一般特征见表 1,两组患者资料比较差异 无统计学意义 (P>0.05)。
|
|
表 1 SOX和PS组进展期胃癌患者的一般资料 Table 1 DGeneral data of advanced gastric cancer patients in SOX and PS groups |
所有患者S-1均是80 mg/m2,分2次餐后口服, d1~d14;SOX组:奥沙利铂130 mg/m2,d1,静 脉滴注;PS组:紫杉醇80 mg/m2,d1、8,静脉 滴注;化疗均是21d为1周期。紫杉醇静滴前12小 时、前6小时各给予地塞米松10 mg口服,化疗前 半小时给予苯海拉明、西咪替丁预处理。 1.4 疗效及不良反应评价标准
按RECIST1.1实体肿瘤疗效评价标准进行疗 效评价,分为:完全缓解(CR)、部分缓解(PR)、 疾病稳定(SD),疾病进展(PD)。以CR+PR计算 有效率(RR),以CR+ P R+ S D计算疾病控制 率(DCR)。无疾病进展时间(progression-free survival,PFS):化疗开始至肿瘤出现进展或死亡 的时间。生存期(overall survival,OS):从化疗开 始至死亡或末次随诊时间。随访时间为治疗开始 至随访截止日期、患者失访或死亡的时间。不良 反应按照美国国立癌症研究所常见毒性分级标准 3.0版(NCI-CTC 3.0)进行评价。于治疗前及2周 期化疗后复查影像学检查评价疗效,每周期均进 行不良反应评价。 1.5 统计学方法
用SPSS16.0软件进行统计学处理,组间比较 用χ2检验,生存期采用Kaplan-Meier方法分析, Log rank方法检验,不良反应采用Wilcoxon秩和检验。P<0.05为差异有统计学意义。 1.6 随访
随访方式为电话随访,随访时间为治疗开始 至末次随访时间,末次随访时间为2013年5月13日 或死亡、失访时间。 2 结 果 2.1 疗效比较
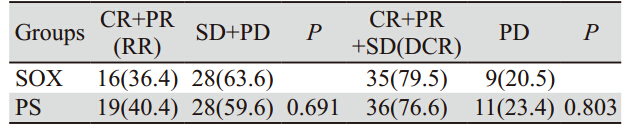
共完成387周期化疗,SOX组和PS组化疗中 位数均是4。以S- 1为基础化疗有效患者共35例 (RR 38.5%);SOX和PS组有效率比较,差异 无统计学意义;两组疾病控制率(DCR)分别为 79.5%和76.6%,两组比较差异无统计学意义(P> 0.05),见表 2。
|
|
表 2 SOX和PS组患者有效率及疾病控制率比较[n(%)] Table 2 Comparison of response rates and desease control rates between SOX and PS groups[n(%)] |
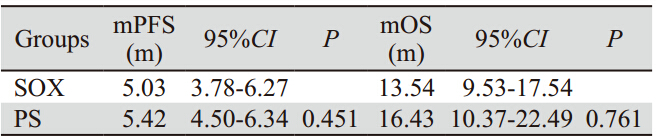
截至2013年5月,随访时间为2~39月,中位 随访11.7月。至随访结束,89例(97.8%)患者 疾病进展,52例(57.1%)患者死亡,1年生存率 为47.3%。本研究91例患者PFS为4.5月(95%CI: 3.6~5.4),OS为12.3月(95%CI:10.8~13.7),两组中 位PFS及中位OS,见表 3。两组无疾病进展时间曲 线和生存时间曲线比较均无显著差异,见图 1、2。
|
|
表 3 SOX组与PS组患者中位无疾病进展时间及中位生存时间的比较 Table 3 Comparison of mPFS and mOS between SOX and PS groups |
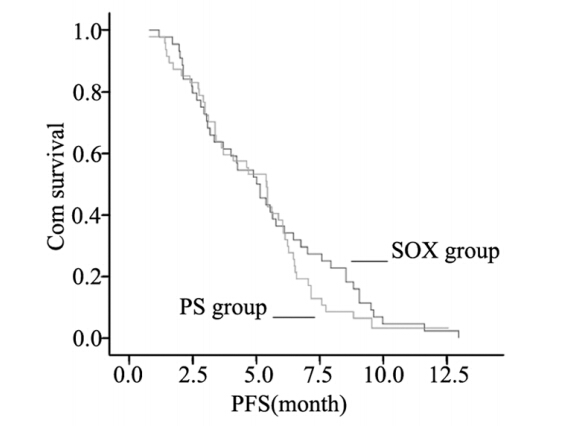 |
图1 SOX组与PS组患者PFS曲线 Figure 1 PFS curves of SOX group and PS group |
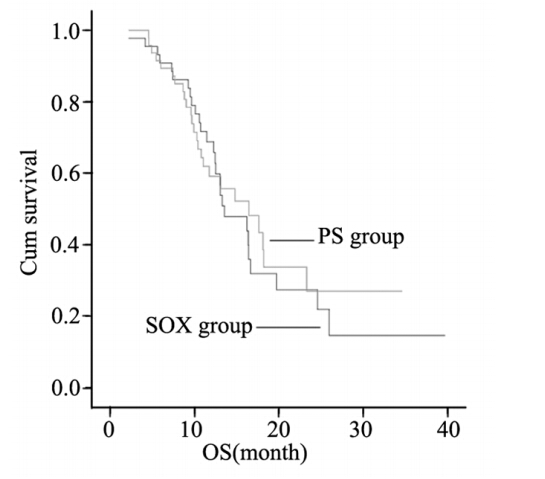 |
图2 SOX组和PS组患者OS曲线 Figure 2 OS curves of SOX group and PS group |
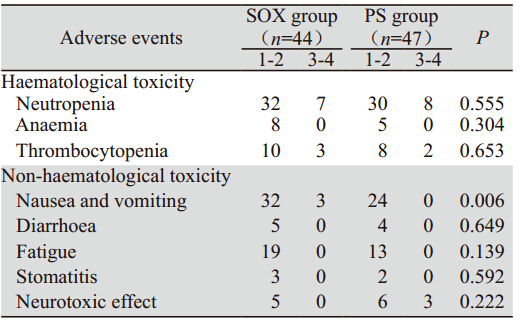
SOX组和PS组的血液学不良反应主要是中性 粒细胞减少,多为1~2度,3~4度中性粒细胞减少分别为15.9%和17.0%,3~4度血小板减少分别为 6.8%和4.3%,经相应的对症处理后绝大多数患 者均能耐受,两组血液学不良反应比较差异均无 统计学意义(P>0.05)。SOX组和PS组的非血液 学不良反应主要是胃肠道反应、乏力;SOX组和 PS组的恶心、呕吐发生率分别为79.5%和51.1%(P <0.05);PS组有3例患者出现3度神经毒性(肢体 疼痛难以忍受,夜间难以入眠,经对症治疗后症 状减轻),SOX组和PS组的神经毒性发生率分别为 11.4%和19.1%(P>0.05);腹泻、口腔炎、乏力不 良反应发生率低,且多为1~2度,差异无统计学意 义。无一例因不良反应而终止治疗,全组无治疗 相关性死亡,见表 4。
|
|
表 4 两组患者化疗不良反应比较(例) Table 4 Comparison of treatment-related adverse events between two groups(case) |
我国早期胃癌的诊断率很低,约65%的胃癌患 者就诊时已处于局部晚期或发生远处转移,因此化 疗成为进展期胃癌的重要治疗手段之一。虽然进展 期胃癌姑息化疗疗效已被广泛认可,但全球范围尚 未确立进展期胃癌的一线标准方案,因此新的研究 方向是寻找高效低毒的化疗方案。近年来多个临床 研究显示S-1联合紫杉醇或S-1联合奥沙利铂在进展 期胃癌中均取得了较好的疗效[4,5,6,7,8],有必要在临床试 验中进一步研究。本研究对比这两方案治疗进展期 胃癌的疗效及不良反应,发现这两方案均有较好的 近期和远期疗效,血液学不良反应无显著差异,而 非血液学不良反应各有特点。
S-1是第四代氟尿嘧啶衍生物口服抗癌剂,是 替加氟、吉美嘧啶和奥替拉西钾的复方制剂;其 中吉美嘧啶为二氢嘧啶脱氢酶的强效抑制剂,阻 止5-Fu的降解,提高5-Fu的利用度,延长血液和肿 瘤组织中5-Fu的药效时间,增加抗癌作用;奥替 拉西钾阻断5-Fu磷酸化,减轻了5-Fu引起的消化 道毒性[9]。多个临床研究表明S-1无论单药还是联 合其他化疗药在进展期胃癌的治疗中均显示了良 好的疗效,有效率高于5-Fu,而且不良反应轻、 使用方便,不需要深静脉置管,是5-Fu很好的替 代药物[2,3]。一项日本Ⅲ期临床研究表明S-1+DDP (SP)和单用S-1治疗晚期胃癌,有效率(RR)分 别为54.0%和31.1%(P=0.001),中位无疾病进 展生存时间(PFS) 及中位生存期(OS)分别达 到(6月 vs. 4月,P<0.001)和(13月 vs. 11月, P=0.04),SP方案已被推荐作为日本晚期胃癌一 线方案[3]。但SP方案中顺铂的消化道反应比较明 显,而晚期胃癌患者通常具有体质差和化疗耐受 性差等特点,SP方案在临床推广有一定限度。
奥沙利铂是第3代铂类抗肿瘤药物,Ⅲ期 REAL-2临床研究结果含奥沙利铂方案和含顺铂 方案的中位生存期分别是10.4和10.0月,含奥沙 利铂方案3~4级中性粒细胞减少、血小板减少、 脱发、肾功损害发生率较含顺铂方案明显降低,虽然神经毒性和腹泻发生率增加[10]。REAL-2研 究表明含奥沙利铂方案在晚期胃癌一线治疗中疗 效并不低于含顺铂方案,而且不良反应明显降 低,患者耐受性更好,与顺铂相比,不需水化, 并且使用简便。因而奥沙利铂联合S-1(SOX) 方案成为进展期胃癌治疗中研究热点。近年多个 Ⅱ期临床研究表明SOX方案在进展期胃癌中RR 较高(40%~59%),PFS为6.2~6.8月,中位OS为 11.8~16.5月,并且不良反应发生率较低[4,5,6]。2013 年ASCO年会上一项日本Ⅲ期晚期胃癌临床研究 显示,SOX组和SP组的RR和DCR分别为55.7% vs. 52.2%和85.2% vs. 81.8%(P>0.05),中位PFS分 别为5.5和5.4月(HR=1.004),由此研究者认为 SOX方案也可作为晚期胃癌一线治疗的新选择。 本研究中SOX组RR为36.4%,中位PFS为5.0月、中 位OS为13.5月,与上述国内外研究报道的结果大 致相符。
紫杉类药物是晚期胃癌化疗中的常用药物之 一,国际多中心V325研究是探讨了DCF方案在 进展期胃癌中的疗效及毒性,虽然在客观缓解 率和无进展生存等方面获益,由于该方案属高效 高毒,限制了其在临床上的广泛应用。在临床前 期研究中表明,紫杉醇与5-Fu 类具有协同抗肿 瘤效应[11]。另有临床试验结果表明紫杉醇与多西 紫杉醇相比,治疗晚期胃癌的近期疗效和远期生 存无显著差异,但紫杉醇联合治疗组的患者耐受 性和安全性更佳[12,13]。近年多个Ⅱ期临床研究表 明紫杉醇联合S-1(PS)方案在进展期胃癌中RR为 46.3%~52.3%,中位PFS为5.0~9.0月,中位OS为 14.0~16.0月,并且耐受性好[7,8,14,15]。2012年日本 一项Ⅱ期临床试验采用PS对比S-1联合顺铂治疗进 展期胃癌,RR(52.3% vs.48.7%,P=0.74)和中位 PFS(9月 vs. 6月,P=0.50)相当,两组不良反应 相似,提示PS方案是治疗进展期胃癌疗效好且简 便易行的非铂方案[14]。国内学者黄鼎智等[15]研究 发现PS方案治疗晚期胃癌的RR为50.0%,DCR为 82.0%,中位PFS为153天,且不良反应较轻,安全 性良好。本研究中PS方案组RR为40.4%,中位PFS 为5.4月、中位OS为16.4月。与上述国内外文献报 道的结果相近。
本研究结果表明以S - 1为基础化疗的RR为 39.6%,1年生存率为47.3%,PFS为4.5月,OS为 12.3月,与国内外文献报道的结果相似;SOX组 和PS组的RR分别为36.4%和40.4%,两组无显著 差异;SOX组和PS组PFS和OS比较差异均无统计 学意义。在不良反应方面,SOX组和PS组的血液 学不良反应主要是中性粒细胞减少,多为1~2度, 两组血液学不良反应比较差异无统计学意义(P> 0.05)。两组方案的非血液学不良反应主要是胃肠 道反应、乏力;SOX组恶心、呕吐发生率较高, 与PS组比较有统计学意义(P<0.05);其他不良反 应发生率低,且多为1~2度,差异均无统计学意 义。两组患者的3~4级不良反应发生率绝大部分小 于5%,提示整体耐受性良好,不良反应可控制。 总之,这两组方案不仅可延长生存而且能提高胃 癌患者生活质量。
本研究表明替吉奥联合紫杉醇或奥沙利铂治 疗进展期胃癌有效率和生存期相当,均有较好的 疗效,不良反应均可很好耐受。
| [1] | Liu TS.Chemotherapy selsction through the process of gastric cancer[J].Zhonghua Wei Chang Wai Ke Za Zhi, 2012,15(2):118-20.[刘天舒.胃癌发展过程中各阶段化疗药物及方案的选择[J].中华胃肠外科杂志,2012,15(2):118-20.] |
| [2] | Boku N, Yamamoto S, Fukuda H, et al. Fluorouracil versus combination of irinotecan plus cisplatin versus S-1 in metastatic gastric cancer: randomised phase 3 study[J].Lancet Oncol,2009, 10(11):1063-9. |
| [3] | Koizumi W, Narahara H, Hara T, et al.S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase Ⅲ trial[J].Lancet Oncol,2008,9(3):215-21. |
| [4] | Liu B, Ying J, Luo C, et al.S-1 combined with oxaliplatin as first line chemothera-py for chinese advanced gastric cancer patients[J].Hepatogastroenterology,2012,59(114):649-53. |
| [5] | Koizumi W, Takiuchi H, Yamada Y, et al. Phase Ⅱstudy of oxaliplatin plus S-1 -as first-line treatment for advanced gastric cancer (G-SOX study) [J].Ann Oncol,2010,21(5):1001-5. |
| [6] | Kim GM, Jeung HC, Rha SY, et al.A randomized phase Ⅱtrial of S-1-oxaliplatin versus capecitabine-oxaliplatin in advanced gastric cancer[J].Eur J Cancer,2012,48(4):518-26. |
| [7] | Wang X,Wang ML,Zhou LY,et al. Randomized phase Ⅱstudy comparing paclitaxel with S-1 vs.S-1 as first-line treatment in patients with advanced gastric cancer. [J].Clin Transl Oncol,2013,15(10): 836-42. |
| [8] | Ueda Y, Yamagishi H, Ichikawa D.Multicenter phase Ⅱstudy of weekly paclitaxel plus S-1 combination chemotherapy in patients with advancedgastric cancer. [J].Gastric Cancer,2010,13(3):149-54. |
| [9] | Fukushima M.Antitumor activity and function of S-1, a new oral tegafur-based formulation[J].Gan To Kagaku Ryoho,2006,33 (Suppl 1):19-26. |
| [10] | Cunningham D, Starling N, Rao S, et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl J Med, 2008,358(1):36-46. |
| [11] | Kano Y, Akutsu M, Tsunoda S, et al. Schedule-dependent interaction between paclitaxel and 5-fluorouracil in human carcinoma cell lines in vitro[J].Br J Cancer,1996 ,74(5):704-10. |
| [12] | Park SH,Lee WK,Chung M,et al. Paclitaxel versus docetaxel for advanced gastric cancer: a randomized phase Ⅱtrial in combination with infusional 5-fluorouracil[J].Anticancer Drugs,2006,17(2):225-9. |
| [13] | Chon HJ,Rha SY,Im CK,et al.Docetaxel versus paclitaxel combined with 5-Fu and leucovorin in advanced gastric cancer: combined analysis of two phase Ⅱ trials [J].Cancer Res Treat,2009,41(4):19 6-204. |
| [14] | Mochiki E, Ogata K, Ohno T,et al. Phase Ⅱ multi-institutional prospective randomised trial comparing S-1+paclitaxel with S-1+cisplatin in patients with unresectable and/or recurrent advanced gastric cancer[J].Br J Cancer,2012 ,107(1):31-6. |
| [15] | Huang DZ,Xiong JP,Ba Y,et al.A phase Ⅱ prospective randomized controlled trial of weekly paclitaxel combined with S-1 or fluorouracil for advanced gastric carcinoma[J].Zhonghua Zhong Liu Za Zhi,2012,34(11):865-8.[黄鼎智,熊建萍,巴一,等.紫杉醇 每周方案联合氟特嗪胶囊与氟尿嘧啶治疗晚期胃癌的Ⅱ期前 瞻性随机对照研究[J].中华肿瘤杂志,2012,34(11):865-8.] |
 2014, Vol.41
2014, Vol.41