胃癌易于早期播散,且临床症状多出现在病 变晚期,故单纯根治性手术难以获得良好的生存 获益[1]。术前辅助化疗(即新辅助化疗)可降低肿瘤 分期,消除潜在的微小转移灶[2],是进展期胃癌 患者综合治疗的重要措施。MAGIC试验[3]显示,围手术期化疗可增加胃癌的手术切除率及生存获 益。新辅助化疗的作用虽然逐渐得以证实,但最 佳化疗方案尚待明确。
氟尿嘧啶(5-Fu)、亚叶酸钙(CF)和奥沙利铂 (L-OHP)联合应用方案(FOLFOX方案)在消化道肿 瘤领域中得到了广泛应用[4],在晚期胃癌姑息性化 疗中临床缓解率可达45% [5],但其在新辅助化疗中 的作用尚不明确。本研究探讨FOLFOX4方案作为 进展期胃癌新辅助化疗方案的临床应用价值。 1 资料和方法 1.1 病例纳入标准
(1)病理组织学确诊胃癌;(2)上腹部 CT、腹部 超声术前分期确定为Ⅲ、Ⅳ期;(3)ECOG 评分: 0~2;(4)年龄 20~80 岁(含 20和80);(5)手术切除 (根治或姑息切除);(6)肝、肾、骨髓功能正常(白 细胞数>4000/dl,血小板数>10 万/dl,丙氨酸转 氨酶(ALT)<两倍正常值,总胆红素<1.5 mg/dl, 血肌酐(Cr)<1.5倍正常值);(7)患者知情同意; (8)既往无恶性肿瘤史、无胃部手术史、无放化疗 史、无严重感染及心脏疾病。 1.2 入组病例
收集武汉大学中南医院2006年1月-2012月1月 经收治的胃癌患者58例,其中经新辅助化疗-手术-辅助化疗的患者23例,按1:1.5比例收录对照组, 选择经手术-辅助化疗的患者35例作为对照。 1.3 治疗方法
研究组患者给予FOLFOX4新辅助化疗方案, L-OHP 85 mg/m2静脉滴注第1、2天,CF 200 mg/m2 静脉滴注第1、2天,5-Fu 400 mg/m2静推,第1、2 天,5-Fu 600 mg/m2持续泵入22 h第1、2天,每两 周为一个化疗周期,术前中位新辅助化疗周期数 2个(范围1~4个)。化疗期间定时复查血常规及肝 肾功能,新辅助化疗后14~21天内进行手术。对照 组在确诊2周内行常规手术治疗。两组术后给予以 FOLFOX方案为主的化疗,术后中位化疗周期数 研究组4个(范围1~6个),对照组5个(范围2~6个)。 1.4 疗效判定及随访
腹部CT测量化疗前后肿瘤病灶大小变化, 测定化疗前后血液肿瘤标志物水平的变化,以此 评判新辅助化疗临床疗效。腹部CT的评判按照 RECIST实体瘤评判标准[6]执行。肿瘤标志物的评 判按照Kuwatani等[7]提出的评判进行,标准如下: (1) 完全缓解(complete response,CR),肿瘤标志 物水平恢复正常;(2) 部分缓解(partial response, PR),肿瘤标志物水平与基线状态比较至少下降 50%;(3) 病变稳定(stable disease,SD),CA125、 CA199、CEA三个肿瘤标志物中有两个的水平下 降小于50%;(4) 病变进展(progression disease, P D),至少有一个肿瘤标志物的水平增长大于 50%。若在行新辅助化疗两周后肿瘤发生完全缓解 或者部分缓解,则再进行1~2周期化疗;若出现肿 瘤明显增大、进一步向外浸润、有远处转移、肿 瘤标志物明显进一步增高等情况,则立即手术治 疗。新辅助化疗病理疗效评价依据参考日本胃癌 研究会的标准[8]:(1) 3级:HE组织切片中无可见 肿瘤细胞残留;(2) 2级可见肿瘤细胞小于整个肿 瘤区域的1/3;(3) 1b级可见肿瘤细胞占整个肿瘤区 域的1/3~2/3;(4) 1a级可见肿瘤细胞大于整个肿瘤 区域的2/3;(5) 0级肿瘤组织无改变。化疗药物不 良反应分级按照WHO的NCI-CTC 2.0标准分为0~ Ⅳ级。
所有患者均随访至2013年1月30日,总生存 时间(overall survival,OS)为患者开始接受治疗 至其死亡或末次随访的时间,无进展生存时间 (progression-free survival,PFS)为患者开始接受治 疗至其疾病复发或者死亡的时间。 1.5 统计学方法
使用SPSS 19.0软件统计分析。用卡方检验 比较计数资料;用非参数Wilcoxon检验比较肿瘤 标志物,手术淋巴结获取数,转移淋巴结数;用 Kaplan-Meier生存分析比较总生存期(OS)及无进展 生存期(PFS);应用Cox风险比例回归模型对影响 生存预后的风险因子进行预测。P<0.05为差异有 统计学意义。 2 结果 2.1 基线数据
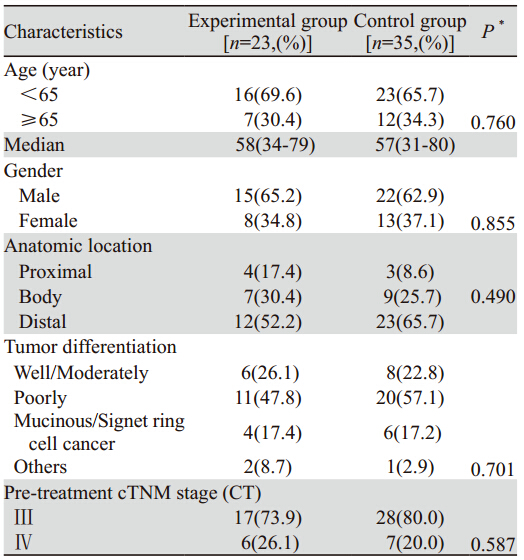
两组患者的临床病理资料均衡可比(P>0.05), 见表 1。
|
|
表 1 两组患者的临床病理资料[例(%)] Table 1 Clinicopathlolgical data of two groups [n,(%)] |
研究组新辅助化疗后血液肿瘤标志物CEA、 CA125和CA199的水平明显下降,化疗前后的肿 瘤标志物水平差异有统计学意义(P<0.05),见表 2。当CEA、CA125、CA199三者联合作为新辅 助化疗疗效评定指标时,CR7例(30.4%),PR7例 (30.4%),SD7例(30.4%),PD2例(8.7%),缓解率 (CR+PR)60.9% (14/23)。腹部CT对疗效评判 按照RECIST实体瘤评判标准执行,其中CR0例 (0%),PR10例 (43.5%),SD9例 (39.1%),PD4例(17.4%),缓解率(CR+PR)43.5% (10/23)。 两组患者化疗相关不良事件主要有中性粒细 胞减少、胃肠道反应、神经毒性及口炎等。所有 患者在给予升白、止吐、护肝等相应对症支持治 疗后均可缓解,未影响临床治疗,两组化疗不良 事件发生率差异无统计学意义(P>0.05),见表 3。
|
|
表 2 新辅助化疗前后肿瘤标志物水平的变化[中位数(范围)] Table 2 Tumor marker responses after the neoadjuvant chemotherapy[Median(range)] |
|
|
表 3 化疗相关不良反应[例(%) ] Table 3 Adverse effects associated with preoperative and postoperative chemotherapy[n,(%)] |
两组均接受手术,R0切除率研究组为82.6% (19/23),对照组为80.0%(28/35) (P>0.05),均无手 术相关死亡。研究组术后严重不良事件4例,包括 术后出血l例,吻合口瘘1例,肺部感染2例;对照 组术后严重不良事件6例,包括肺部感染3例,术 后消化道梗阻2例,术后出血1例;两组差异无统 计学意义(P>0.05)。 2.4 术后病理资料
标本病理学检查显示,3级疗效(即病理完全 缓解)患者0例,2级疗效8例(34.8%),1b级疗效 10例(43.5%),1a级疗效3例(13.0%),0级疗效2例 (8.7%);淋巴结转移中位数研究组为3个(范围0~14 个),对照组为6个(范围0~27个) (P=0.04),相应N 分期,研究组也显著低于对照组 (P=0.034)。 2.5 生存分析
研究组患者的中位随访时间为26月( 10~61 月),对照组为31月(15~72月) (P>0.05)。KaplanMeier生存分析显示,研究组与对照组中位生存 时间分别为29.0月(95%CI: 25.3~32.7)和22.0月 (95%CI:18.2~25.8) (P=0.013),中位无进展生存时 间分别为26.0月(标准误未达到)和18.0月(95%CI: 14.4~21.6) (P=0.019),见图 1A、1B。三年总生存 率,研究组为73.9% (95%CI: 54.6~93.2),对照组 40.0% (95%CI: 30.1~49.9);三年无进展生存率,研 究组为60.9% (95%CI: 47.7~74.1),对照组为34.3% (95%CI: 26.2~42.4)。
 |
OS (overall survival) and PFS (progression-free survival) between the two groups (A, B); OS between the two groups without metastasis (C); OS between the two groups with metastasis (D)
图1 两组患者Kaplan-Meier生存分析
Figure 1 Kaplan-Meier analysis of the neoadjuvant group and control group |
多因素分析显示,对总生存期有意义的预后 因素为新辅助化疗[hazard ratio(HR)=0.202(95%CI: 0.072~0.570),P=0.003]及肿瘤远处转移[HR=5.388 (95%CI:1.856~15.643),P=0.002]。进一步分析发 现新辅助化疗在未发生远处转移的(M0)胃癌患者 中有价值(P=0.009)(图 1C);而对远处转移(M1)的 患者,新辅助化疗组与对照组相比无统计学意义(P=0.091),但M1胃癌患者只有9例,统计学效能 有限,见图 1D。 3 讨论
进展期胃癌的总预后仍然较差,即便是区域 淋巴结扩大清扫、多脏器联合切除等方式也已证 明不能带来更多的生存获益,故新辅助治疗如新 辅助放/化疗等备受关注,尤其是MAGIC试验[3]。 该大样本、多中心、Ⅲ期随机临床研究证实新辅 助化疗能降低肿瘤分期,提高手术R0切除率(79% vs. 69%) ,提高5年生存率(36% vs. 23%),不良反 应可耐受,并不增加手术死亡及并发症,为“新辅 助化疗+手术+术后化疗”这种模式的应用提供了高 级别循证医学证据。但目前仍然缺乏针对新辅助 化疗具体方案的高级别证据,因此2011版NCCN胃 癌治疗指南中建议使用以铂类为基础的多药联合 新辅助化疗方案。
FOLFOX方案已成为进展期胃癌的治疗方法 之一。Ji等[9]对15例进展期(ⅢB or Ⅳ)胃癌患者使 用FOLFOX方案,发现7例部分缓解及6例病情稳 定,且该方案耐受性好。Zhang等[10]报导了改良 FOLFOX7新辅助化疗方案治疗进展期胃癌,结果 显示该方案临床缓解率达50%。Al Batran等 [11]、Luo等[12]使用FOLFOX6方案治疗进展期胃癌, 其临床缓解率为43.2%、41.2%。De Vita等[5]运用 FOLFOX4方案,其临床缓解率为38%。本研究观 察了FOLFOX4方案的临床疗效,其临床缓解率(腹 部CT评价)达到了43.5%(CR 0%,PR 43.5%),与国 内外的临床研究结果相似,再次肯定了FOLFOX4 方案的临床疗效。
临床缓解率是评判化疗疗效的重要指标,但 是各种化疗方案所导致的化疗不良反应也应引起 重视。术前ECF方案(表阿霉素、顺铂和5-Fu)化疗 临床缓解率可以达到49%~56% [3,13],但23.8%的患 者出现Ⅲ~Ⅳ度的粒细胞减少,2%~6%的出现Ⅲ ~Ⅳ度的非血液性不良反应[3]。与ECF方案相比, FOLFOX方案似乎更安全,更易耐受。De Vita及 Al-Batran的研究使用FOLFOX方案[5,11],其间未出现Ⅲ~Ⅳ度的神经毒性反应及粒细胞减少,出现的 Ⅰ~Ⅱ度的粒细胞减少及消化道反应在给予对症支 持治疗后缓解。在本研究中,使用FOLFOX4方案 新辅助化疗后,不良事件主要为骨髓抑制和消化 系统反应,且大部分为Ⅰ~Ⅱ度,在给予对症支持 处理后,所有患者均顺利完成全部化疗疗程,中 途无退出病例,FOLFOX4方案的安全性,耐受性 得以肯定。
患者的3年总生存率,研究组为73.9% (95% CI: 54.6~93.2)显著高于对照组40.0% (95%CI: 30.1~49.9)。已有MAGIC、FNLCC研究[3,14]显示, 新辅助化疗组五年总生存率分别为36% 、38%, 显著高于单纯手术+辅助化疗组,而Wang、Nio的 研究[15,16]中新辅助化疗组五年总生存率分别为40% 和72%,与单纯手术组相比无显著优势。前两项研 究为欧洲的多中心临床研究,优点是样本量大, 随机对照规范,有利于获得高级别循证医学证 据,但不足是手术根治范围较小,限制了其循证 医学的适用环境;后两项研究为亚洲的多中心临 床研究,优点是手术根治范围较大,但不足是样 本量较小,统计学把握度较小,随机对照的规范 性有待提高,限制了其循证医学证据的水平。
总之,本研究显示,FOLFOX4新辅助化疗方 案有利于降低进展期胃癌患者淋巴结转移率,延 长患者总生存期,且耐受性和依从性良好,但仍 需要高级别循证医学的临床研究,以明确其对进 展期胃癌患者的临床获益。
| [1] | Cunningham D, Chua YJ. East meets west in the treatment of gastric cancer[J]. N Eng J Med,2007,357(18):1863-5. |
| [2] | Wagner AD, Unverzagt S, Grothe W, et al. Chemotherapy for advanced gastric cancer[J]. Cochrane Database Syst Rev,2010,(3): CD004064. |
| [3] | Cunningham D, Allum WH, Stenning SP, et al. Perioperative c h e m o th e r a p y v e r s u s s u r g e r y a lo n e f o r r e s e c ta b le gastroesophageal cancer[J]. N Eng J Med,2006,355(1):11-20. |
| [4] | Bleiberg H, de Gramont A. Oxaliplatin plus 5-fluorouracil: clinical experience in patients with advanced colorectal cancer[J]. Semin Oncol,1998,25 (2 Suppl 5):32-9. |
| [5] | De Vita F, Orditura M, Matano E, et al. A phase Ⅱ study of biweekly oxaliplatin plus infusional 5-fluorouracil and folinic acid (FOLFOX-4) as first-line treatment of advanced gastric cancer patients[J]. Br J Cancer,2005,92(9):1644-9. |
| [6] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version1.1)[J]. Eur J Cancer,2009,45(2):228-47. |
| [7] | Kuwatani M, Kawakami H, Eto K, et al. Modalities for evaluating chemotherapeutic efficacy and survival time in patients with advanced pancreatic cancer: comparison between FDG-PET, CT, and serum tumor markers[J]. Intern Med,2009,48(11):867-75. |
| [8] | Japanese Gastric Cancer Association. Japanese classification of gastric carcinoma--2nd English edition--response assessment of chemotherapy and radiotherapy for gastric carcinoma: clinical criteria[J]. Gastric Cancer,2011,4(1):1-8. |
| [9] | Ji JF, Yu Z, Zhong XN,et al. Oxaliplatin-based regimen as neoadjuvant chemotherapy for Chinese patients with advanced gastric cancer: preliminary results of a phase Ⅱ study[J]. J Clin Oncol,2004,22 (14S):4184. |
| [10] | Zhang J, Chen RX, Zhang J, et al. Efficacy and safety of neoadjuvant chemotherapy with modified FOLFOX7 regimen on the treatment of advanced gastric cancer[J]. Chin Med J (Engl), 2012,125(12):2144-50. |
| [11] | Al-Batran SE, Atmaca A, Hegewisch-Becker S, et al. Phase II trial of biweekly infusional fluorouracil, folinic acid, and oxaliplatin in patients with advanced gastric cancer[J]. J Clin Oncol,2004,22 (4):658-63. |
| [12] | Luo HY, Xu RH, Zhang L, et al. A pilot study of oxaliplatin, f luor our acil and f olinic acid ( FOLFOX- 6) as f ir st- line chemotherapy in advanced or recurrent gastric cancer[J]. Chemotherapy,2008,54(3):228-35. |
| [13] | Ross P, Nicolson M, Cunningham D, et al. Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-Fu) with epirubicin, cisplatin, and PVI 5-Fu in advanced esophagogastric cancer[J]. J Clin Onco l,2002,20(8):1996-2004. |
| [14] | Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase Ⅲ trial[J]. J Clin Oncol,2011,29(13):1715-21. |
| [15] | Wang XL, Wu GX, Zhang MD, et al. A favorable impact of preoperative FPLC chemotherapy on patients with gastric cardia cancer[J]. Oncol Rep,2000,7(2):241-4. |
| [16] | Nio Y,Koike M,Omori H,et al.A randomized consent design trial of neoadjuvant chemotherapy with tegafur plus uracil (UFT) for gastric cancer--a single institute study[J]. Anticancer Res,2004,24 (3b):1879-87. |
 2014, Vol.41
2014, Vol.41