细胞间黏附连接(adheren junction system,AJS) 结构的形成是通过相邻细胞表面的E-钙依赖性钙 黏着素(E-cadherin)受体的细胞外区域的相互作 用实现的,E-cadherin的细胞质区域与连环蛋白(β-catenin)连接,β-catenin再通过α-catenin与肌动 蛋白细胞骨架相连接,这种Cadherin的跨膜结构 与细胞骨架蛋白4.1N的连接对于细胞间连接的稳 定性及正常细胞生理功能的维持是必不可少的, 细胞的恶变通常表现为组织结构中细胞骨架的根 本改变,这种改变可能通过激活一些可阻断AJs聚 集的信号转导途径来实现,而细胞骨架蛋白4.1N 与E-cadherin、β-catenin在胃癌中相互关系的研究 目前尚未见报道,本实验通过比较细胞骨架蛋白 4.1N与E-cadherin、β-catenin在癌旁胃组织及胃癌 中的表达来分析三者与胃癌临床病理学指标(分 化程度、淋巴结转移、TNM分期)的关系及三者 之间的相互关系,为研究胃癌的发病机制提供一 些临床试验和理论依据,同时也为临床治疗胃癌 提供新的潜在的作用靶点。 1 资料和方法 1.1 病例资料
收集承德医学院附属医院2009年1月—2012年1 月手术切除经病理证实的胃腺癌组织52例,其中男 32例,女20例,年龄≤60岁的30例,>60岁的22例。 高-中分化者30例,低分化者22例;无淋巴结转移19 例,有淋巴结转移33例;TNM分期Ⅰ+Ⅱ期17例、 Ⅲ+Ⅳ期35例。同时取癌旁(距离肿瘤10 cm)并经 病理证实为无癌累及的胃黏膜组织30例作为对照 组,所有病例均未作任何放化疗治疗。 1.2 主要试剂
鼠抗人细胞骨架蛋白4 .1 N与E- cad h er in、 β-catenin抗体即用型免疫组织化学试剂盒由武汉博 士德生物技术公司提供。 1.3 实验方法
采用免疫组织化学Elivision法分别检测细胞 骨架蛋白4.1N与E-cadherin、β-catenin在癌旁胃组 织与胃癌组织中的表达。将癌旁胃组织与胃癌组 织常规石蜡包埋后,4 μm连续切片,常规脱蜡至 水,以3%H2O2室温孵育10 min,在微波炉中进行 抗原修复,加正常山羊血清工作液进行封闭,分 别加细胞骨架蛋白4.1N与E-cadherin、β-catenin抗 体在37℃湿盒中温育60 min后,4℃过夜,DAB 显色、蒸馏水冲洗终止显色、苏木精对比染色、 封片、观察。组织切片用PBS替代细胞骨架蛋白 4.1N与E-cadherin、β-catenin抗体作为阴性对照, 阳性对照为已知细胞骨架蛋白4.1N与E-cadherin、 β-catenin阳性的胃癌标本及已知阳性的胃黏膜组 织标本,细胞骨架蛋白4.1N免疫组织化学染色 阳性信号为在胞膜或胞质内出现棕褐色颗粒, E-cadherin、β-catenin免疫组织化学染色阳性信号 为在胞膜出现棕褐色颗粒。 1.4 结果判定
应用CMIAS真彩色医学图象分析系统,每张 切片随机选择5个高倍(×200)视野,分别对5个 不同视野中的各组免疫组织化学结果进行吸光度 值(integral optical density,IOD)测定,然后计算 平均IOD值。 1.5 统计学方法
采用SPSS11.5统计学软件进行统计学处理, 计量资料用x±s表示。两组间均数比较用t检验, 多组间均数的比较用方差分析。并将各因子吸光 度值进行相关性分析,以P<0.05为差异有统计学 意义。 2 结果 2.1 细胞骨架蛋白4.1N、E-cadherin 和 β-catenin 在癌旁胃黏膜和胃癌组织中的表达
细胞骨架蛋白4 .1 N在胃癌组、癌旁胃黏膜 组织中表达的IOD值分别为(7.98±2.28)和(10.03± 5.23),胃癌组明显低于对照组,差异有统计学 意义(P<0.05)。E-cadherin蛋白在胃癌组、对照组 中阳性表达的IOD值分别为(9.30±3.04)和(11.12± 4.68),胃癌组明显低于对照组(P<0.05)。β-catenin 蛋白在胃癌组、对照组中阳性表达的IOD值分别为 (10.39±2.57)和(14.11±5.12),胃癌组明显低于对照 组(P<0.05),见表 1。
|
|
表 1 细胞骨架蛋白4.1N、E-cadherin和β-catenin 在癌旁胃黏膜和胃癌组织中的表达(x±s) Table 1 The expression of cytoskeletal protein 4.1N, E-cadherin and β-catenin in gastric mucosa and gastric carcinoma(x±s) |
细胞骨架蛋白4.1N的表达在高-中分化胃癌 组织中IOD值是(8.96±5.13),在低分化胃癌组织 中IOD值是(6.42±3.46),低分化组较高-中分化组 的表达显著降低,两组比较差异有统计学意义 (P<0.05);细胞骨架蛋白4.1N在无淋巴结转移 的胃癌组中的IOD值是(9.10±4.78),在有淋巴结转移的胃癌组中的IOD值是(7.31±3.14),两组比较差 异有统计学意义(P<0.05);在Ⅰ+Ⅱ期IOD值为 (9.36±6.32),在Ⅲ~Ⅳ期为(7.29±3.12),两组之间 的表达比较差异均具有统计学意义(P <0.05); 与患病年龄及性别无关(P>0.05),见表 2,图 1。
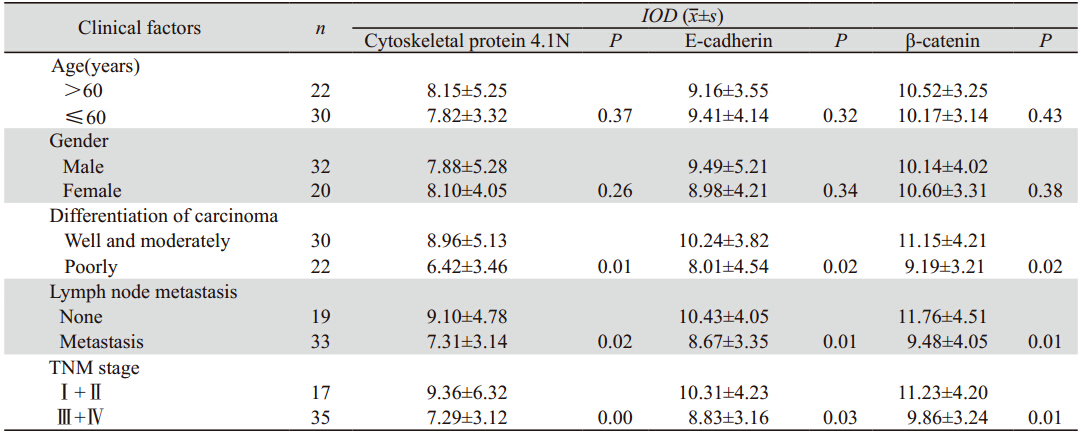
 |
A:strong positive expression in normal gastric mucosa;B:positive expression in well-and moderately-differentiated gastric carcinoma;
C:negative expression in poorly-differentiated gastric carcinoma
图1 细胞骨架蛋白4.1N在不同组织中的表达 (Elivision ×200)
Figure 1 Cytoskeletal 4.1N protein expression in different tissues (Elivision ×200) |
|
|
表 2 细胞骨架蛋白4.1N、E-cadherin、β-catenin在胃癌组织中的表达及与临床生物学特性的关系(x±s) Table 2 Relationship between the expression of cytoskeletal protein 4.1N,E-cadherin,β-catenin and clinic biological characteristics of gastric carcinoma(x±s) |
E-cadherin蛋白的表达在高-中分化胃癌组织中 IOD值是(10.24±3.82),在低分化胃癌组织中IOD值 是(8.01±4.54),差异有统计学意义(P<0.05);无 淋巴结转移的胃癌组中的IOD值为(10.43±4.05), 在有淋巴结转移的胃癌组中的I OD值为( 8 .6 7 ± 3.35),两组比较差异有统计学意义(P<0.05); 在Ⅰ+Ⅱ期IOD值为(10.31±4.23),在Ⅲ+Ⅳ期为 (8.83±3.16),两组之间比较差异有统计学意义(P <0.05);与患病年龄、性别无关(P>0.05),见表 2、 图 2。
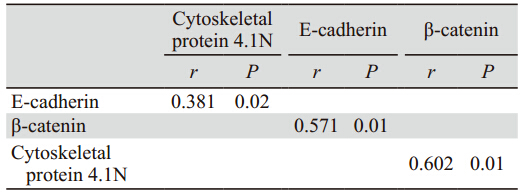
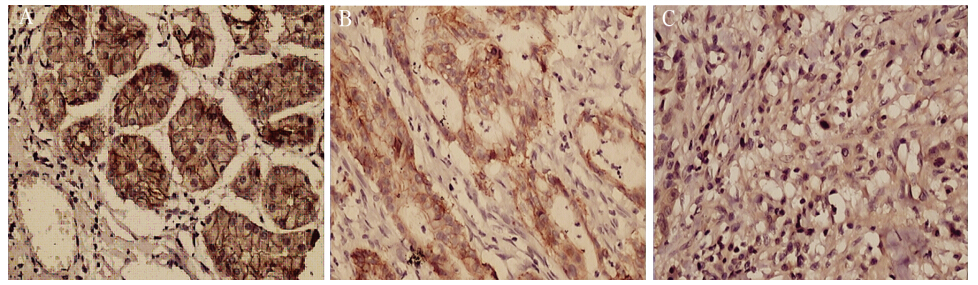 |
A:strong positive expression in normal gastric mucosa;B:positive expression in well- and moderately-differentiated gastric carcinoma;
C:negative expression in poorly-differentiated gastric carcinoma
图2 E-cadherin在不同组织中的表达 (Elivision ×200)
Figure 2 E-cadherin protein expression in different tissues (Elivision ×200) |
β-catenin蛋白的表达在高-中分化胃癌组织中 IOD值是(11.15±4.21),在低分化胃癌组织中IOD值 是(9.19±3.21),高-中分化组β-catenin蛋白的表达 较低分化组显著高,差异有统计学意义(P<0.05); 在有淋巴结转移的胃癌组中的I OD值是( 9 .4 8 ± 4.05),在无淋巴结转移胃癌组中的IOD值是(11.76 ±4.51),两组比较差异有统计学意义(P<0.05);在 Ⅰ+Ⅱ期IOD值为(11.23±4.20),在Ⅲ+Ⅳ期为(9.86± 3.24),两组之间比较差异有统计学意义(P<0.05); 与患病年龄、性别无关(P>0.05),见表 2、图 3。
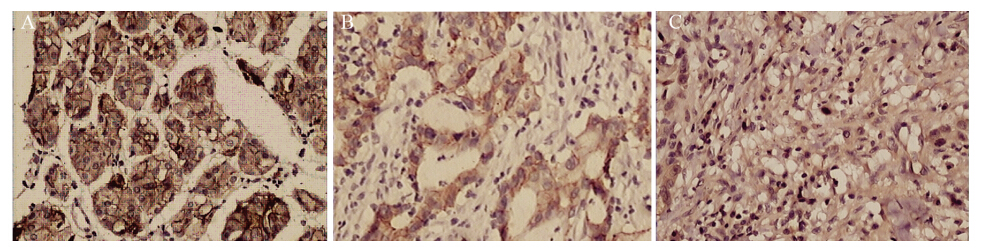
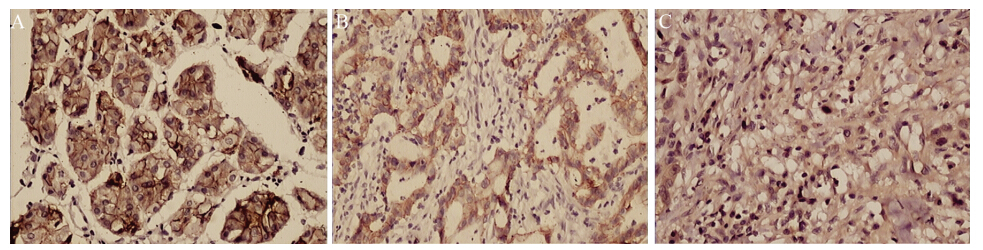 |
A:strong positive expression in normal gastric mucosa;B:positive expression in well-and moderately-differentiated gastric carcinoma; C: negative expression in poorly-differentiated gastric carcinoma
图3 β-catenin在不同组织中的表达 (Elivision ×200)
Figure 3 β-catenin protein expression in different tissues (Elivision ×200) |
细胞骨架蛋白4.1N与E-cadherin之间的表达呈正 相关(r=0.381,P<0.05),与β-catenin之间的表达呈正 相关(r=0.602,P<0.05)。E-cadherin与β-catenin之间 的表达呈正相关(r=0.571,P<0.05),见表 3。
|
|
表 3 胃癌组织中细胞骨架蛋白4 .1 N与E-cadherin、β-catenin之间的相关分析 Table 3 The correlation of cytoskeletal protein 4.1N,E-cadherin and β-catenin in gastric carcinoma |
细胞骨架蛋白4.1N作为细胞膜的组成成分能 够将膜蛋白和细胞骨架蛋白连接起来,对维持细 胞膜的稳定性和完整性有重要作用。早期的研究 主要集中在其与不同的膜蛋白的相互作用关系 上。目前,国内外对4.1N的研究集中在其神经系 统中的功能,而在消化道肿瘤方面研究较少[1]。本 实验通过免疫组织化学法研究52例胃癌组织和30 例癌旁胃黏膜组织中细胞骨架蛋白4.1N的表达情 况,实验结果显示细胞骨架蛋白4.1N在癌旁胃组 织中的表达明显高于其在胃癌组织中的表达,且 与胃癌的病理分级、TNM分期有关。细胞骨架蛋 白4.1N作为重要的膜骨架成分,可能在细胞黏附 因子和细胞内信息转导中处于“信号中转站” 的关键性作用,并因此在肿瘤的发生、发展的过程中 可能起到重要作用。此外,本研究还发现在伴有 淋巴结转移的病例中,细胞骨架蛋白4.1N的表达 程度明显低于无淋巴结转移的病例,提示细胞骨 架蛋白4.1N可能参与胃癌的淋巴结转移过程。
E-cadherin是一种跨膜糖蛋白,可以与Catenin 结合而介导Ca 2+依赖性的细胞间黏附,这对于保 持组织结构的完整性和极性起着极其重要的作 用。Park等[2]研究认为E-cadherin表达下降是胃癌 发病机制的特征之一,如Becker等[3,4,5,6,7,8]研究发现早 期胃癌特别是弥漫型胃癌与E-cadherin表达下降相 关,用cDNA转染人类胃癌细胞系来重建cadherin 可以使癌细胞丧失浸润性。当细胞间黏附作用被 抗E-cadherin单克隆抗体抑制后,非转化上皮细 胞即获得去分化和浸润的表型。这些资料充分表 明E-cadherin能够抑制肿瘤的浸润过程。在大多 数其他上皮性肿瘤中E-cadherin表达下调被认为 是一种晚期事件,标志着其表达的变化可能是转 移征象。本研究发现E-cadherin蛋白阳性表达在 胃癌组明显低于癌旁胃黏膜组织组,高-中分化组 较低分化组增高,差异有统计学意义。在有淋巴 结转移的胃癌组较无淋巴结转移的胃癌组表达降 低,两者比较差异有统计学意义。从本结果可知 E-cadherin蛋白在胃癌组表达的IOD值随着TNM分期的升高而降低,Ⅲ+Ⅳ期与Ⅰ+Ⅱ期之间表达比 较差异有统计学意义。从本结果可知,E-cadherin 表达与胃癌的去分化程度、浸润能力、组织结构 完整性、破坏程度等生物学行为具有较显著相关 性,与文献报道一致。由此可见,E-cadherin表达 异常是胃癌重要的恶性生物学指标。对胃癌组织 进行E-cadherin的检测,有助于了解及判断胃癌的 去分化程度、浸润能力以及恶性程度,从而有助 于对患者的诊断与预后情况的评估。
β-catenin是Wnt/β-catenin信号转导途径的重要 调节因子。当信号转导过程发生异常或障碍,会导 致细胞生长、分化、代谢及生物学异常,从而引起 各种疾病甚至肿瘤的发生,因此胃癌的发生、发展 过程中可能也存在着上述信号转导通路的负性调 节[9]。本研究结果显示,β-catenin蛋白阳性表达在 胃癌组低于癌旁胃黏膜组。低分化组较高-中分组 显著降低,在有淋巴结转移组较无淋巴结转移胃癌 组显著降低。不同TNM分期的胃癌之间,β-catenin 的表达水平不同,在胃癌组表达的IOD值随着TNM 分期的升高而降低,结果提示,β-catenin与胃癌的 发生、转移和侵袭性密切相关,这一结果可能与 β-catenin涉及细胞生长信号的转导有关。β-catenin 的磷酸化可能会导致β-catenin不能参与形成E-cdcat复合体,进而使细胞间的黏附连接被破坏,促进 细胞的恶性转化,同时促进了肿瘤细胞的浸润与转 移。β-catenin与肿瘤转移的关系可能还源于其异常 表达导致的E-cd-cat系统功能异常,细胞黏附性下 降或丧失,从而促进了肿瘤的浸润与转移[10,11]。
本研究对细胞骨架蛋白4.1N、E-cadherin及 β-catenin在胃癌组织中表达相关性的统计分析表 明,细胞骨架蛋白4.1N与E-cadherin、β-catenin 三者之间相互呈正相关关系,也就是说在胃癌 发生、发展过程中如果失去E-cadherin的正常表 达,可能意味着会同时失去β-catenin与细胞骨架 蛋白4.1N的正常表达,反之亦然[12]。导致这一结 果的原因可能是因为细胞骨架蛋白4.1N作为细胞 骨架蛋白与细胞膜之间的连接蛋白而存在能够与 β-catenin形成复合体在胃癌的发生、发展及转移 中发挥协同作用,同时E-cadherin与细胞骨架蛋 白4.1N有共同的定位[12],推测两种蛋白可能有直 接或者间接的联系,因此,细胞骨架蛋白4.1N、 E-cadherin及β-catenin三者在胃癌中的表达具有显 著相关性,其发生、发展及转移中可能发挥着协 同作用。
| [1] | Fukuhara S,Mochizuki N.Signaling mechanism involved in regulation of endothelial cell-cell junctions[J].Yakugaku Zasshi, 2010,130(11):1413-20. |
| [2] | Park JW,Jang SH, Park DM, et al.Cooperativity of E-cadherin and Smad4 loss to promote diffuse-type gastric adenocar cinoma and metastasis[J].Mol Cancer Res,2014 Apr 30.[Epub ahead of print] |
| [3] | Becker KF, Atkinson MJ,Reich U,et al.E-cadherin gene mutations provide clues to diffuse type gastric carcinomas[J].Cancer Res,1994,54(14):3845-52. |
| [4] | Wong H,Yau T.Molecular targeted therapies in advanced gastric cancer:does tumor histology matter?[J].Therap Adv Gastroenterol, 2013,6(1):15-31. |
| [5] | Morin PJ,Weeraratna AT.Wnt signaling in human cancer[J].Cancer Treat Res,2003,115:169-87. |
| [6] | Willert K,Nusse R.Beta-catenin:a key mediator of Wnt signaling[J].Curr Opin Genet Dev,1998,8(1):95-102. |
| [7] | Henderson BR,Fagotto F.The ins and outs of APC and beta-catenin nuclear transport[J].EMBO Rep,2002, 3(9):834-9. |
| [8] | Barker N,Morin PJ,Clevers H.The Yin-Yang of TCF/beta-catenin signaling[J].Adv Cancer Res,2000,77:1-24. |
| [9] | Ody C,Corbel C,Dunon D,et al.MHC class Ⅱ beta-chain and alphaⅡbbeta3 integrin are expressed on T-cell progenitors in embryonic bone marrow[J]. Mol Immunol,2001,38(1):45-53. |
| [10] | Peng XL,Ji MY,Yang ZR,et al.Tumor suppressor function of ezrinradixin-moesin-binding phosphoprotein-50 through β-catenin/ E-cadher in pathway in human hepatocellular cancer[J].World J Gastroenterol,2013,19(8):1306-13. |
| [11] | Bourboulia D,Han H,Jensen-Taubman S,et al.TIMP-2 modulates cancer cell transcriptional profile and enhances E-cadherin/ beta-catenin complex expression in A549 lung cancer cells[J]. Oncotarget,2013, 4(1):166-76. |
| [12] | Kang Y,Massagué J.Epithelial-mesenchymal transitions: twist in development and metastasis[J].Cell,2004,118(3):277-9. |
 2014, Vol.41
2014, Vol.41