宫颈癌的发生是一个多因素、多步骤的过 程,由正常宫颈上皮向宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),即癌前病变转化, 再发展为浸润性宫颈癌,约需要十年时间,仅有部 分上皮内瘤变最终发展为宫颈癌,因而,寻找能预 测宫颈病变发展的标志物尤为重要。持续性高危 型HPV感染是宫颈癌发生的必要条件,然而有证 据显示单一的HPV感染不足以导致宫颈癌,宿主 的基因变异在宫颈癌的发展中也起了重要作用,明 确这些遗传的改变对于宫颈癌的筛查和治疗有重 要的意义[1]。miRNA是一类长约19~25个核糖核苷 酸的非编码调控单链小分子RNA。研究已经显示 成千上万的蛋白编码的基因共同由miRNA调节[2]。 miRNA表达异常与多种肿瘤相关,其在肿瘤的发 生过程中发挥癌基因或抑癌基因的作用。已有研究 发现miRNA在宫颈癌中有异常表达,而在癌前病 变中的研究不多,研究结果也不一致。本研究采用 miRNA芯片技术筛选宫颈癌、癌前病变及正常宫 颈组织差异表达的miRNA,探讨miRNA与宫颈癌 的关系,以期为宫颈癌的筛查提供生物标志物,为 阐明宫颈癌发生的分子机制提供新的依据。 1 资料和方法 1.1 标本资料
宫颈石蜡组织标本来自广西壮族自治区人民 医院病理科。12份标本用于miRNA芯片检测,其 中3份为宫颈鳞状细胞癌(SCC),3份为宫颈高度鳞 状上皮内病变(HSIL)(CIN2/CIN3),3份为宫 颈低度鳞状上皮内病变(LSIL)(CIN1)及3份正常 宫颈组织;60份标本用作miRNA表达的验证,包 括20份宫颈癌、20份HSIL、10份LSIL组织及10份 正常宫颈组织。标本均由病理科医生复核。所有 的宫颈癌患者在术前均未接受过放化疗及其他治 疗,正常宫颈组织来自因子宫良性病变切除的子 宫。该研究已获得医院伦理委员会同意。 1.2 miRNA芯片检测 1.2.1 RNA抽提和纯化
选取宫颈石蜡切片中 病变部分的组织,使病变组织达90%以上,采用 RecoverAllTM 总核酸提取试剂盒 (美国Ambion公 司)根据生产厂商提供的标准操作流程进行样品的总 RNA抽提,抽提所得总RNA经安捷伦2100生物分析 仪 (美国安捷伦科技公司)电泳质检合格后备用。 1.2.2 芯片实验
miRNA芯片杂交所用芯片为安 捷伦人miRNA芯片(8×15K) V12.0芯片(覆盖866个 人类相关miRNA以及89个人类病毒相关miRNA)。 芯片杂交实验及后续结果分析在上海伯豪芯片生 物技术有限公司完成。实验样品RNA采用Agilent miRNA芯片配套的试剂盒(美国安捷伦科技公司), 按照标准操作流程对样品中的miRNA分子进行荧 光标记及样品的杂交实验。芯片结果采用安捷伦 微阵列芯片扫描仪进行扫描,用Feature Extraction 软件10.7读取数据,最后采用Gene Spring软件 11.0进行归一化处理。 1.3 实时定量PCR (real-time RT-PCR)验证 1.3.1 石蜡组织总RNA抽提及反转录
石蜡切片 用二甲苯脱蜡,用QuantoBio总RNA提取试剂盒进 行总RNA抽提;用加尾法进行cDNA第一条链的合 成。借助E.coli聚合酶添加PolyA尾至总RNA,利 用QuantoBio反转录系统将加PolyA尾的总RNA逆 转录成加PolyA尾的cDNA。 1.3.2 Real-time PCR
以第一链cDNA为模板,利 用SYBR Green PCR Master Mix进行PCR扩增,反应 在20 μl的体系中进行。采用溶解曲线分析和凝胶 电泳实验来检测real-time RT-PCR产物的特异性。 U6 snRNA作为实验的内参基因。miRNA相对表达 量为2-ΔΔCt,ΔCt=(CtmiRNA-CtU6)。 1.4 靶基因的预测及功能分析
利用生物信息学方法,通过miRNA 靶标预测 工具(TargetScan、PicTar、miRanda等)对在宫颈 癌组织中明显下调的miR-218及明显上调的miR-21 的靶基因进行预测,取至少被3个软件同时预测的基 因作为靶基因。采用Gene Ontology数据库(http:// www.geneontology.org)对靶基因进行功能分析。 1.5 统计学方法
利用基因芯片显著性分析(SAM)和t检验 (t-test)进行差异表达基因分析,差异倍数为2倍 及以上(即≥2或≤0.5),Q-value (错误发现率)<5% 的miRNA为有差异的miRNA。应用SPSS软件对 PCR结果进行统计分析,组间miRNA表达水平比 较采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 miRNA芯片检测结果 2.1.1 宫颈癌组织中差异表达的miRNA
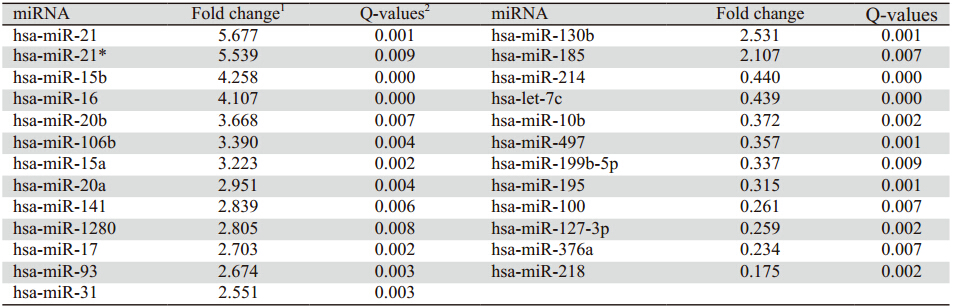
利用宫 颈SCC、HSIL、LSIL组织和正常宫颈组织进行 miRNAs芯片分析,聚类分析结果显示在不同的 宫颈组织中存在差异表达的miRNA。与正常宫颈 组织比较,宫颈癌组织中有15个miRNAs表达为 上调(>2倍),10个miRNAs表达为下调(<0.5倍), 其中上调4倍以上的miRNA有miR-21及miR-21* 、 miR-15b、miR-16,下调4倍以上的有miR-218及 miR-376,其中上调最明显的是miR-21,下调最明 显的是miR-218,见表 1。
|
|
表 1 宫颈癌和正常宫颈组织中差异性表达的miRNA Table 1 Differential expression of miRNAs in cervical cancer and normal tissues |
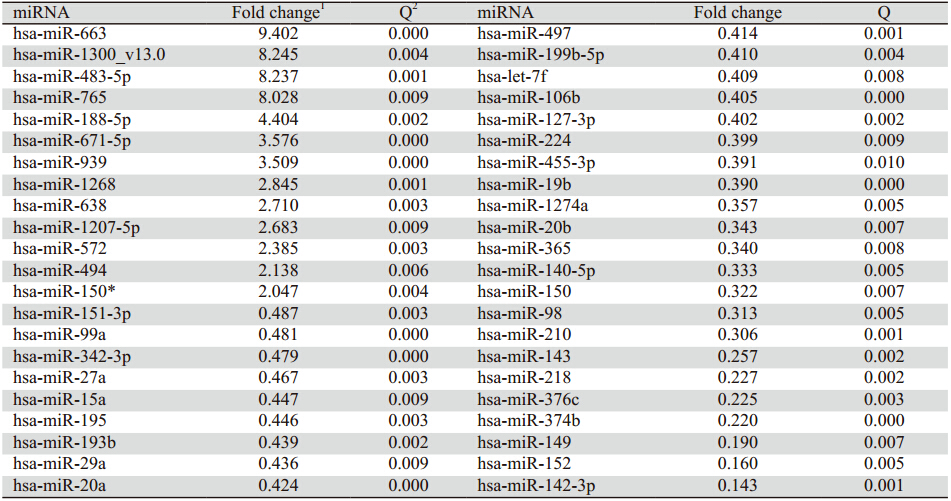
芯片分析结果显示,与正常宫颈组织比较,HSIL中 有13个miRNA表达为上调,31个miRNA表达为下 调,其中上调4倍以上的有miR-663、miR-188-5p 、 miR-765、miR-1300、miR-483-5p,下调4倍以上 的有miR-218、miR-376c、 miR-374b、miR-149、 miR-152、miR-142-3,见表 2。LSIL与正常宫颈组 织比较,仅miR-1260表现为2倍的下调(0.441倍, P=0.008),其他miRNA未显示出差异性表达。
|
|
表 2 宫颈高度鳞状上皮内病变和正常宫颈组织中差异表达的miRNA Table 2 Differential expression of miRNAs in HSIL and normal tissues |
从miRNA芯片检测结果中选取在宫颈癌组织 中有异常表达的4个miRNA,利用荧光定量RTPCR在20份宫颈癌、20份HSIL、10份LSIL及10份 正常宫颈组织中进行验证。这4个miRNA分别为 miR-21、miR-218、 miR-31、miR-376a,U6作为 内参照并进行标准化。结果显示与正常宫颈组织 比较,miR-218在宫颈癌及HSIL中均显示明显下降 (P=0.000、P<0.05),miR-21、miR-31表达在 宫颈癌组织中明显增加(P <0.00);芯片检测结 果显示miR-376a在宫颈癌及HSIL中均为下降(P <0.01),而PCR检测在HSIL中未显示出明显的下 调(P >0.05),见图 1。这4个miRNA经real-time RTPCR验证,显示与miRNA芯片基本一致的变化。
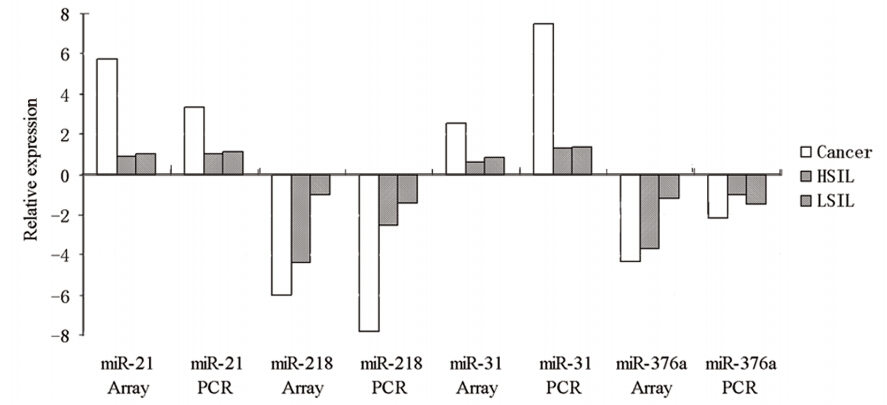 |
图1 Microarray和Real-time PT-PCR检测4个miRNAs在宫颈癌及癌前病变组织中相对表达结果比较 Figure 1 Relative expressions of four miRNAs in cervical cancer and cervical precancerous lesions detected by realtime RT-PCR and microarray assay |
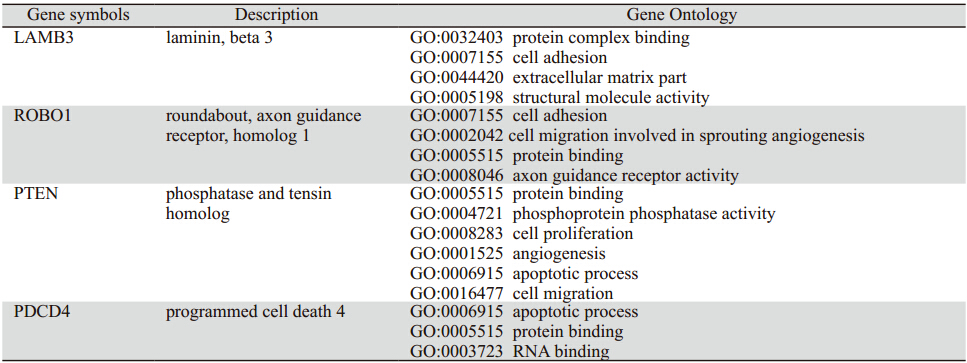
经miRNA 靶标预测工具预测,miR-218预测的靶基因有2 886个,其中LAMB3(层黏连蛋白β3) 和ROBO1(迂回的轴突引导受体1)已在一些肿 瘤中证实为miR-218的靶基因。miR-21预测的靶基 因有29 329,其中PDCD4(程序性细胞死亡蛋白 4),PTEN (磷酸酶张力蛋白)在一些肿瘤中得到验 证。利用GO数据库对这几个靶基因进行功能分析, 结果显示miR-218的靶基因LAMB3和ROBO1与细 胞的黏附和迁移有关,miR-21的靶基因PDCD4和 PTEN与细胞的增殖、迁移和凋亡有关,见表 3。
|
|
表 3 miR-218和miR-21靶基因的GO分析 Table 3 Gene ontology annotation of target genes of miR-218 and miR-21 |
目前,已有研究显示miRNA在宫颈癌组织中 有差异性表达。Lee等[3]利用实时定量PCR比较10 例正常宫颈和10例宫颈鳞状细胞癌组织的miRNA 谱的变化,发现70个miRNA的表达有明显的改变, 其中68个上调,仅有2个下调。Rao等[4]利用芯片 技术分析了13例宫颈癌及癌旁正常组织的miRNA 的表达,发现在宫颈癌组织中18个miRNA表达升 高,而19个miRNA表达下降。Huang等[5]研究显示 宫颈癌组织中7个miRNA表现为明显降调节,并与 淋巴结转移和预后有关。在本研究中,我们利用 microRNA芯片对宫颈癌、HSIL、LSIL和正常宫颈 组织进行筛查,结果显示宫颈癌中15个miRNA表 达上调,10个miRNA表达下调,其中上调最明显 的是miR-21,下调最明显的是miR-218。利用realtime RT-PCR对其中有异常表达的4个miRNA进行验证,显示出基本一致的结果。这些研究结果显 示,宫颈癌组织中存在miRNA的异常表达,这些 差异表达的miRNA可能参与了宫颈癌的发生。然 而,不同的研究显示差异表达的miRNA不一致,甚 至相反,这些不一致的结果可能是由于高通量平台 的差异、不同实验室采用的实验方法不同以及人群 遗传变异体的不同造成[6]。miRNA在用甲醛固定的 石蜡组织中有较高的稳定性,利用FFPE标本进行 miRNA表达谱分析具有准确性和实用性[7,8] ,因而我们选择较易获取的FFPE标本进行实验。由于宫 颈CIN病变常为局灶性,我们通过HE染色鉴别病变 部位,选择FFPE标本中病变部位组织进行实验,以 减少由于标本的原因而影响结果的可靠性。
miRNA在宫颈癌前病变也表现为异常表 达。Cheung等[1]研究了宫颈癌前病变(CIN2/3) 中miRNA表达谱,发现与正常宫颈比较,12个 miRNA显示高表达,这些miRNA可能与凋亡和 周期调节有关。Pereira等[6]研究了在宫颈癌、宫 颈高度和低度鳞状上皮内病变及正常宫颈组织中 miRNAs表达谱,发现至少有8个miRNA在宫颈正常 组织向癌前病变及宫颈癌发展过程中显示明显的 降调节,这些miRNA可能在肿瘤的发生中起抑制 作用;5个miRNA在正常宫颈向癌前病变和宫颈 癌转化过程中显示为上调,这些miRNA可能与宫 颈异常细胞向宫颈癌转化有关。我们的研究结果 也显示一些miRNA在HSIL中表现增高或下降,一 些在宫颈癌中明显上调的miRNA在HSIL中并不显 示高表达,而在宫颈癌中低表达的miRNA在HSIL 中也显示为低表达,如miR-218、miR-195、miR-199b-5p、miR-497,推测宫颈癌前病变向宫颈癌 转变可能与这些miRNAs的异常表达有关。芯片筛 查结果还显示,在正常宫颈与LSIL之间不存在明 显差异表达的miRNA,这可能与大部分LSIL病变 可向正常宫颈逆转有关。
研究显示miR-218及miR-21在肿瘤组织中异常 表达。miR-218在多种肿瘤组织和细胞中表现为下调并与肿瘤的生长、侵袭和转移有关,被认为是 肿瘤抑制因子[9,10,11]。miR-218在宫颈癌组织、宫颈 上皮内瘤变、宫颈癌细胞株中表现为明显的下调 [4,12,13,14] ,能明显抑制宫颈癌细胞侵袭和迁移[15,16] 。研 究已经显示miR-21在多种肿瘤组织中表达增高, 如头颈癌[17] 、子宫内膜样癌 [18]、肺癌 [19]等。也有报 道miR-21与宫颈癌有关,在多种宫颈癌细胞及宫 颈癌组织中表达明显增高[15,20],而在癌前病变组织 中并不增高[21]。我们的结果与以上研究一致,提示 miR-218在正常宫颈向宫颈癌转化过程中可能起抑 癌基因的作用,而miR-21作为癌基因起作用。
miRNA在肿瘤发生过程中的作用尚不明确, 对靶基因的功能分析有助于我们对miRNA作用机 制的理解。靶基因的预测显示miR-218及miR-21 有许多靶基因,一些靶基因在某些肿瘤中得到验 证,如miR-218的靶基因LAMB3、Robo1 [22,23,24], miR-21的靶基因 PDCD4,PTEN等[25,26]。通过靶基 因的功能分析,这些基因与肿瘤细胞的生长、凋 亡、黏附和迁移等有关。研究显示miR-218通过 作用于靶基因LAMB3与头颈鳞状细胞癌的发生有 关 [24]。又有研究发现miR-218和 LAMB3的多态性 与宫颈癌的易感性有关[27]。Robo1被认为是一个 原癌基因,具有肿瘤迁移的活性,miR-218能通过 Slit2/Robo1途径,抑制肿瘤细胞的生长、侵袭和转 移[22,23]。研究也显示miR-21能通过作用于PTEN和 PDCD4促进肿瘤细胞增长[18,26],参与肝细胞癌的侵 袭和迁移[25]。这些研究显示miR-218及miR-21通过 调节其下游的靶基因参与肿瘤的发生发展。
我们的研究显示,miRNA在宫颈癌及癌前病 变中有异常表达,这些miRNA可能与肿瘤的发生 发展有关,有可能成为潜在的肿瘤生物标志物和 分子靶标,然而这些miRNA在宫颈癌中的作用还 有待进一步研究,对miRNA靶基因的功能研究将 有助对miRNA在宫颈癌发生发展机制的理解。
| [1] | Cheung TH,Man KN,Yu MY,et al.Dysregulated microRNAs in the pathogenesis and progression of cervical neoplasm[J].Cell Cycle,2012,11(15):2876-84 |
| [2] | Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J],Cell,2005,120(1):15-20. |
| [3] | Lee JW,Choi CH,Choi JJ,et al.Altered microRNA expression in cervical carcinomas[J].Clin Cancer Res,2008,14(9):2535-42. |
| [4] | Rao Q,Shen Q,Zhou H,et al.Aberrant microRNA expression in human cervical carcinomas[J].Med Oncol,2012,29(2):1242-8. |
| [5] | Huang L,Lin JX,Yu YH,et al.Downregulation of six microRNAs is associated with advanced stage,lymph node metastasis and poor prognosis in small cell carcinoma of the cervix[J].PLoS One,2012,7(3):e33762. |
| [6] | Pereira PM,Marques JP,Soares AR,et al.MicroRNA expression variability in human cervical tissues[J].PLoS One,2010,5(7): e11780. |
| [7] | Hall JS,Taylor J,Valentine HR,et al.Enhanced stability of microRNA expression facilitates classification of FFPE tumour samples exhibiting near total mRNA degradation[J].Br J Cancer, 2012,107(4):684-94. |
| [8] | Hui AB,Shi W,Boutros PC,et al.Robust global micro-RNA profiling with formalin-fixed paraffin-embedded breast cancer tissues[J].Lab Invest,2009,89(5):597-606. [9] Venkataraman S,Birks DK,Balakrishnan I,et al.MicroRNA 218 acts as a tumor suppressor by targeting multiple cancer phenotype-associated genes in medulloblastoma[J].J Biol Chem,2013,288(3):1918-28. |
| [9] | Davidson MR,Larsen JE,Yang IA,et al.MicroRNA-218 is deleted and downregulated in lung squamous cell carcinoma[J].PLoS One,2010,5(9):e12560. |
| [10] | Gao C,Zhang Z,Liu W,et al.Reduced microRNA-218 expression is associated with high nuclear factor kappa B activation in gastric cancer[J].Cancer,2010,116(1):41-9. |
| [11] | Martinez I,Gardiner AS,Board KF,et al.Human papillomavirus type 16 reduces the expression of microRNA-218 in cervical carcinoma cells[J].Oncogene,2008,27(18):2575-82. |
| [12] | Li Y,Liu J,Yuan C,et al.High-risk human papillomavirus reduces the expression of microRNA-218 in women with cervical intraepithelial neoplasia[J].J Int Med Res,2010,38(5):1730-6. |
| [13] | Gai HX.Preliminary research on the correlation between miR-218 down-regulation and cervical cancer[J].Zhongguo Xian Dai Yi Sheng,2012,50(27):28-30.[盖红霞. miR-218下调与宫颈癌发生 相关性的初步研究[J].中国现代医生,2012,50(27):28-30.] |
| [14] | Yamamoto N,Kinoshita T,Nohata N,et al.Tumor suppressive microRNA-218 inhibits cancer cell migration and invasion by targeting focal adhesion pathways in cervical squamous cell carcinoma[J].Int J Oncol,2013,42(5):1523-32. |
| [15] | Li J,Ping Z,Ning H.MiR-218 impairs tumor growth and increases chemo-sensitivity to cisplatin in cervical cancer[J].Int J Mol Sci,2012,13(12):16053-64. |
| [16] | Tu HF,Lin SC,Chang KW.MicroRNA aberrances in head and neck cancer:pathogenetic and clinical significance[J].Curr Opin Otolaryngol Head Neck Surg,2013,21(2):104-11. |
| [17] | Qin X,Yan L,Zhao X,et al.microRNA-21 overexpression contributes to cell proliferation by targeting PTEN in endometrioid endometrial cancer[J].Oncol Lett,2012,4(6):1290-6. |
| [18] | V?sa U,Vooder T,Kolde R,et al.Meta-analysis of microRNA expression in lung cancer[J].Int J Cancer,2013,132(12):2884-93. |
| [19] | Gocze K,Gombos K,Juhasz K,et al.Unique microRNA expression profiles in cervical cancer[J].Anticancer Res,2013,33(6):2561-7. |
| [20] | Deftereos G,Corrie SR,Feng Q,et al.Expression of mir-21 and mir-143 in cervical specimens ranging from histologically normal through to invasive cervical cancer[J].PLoS One,2011,6(12): e28423. |
| [21] | Tie J,Pan Y,Zhao L,et al.MiR-218 inhibits invasion and metastasis of gastric cancer by targeting the Robo1 receptor[J].PLoS Genet,2010,6(3):e1000879. |
| [22] | Alajez NM,Lenarduzzi M,Ito E,et al.MiR-218 suppresses nasopharyngeal cancer progression through downregulation of sur vivin and the SLI T2- ROBO1 pathway[ J].Cancer Res,2011,71(6):2381-91. |
| [23] | Kinoshita T,Hanazawa T,Nohata N,et al.Tumor suppressive microRNA-218 inhibits cancer cell migration and invasion through targeting laminin-332 in head and neck squamous cell carcinoma[J].Oncotarget,2012,3(11):1386-400. |
| [24] | Yao Q,Xu H,Zhang QQ,et al.MicroRNA-21 promotes cell proliferation and down-regulates the expression of programmed cell death 4 (PDCD4) in HeLa cervical carcinoma cells[J]. Biochem Biophys Res Commun,2009,388(3):539-42. |
| [25] | Zhang JG,Wang JJ,Zhao F,et al.MicroRNA-21 (miR-21) represses tumor suppressor PTEN and promotes growth and invasion in non-small cell lung cancer (NSCLC) [J].Clin Chim Acta,2010,411 (11-12):846-52. |
| [26] | Zhou X,Chen X,Hu L,et al.Polymorphisms involved in the miR-218-LAMB3 pathway and susceptibility of cervical cancer,a case-control study in Chinese women[J].Gynecol Oncol,2010,117(2):287-90. |
 2014, Vol.41
2014, Vol.41