PTEN基因定位于人类染色体10q23,编码一 种双特异的磷酸脂质酶,被认为是一种抑癌基 因。早期研究普遍认为PTEN突变是肿瘤发生的主要原因,近几年的研究发现某些肿瘤中并未检测 到PTEN基因的突变,或突变频率很低,如胃癌、 肺癌、某些妇科肿瘤等[1,2,3],却发现PTEN基因高 甲基化与这些肿瘤的发生有关。已有研究表明, 多种基因的异常甲基化与食管癌的发生有关,如 p16、E-Cadherin及FHIT基因在食管癌中甲基化频 率均在50%以上[4,5,6],但是PTEN基因甲基化在食管 癌中的研究却少有报道。本研究检测食管鳞状细 胞癌中PTEN基因启动子区甲基化状态和PTEN基 因mRNA表达情况,旨在分析PTEN基因甲基化在 食管癌发生、发展中的作用以及PTEN基因mRNA 失表达与其甲基化之间是否存在相关性,以期对 食管癌发生的分子机制有更深入的认识。 1 资料和方法 1.1 研究对象
收集2007年8月至2010年2月在河北医科大学 第四医院胸外科行食管癌根治性切除术的患者94 例,其中男67例,女27例,年龄26~75岁,平均年 龄(59.0±8.91)岁,患者术前均未行化疗和放疗。 按UICC标准进行TNM分期,其中Ⅰ期9例,Ⅱ期53 例,Ⅲ期30例,Ⅳ期2例。按肿瘤侵及深度,T1 11 例,T2 14例,T3 61例,T4 8例;有区域淋巴结转移 的35例,无转移的59例。其中食管上段癌14例,中 段癌47例,下段癌33例。所有患者均在其出院后复 查病历,以确认诊断信息无误。 1.2 标本采集
同时采集肿瘤组织及距肿瘤组织≥3 cm的癌旁 组织约1/2黄豆大小,分别将其置于经 0.1%焦碳酸 二乙酯(DEPC)水处理后并高压消毒过的1.5 ml Eppendorf 管中,液氮速冻,然后转运至-80℃冰箱 保存备用。均经术后病理证实:肿瘤组织均为食管 鳞状细胞浸润癌,癌旁组织均为非肿瘤组织。 1.3 实验方法
以蛋白酶K(德国Merck公司)消化,酚氯仿异 戊醇抽提法提取组织DNA。将提取的组织DNA进 行亚硫酸氢钠处理。将健康者外周血白细胞DNA 用SssI甲基转移酶(新西兰BioLabs公司)处理,并 进行亚硫酸氢钠处理后作为甲基化阳性对照。以 Trizol( 美国Invitrogen公司)法提取总RNA。 1.4 甲基化特异性PCR(MSP)法
P T E N基因甲基化和非甲基化引物设计参 照Yang等[7]报告的文献。用于检测PTEN甲基化 (PTEN-M)引物序列为:5’-TTC GTT CGT CGT CGT CGT ATTT-3’(上游)和5’-GCC GCT TAA CTC TAA ACC GCA ACCG-3’(下游);检测PTEN非甲基 化(PTEN-U)引物序列为:5’-GTG TTG GTG GAG GTA GTT GTTT-3’(上游) 和5’-ACC ACT TAA CTC TAA ACC ACA ACCA -3’(下游)。取经亚硫酸盐处 理后DNA约100 ng进行MSP。反应条件为:采用 Hot-start方法进行PCR,循环参数为94℃预变性5 min,之后加入Taq-DNA聚合酶(北京赛百盛), 然后94℃变性30 s、65.5℃(甲基化引物)或62.5℃ (非甲基化引物)退火45 s、72℃延伸1 min,35个循 环后,72℃继续延伸5 min,扩增产物为206bp (甲 基化)和162bp(非甲基化)。
以经SssΙ甲基转移酶处理的健康者外周血DNA 为甲基化阳性对照,以去离子水作为阴性对照。 取PCR扩增产物10 μl,用3%琼脂糖凝胶电泳,以 Alphalmager TM2200型凝胶成像系统观察并记录 图像 。并留取PTEN-M、PTEN-U的MSP产物经 3730测序仪进行双向测序分析(上海英骏生物技术 有限公司)以证实结果的可靠性。
将单纯出现甲基化条带者或同时出现甲基化 条带和非甲基化条带者确定为甲基化状态;将单 纯出现非甲基化条带确定为非甲基化状态。 1.5 RT-PCR法
PTEN及GAPDH引物序列参照白伟良等[8]的 设计。PTEN引物:5’-TTT GAA GAC CAT AAC CCA CCA-3’ (上游); 5’-TCA TTA CAC CAG TTC GTC CCT-3’ (下游)。2,3-二羟基丙醛-3-磷酸脱 氢酶(GAPDH)内参照引物:5’- AGG TGA AGG TCG GAG TCA ACG -3’ (上游),5’-AGG GGT CAT TGA TGG CAA CA -3’ (下游)。应用RT-PCR试剂 盒(A3500,美国Promega公司)反转录合成 cDNA 第一链。在20 μl反应体系中加入cDNA 2 μl,循 环参数:94℃预变性 5 min 后,94℃30 s;53℃ (PTEN)、59℃(GAPDH)45 s;72℃60 s;35个循 环,最后72℃延伸 5 min,扩增过程采用去离子水 作为阴性对照。扩增的PTEN及GAPDH PCR产物 大小分别为136 bp、102 bp。将PCR产物于3%琼 脂糖凝胶电泳,经凝胶成像分析系统摄影,观察 PTEN及GAPDH基因mRNA表达情况。
以同时出现PTEN和GAPDH扩增条带者为 PTEN mRNA表达阳性;以仅出现GAPDH条带、 未出现PTEN条带者为PTEN mRNA表达阴性。 1.6 统计学方法
采用实际观察值(百分比)表示各统计量,数 据分析采用卡方检验及Phi相关系数检验,应用 SPSS11.5软件包完成,双侧P<0.05为差异有统计 学意义。 2 结果 2.1 PTEN基因的甲基化检测结果
PTEN基因的甲基化在食管癌组织中显著 高于食管正常组织 (P=0.00),见表 1,图 1、2。
|
|
表 1 食管癌和癌旁正常组织中PTEN甲基化分布[n(%)] Table 1 Distribution of PTEN methylation patterns in ESCC tissues and adjacent normal tissues[n(%)] |
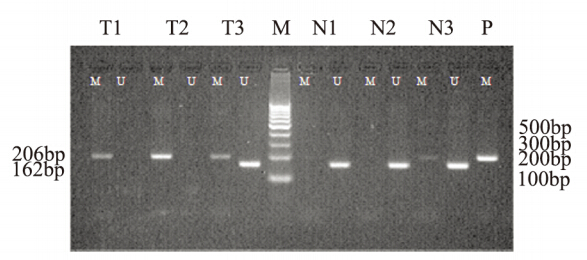 |
MSP:methylation specific polymerase chain-reaction;T1,T2 and T3:
ESCC tissues;N1,N2 and N3: adjacent normal ESCC tissues;P: positive
control of PTEN gene methylation pattern with genomic DNA treated
by SssΙ; Ma: 100bp DNA marker; M: PTEN gene methylation pattern
(206bp); U: PTEN gene unmethylation pattern (162bp)
图1 MSP法检测食管癌和癌旁正常组织中PTEN甲基化情况
Figure 1 PTEN gene methylation pattern in ESCC tissues
and adjacent normal tissues detected by MSP |
 |
1,2,3,4,6:positive PTEN mRNA expression;5:negative PTEN mRNA expression;M:100bp DNA marker
图2 RT-PCR检测PTEN基因mRNA表达
Figure 2 PTEN mRNA expression detected by RT-PCR |
94例浸润癌中,淋巴结转移阳性组和阴性组PTEN 基因甲基化频率分别为62.9%和35.6%,阳性组PTEN基 因甲基化化频率显著性高于阴性组(P=0.01),见表 2。
|
|
表 2 食管癌组织中PTEN甲基化模式与临床病理特征的关系[n(%)] Table 2 Relationship of PTEN gene methylation patterns and clinical characteristics in ESCC tissues[n(%)] |
94例浸润癌中,T1+T2组和T3+T4组PTEN基因 甲基化频率分别为56.0%和42.0%,两组相比,PTEN 基因甲基化频率差异无统计学意义(P=0.23),见表 2。 2.4 PTEN基因甲基化与食管癌临床病理分期的关系
94例浸润癌中,Ⅰ+Ⅱ期组和Ⅲ+Ⅳ期组PTEN基因 甲基化频率分别为40.3%和56.3%,两组相比,PTEN 基因甲基化频率无显著性差异(P=0.14),见表 2。 2.5 PTEN mRNA表达定性检测结果
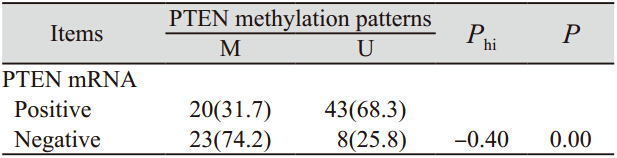
在94例食管癌组织中,63例( 67.0%) PTEN mRNA表达阳性,31例(33.0%) 表达阴性。 2.6 PTEN mRNA表达与其基因甲基化的关系
PTEN mRNA表达阳性的63例肿瘤组织中, 20例(31.7%)发生了PTEN基因的甲基化,而PTEN mRNA表达阴性的31例肿瘤组织中,23例(74.2%) 出现PTEN基因的甲基化。在PTEN mRNA失表达 个体中,PTEN基因的甲基化频率显著升高,显示 食管癌肿瘤组织中PTEN基因mRNA的失表达与其 甲基化状态有显著的相关性(Phi=-0.40,P=0.00) , 见表 3。
|
|
表 3 食管癌中PTEN mRNA表达与其甲基化的关系[n(%)] Table 3 Correlation between PTEN mRNA expression and methylation patterns in ESCC tissues[n(%)] |
通常认为基因突变、杂合性缺失(LOH)、启动 子高甲基化是抑癌基因失活并引起肿瘤发病的主 要原因。其中肿瘤抑制基因CpG岛的高甲基化已 成为研究的热点领域,食管癌也不例外。DNA甲 基化是真核细胞DNA最普遍的修饰过程,它不改 变DNA的一级结构并且在细胞正常发育、基因表 达模式以及基因组的稳定性中起着至关重要的作 用。DNA甲基化是肿瘤发生过程中常见的分子改 变之一,包括基因组总体的广泛性低甲基化和某 些特定基因启动子区域的高甲基化。对食管癌甲 基化的研究将有助于深入了解食管鳞癌发生的分 子机制,并为筛选用于食管鳞癌早期诊断和检测 其复发和转移的特异性分子标志物提供极具价值 的理论依据。
PTEN是一种抑癌基因,结构上,PTEN与鸡张力蛋白和牛辅助素有广泛同源性,在PTEN cDNA的5'端长的非翻译区含多个CG重复序列,这 为甲基化调节提供了可能。功能上,该基因编码 的蛋白PTEN能特异性地使磷脂酰肌醇-3,4,5-三磷 酸(phosphatidylinositol 3,4,5-triphosphate,PIP3)去磷 酸化,拮抗PI3K/AKT信号转导通路,具有调节细 胞生长、增殖、迁移、分化等多种效应。体内外 实验还表明,PTEN可使FAK脱磷酸,从而阻碍肿 瘤细胞的扩散、转移、侵袭。
虽然PTEN突变与多种肿瘤的发生密切相关, 但在一些肿瘤尤其是散发性肿瘤中并未检测到 PTEN基因的突变,或突变频率很低,推测在这些 肿瘤中可能存在着突变以外的其他机制,如表遗 传学的修饰、基因的甲基化。本研究中观察到, 在食管鳞状细胞癌中PTEN甲基化频率为43.7%, 与食管正常组织相比存在着显著差异,认为PTEN 甲基化与食管鳞癌的发生密切相关,这也与一些 研究者的研究一致。一些研究者分别在胃癌[9]、肺 癌[2]、散发性乳腺癌[10]、宫颈癌[3]的研究中,发现 存在PTEN基因不同程度的甲基化,PTEN甲基化 频率在19%~58%,并且认为PTEN甲基化与这些肿 瘤的发生密切相关。因此推测,除PTEN基因突变 与肿瘤的发生密切相关外,PTEN甲基化也是包括 食管癌在内的某些肿瘤发生的重要机制。
本研究显示,有淋巴结转移者PTEN甲基化高 达62.9%,显著高于无淋巴结转移者,PTEN甲基 化与食管癌的淋巴结转移密切相关,预示着PTEN 甲基化可能与食管癌预后不良有关。其原因可能 为正常PTEN基因可使FAK脱磷酸,从而阻碍肿瘤 细胞的扩散、转移,而一旦发生PTEN基因甲基 化,使PTEN基因表达受到抑制,最终造成肿瘤细 胞的扩散、转移。这在一些研究中也得到证实, Yang等[7]在宫颈癌和卵巢癌及Kang等[9]在胃癌的 研究中均发现PTEN甲基化与淋巴结转移或预后有 关。由于本研究未能对术后患者随访观察,所以 PTEN基因的甲基化情况与患者生存的关系无法确 定,这有待于今后的研究来进一步证实PTEN甲基 化在食管癌预后中的作用。此外,由于循环血中 存在肿瘤组织的游离DNA,所以,检测循环血中 PTEN基因的甲基化状态有可能为食管癌的早期筛 查、监测食管癌的复发和转移提供新的靶点。
此外本研究结果还显示,在食管癌中PTEN甲 基化与其基因失表达密切相关,提示PTEN甲基化 是引起其基因表达异常的主要机制,这也与许多 研究者的结果一致。Rizvi等[11]在印度人宫颈癌研 究中发现,在甲基化阳性病例中有41%出现PTEN 的表达缺失,并证实PTEN高甲基化与其基因失表 达相关。在一项乳腺癌的研究中也证实了PTEN甲 基化引起基因失活,导致肿瘤发生[12]。Fan等[13]在 体外实验中表明,在腺样囊性癌细胞系中,PTEN 高甲基化引起该基因低表达。并在甲基化的细胞 系中用去甲基化制剂处理后,可恢复PTEN基因的 mRNA表达,得出结论PTEN基因甲基化正是引起 表达缺失的一个主要原因。这都表明PTEN基因甲 基化导致其基因失活,而PTEN基因失活,可通过 不同途径引起细胞过度增殖,抑制细胞凋亡,从 而导致了肿瘤的转化和生长。
综上所述,本研究从表遗传学(基因甲基化)以 及转录(mRNA)水平上,较深入地探讨了食管癌发 生的分子机制,证实PTEN甲基化是食管癌发生中 常见的分子事件,并与食管癌预后有关;此外, PTEN甲基化还是其基因失活的重要原因。这为进 一步研究PTEN基因与肿瘤的关系奠定了基础,同 时也为食管癌的防治提供了理论依据。
| [1] | Sato K, Tamura G, Tsuchiya T, et al. Analysis of genetic and epigenetic alterations of the PTEN gene in gastric cancer[J]. Virchows Arch, 2002, 440(2): 160-5. |
| [2] | Soria JC, Lee HY, Lee JI, et al. Lack of PTEN expression in nonsmall cell lung cancer could be related to promoter methylation[J]. Clin Cancer Res, 2002, 8(5): 1178-84. |
| [3] | Cheung TH, Lo KW, Yim SF, et al. Epigenetic and genetic alternation of PTEN in cervical neoplasm[J]. Gynecol Oncol, 2004, 93(3): 621-7. |
| [4] | Abbaszadegan MR, Raziee HR, Ghafarzadegan K, et al. Aberrant p16 methylation, a possible epigenetic risk factor in familial esophageal squamous cell carcinoma[J]. Int J Gastrointest Cancer, 2005,36(1): 47-54. |
| [5] | Takeno S, Noguchi T, Fumoto S, et al. E-cadherin expression in patients with esophageal squamous cell carcinoma: promoter hypermethylation, Snail overexpression, and clinicopathologic implications[J]. Am J Clin Pathol,2004, 122(1): 78-84. |
| [6] | Noguchi T, Takeno S, Kimura Y, et al. FHIT expression and hypermethylation in esophageal squamous cell carcinoma[J]. Int J Mol Med, 2003,11(4): 441-7. |
| [7] | Yang HJ, Liu VW, Wang Y, et al. Differential DNA methylation profiles in gynecological cancers and correlation with clinicopathological data[J]. BMC Cancer, 2006, 6: 212. |
| [8] | Bai WL, Li W, Chen XQ, et al. The relationship between hypermethylation of the PTEN promoter and laryngeal squamous cell carcinoma[J]. Lin Chuang Er Bi Hou Ke Za Zhi, 2006, 20(6): 254-7.[白伟良, 李巍, 陈晓秋, 等. 蛋白落氨酸磷酸酶基因启动 子过甲基化与喉癌的关系[J]. 临床耳鼻喉科杂志, 2006, 20(6): 254-7.] |
| [9] | Kang YH, Lee HS, Kim WH. Promoter methylation and silencing of PTEN in gastric carcinoma[J]. Lab Invest,2002,82(3): 285-91. |
| [10] | García JM, Silva J, Pe?a C, et al. Promoter methylation of the PTEN gene is a common molecular change in breast cancer[J]. Genes Chromosomes Cancer, 2004, 41(2): 117-24. |
| [11] | Rizvi MM, Alam MS, Ali A, et al. Aberrant promoter methylation and inactivation of PTEN gene in cervical carcinoma from Indian population[J]. J Cancer Res Clin Oncol, 2011, 137(8):1255-62. |
| [12] | Khan S, Kumagai T, Vora J, et al. PTEN promoter is methylated in a proportion of invasive breast cancers[J]. Int J Cancer, 2004, 112(3): 407-10. |
| [13] | Fan X, Chen B, Xu J, et al. Methylation status of the PTEN gene in adenoid cystic carcinoma cells[J]. Mol Med Rep, 2010, 3(5):775-9. |
 2014, Vol.41
2014, Vol.41