恶性肿瘤患者发生静脉血栓栓塞症(venous thromboembolism,VTE)的风险大大增加,其中 肺癌患者增加22倍;不同时间段发生VTE风险也 不同,最初0~3月内为54倍,3~12月内降至14倍, 1~3年则为3.6倍,即使在诊断后的15年VTE风险仍 轻微升高[1]。因此关注肺癌患者凝血-纤溶状态改 变,尤其在最初诊断的几月内具有积极的临床意 义。本实验检测初次确诊肺癌的患者在化疗前、 化疗2周期后血小板计数(plateletcount,PC)、 凝血酶原时间(prothrombintime,PT)、活化部 分凝血活酶时间(activatedpartialthromboplastin time,APTT)、尿激酶纤维蛋白溶酶原激活物 (urokinaseplasminogenactivator,uPA)、组织型 纤维蛋白溶酶原激活物(tissue-typeplasminogen activator,tPA)、纤维蛋白溶酶原激活质抑制物-1 (plasminogenactivatorinhibitor-1,PAI-1)、D-二 聚体(D-dimer)等指标的动态改变,探讨上述各 项指标在肺癌患者化疗过程中的变化,分析并评 价其与肺癌患者预后的关系。 1 资料与方法 1.1 研究对象及分组 1.1.1 入选标准
初次入院明确诊断为肺癌的患 者(有安徽省蚌埠医学院第一附属医院病理学或 细胞学诊断依据);年龄≥18岁并且≤75岁;PS 评分≤2分; 晚期肺癌患者失去手术机会同意接受 化疗;签署实验知情同意书。同时符合上述各项 条件者方可入组。 1.1.2 排除标准
存在其他影响凝血-纤溶指标的 慢性疾病:如慢性阻塞性肺疾病、肝脏疾病、其 他系统肿瘤、近期手术者、正在使用抗凝剂等。 符合上述任一条件者即予排除。 1.1.3 剔除标准
中途退出者或不能坚持2周期化 疗者。 1.1.4 入选对象基本临床资料的情况
年龄、性 别、体重指数等差异均无统计学意义(P>0.05), 具有可比性,见表 1。
|
|
表 1 入选肺癌患者的基本临床资料 Table 1 Basic clinical data of all selected lung cancer patients |
收集2010年9月—2011年9月期间 蚌埠医学院第一附属医院呼吸内科住院初次确 诊为肺癌患者的临床资料,筛选出符合入选条 件的患者30例作为实验组(A组),将化疗前定 义为A1组,化疗2周期后定义为A2组。其中男15 例,女15例,年龄34~72岁,平均年龄为(55.07 ±12.09)岁;按2009年世界卫生组织肺及胸膜肿 瘤组织学类型修订方案,并参考《外科诊断病理 学》对全部资料进行统一命名和分类:小细胞肺 癌患者8例,非小细胞肺癌患者22例,其中包括腺 癌14例,鳞癌8例;临床分期:ⅢA期1例,ⅢB期 9例,Ⅳ期20例。其中1例ⅢA期患者和9例ⅢB期 患者,均因患者本人不愿先接受放疗,而入组化 疗。实验中采用的化疗方案如下:小细胞肺癌予 以“EP”方案化疗(依托泊苷注射液:60 mg/m2, 静脉滴注,第1天至第5天;顺铂注射液:(25~30) mg/m2,静脉滴注,第1天至第4天,每3周1次); 非小细胞肺癌予以“GP”方案化疗(吉西他滨注射 液:1 000 mg/m2,静脉滴注30 min,第1天、第8天 各1次;顺铂注射液:20 mg/m2,静脉滴注,第1天至 第4天,每4周1次)或“TP”方案(多西他赛注射液: 75 mg/m2,滴注1 h时;顺铂注射液:20 mg/m2,静 脉滴注,第1天至第4天,每3周1次)。 1.2.2 对照组
选择与A组患者年龄、性别比例组 成相似的并在蚌埠医学院第一附属医院体检中心健 康体检者29名作为对照组B组,其中男18例,女11 例,年龄27~73岁,平均年龄(50.52±15.86)岁。 1.3 试验方法 1.3.1 临床资料收集
记录所有入选对象基本信 息:人口学资料、既往病史、个人史、家族肿瘤 病史等。记录肺癌患者化疗前、后主要症状,生 命体征及阳性体征,分别于入组时进行全身评 价、临床分期,并于第3周期化疗前再次行胸部CT 检查及全身评价,便于评价疗效。 1.3.2 标本收集
采集实验组和对照组志愿者清晨空腹静脉血3 ml置于枸橼酸钠抗凝管(9:1) 中,半小时内离心10 min(3 000 r/min),吸取 上清液在-70℃冰箱内冻存,待测tPA、uPA及 PAI-1;同时收集血常规、凝血四项、D-dimer等常 规检查指标数据。 1.3.3 观察指标的采集与检测
记录实验组入院 次日常规检查结果,包括血常规、凝血四项以及 D-dimer(采用比浊法检测),uPA、tPA、PAI-1 的检测(均根据试剂盒说明书用ELISA法测定) 1.4 统计学方法
采用SPSS 17.0 统计软件对数据进行处理, 数据以均数±标准差(x±s)表示,数据近似符合 正态分布时,计量资料两独立样本均数比较采 用两独立样本t检验,两配对样本多参数比较用 Hotelling’s Trace 检验;计数资料采用卡方检验; 数据相关性比较采用直线相关分析,检验结果均 以 P <0.05 为差异有统计学意义。 2 结果 2.1 肺癌患者化疗前、后以及健康对照组血浆凝 血指标的比较
肺癌患者化疗前、后的凝血指标应用Hotelling’s Trace检验后发现,化疗2周期后肺癌患者PT、APTT 较化疗前有所缩短,PC较前稍减少,但差别不具有 统计学意义(P值分别为0.357、0.35、0.781),见图 1。
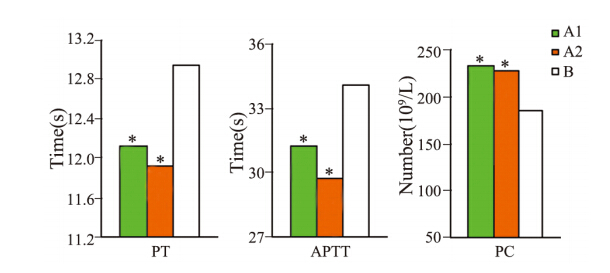 |
A1:lung cancer patients before chemotherapy; A2:lung cancer patients
after two cycles of chemotherapy; B: normal control group;*:P
<0.05,compared with Group B;PT:prothrombin time;APTT:activated
partial thromboplastin time; PC:platelet count
图1 肺癌患者化疗前、后以及健康对照组血浆凝血指标的比较
Figure 1 Differences of coagulation indexes between
normal control group and treatment groups |
肺癌患者化疗前、后的纤溶指标应用 Hotelling’s Trace检验后发现,肺癌患者化疗后 D-dimer、tPA、uPA、PAI-1均较化疗前明显升 高,且差别有统计学意义(P值分别为0.001、 0.002、0.000、0.001),见图 2。
 |
*:P<0.05, compared with Group B;#:P<0.05, compared with Group A1;uPA:urokinase plasminogen activator; tPA:tissue-type plasminogen activator; PAI-1:plasminogen activator inhibitor-1
图2 肺癌患者化疗前、后以及健康对照组血浆纤溶指标的比较
Figure 2 Differences of fibrinolytic indexes between normal control group and treatment groups |
临床获益组(包括治疗后肺癌完全缓解、部 分缓解及稳定期病例)和进展组(治疗后肺癌进 展的病例),见表 2~3。
|
|
表 2 肺癌患者化疗临床获益组与进展组凝血指标的比较 (x±s) Table 2 Comparison of coagulation indexes between clinical benefit group and progressive treatment group(x±s) |
|
|
表 3 肺癌患者化疗临床获益组与进展组纤溶指标的比较(x±s) Table 3 Comparison of fibrinolytic indexes between clinical benefit group and progressive treatment group(x±s) |
应用 SPSS 17.0统计软件对肺癌患者化疗前、 后具有显著差别的D-dimer、uPA、tPA、PAI-1两 两进行直线相关分析,发现化疗后高水平的uPA 与D-dimer、tPA、PAI-1三个指标之间均有直线 正相关关系(r分别为0.472、0.624、0.575,相 应P值分别为 0.008、0.000、0.001);D-dimer与 tPA,PAI-1均不具有直线相关性(r分别为0.305、 0.252,相应P值分别为0.102、0.179);tPA与 PAI-1也具有直线相关关系(r=0.61,P=0.000)。 可见uPA系统的三个指标之间的相关性较大,而 D-dimer仅与uPA有直线相关性。 3 讨论
近10年来,肺癌已成为发病率及病死率最高 的恶性肿瘤之一,并呈持续快速上升趋势[2],而血栓及其并发症是恶性肿瘤重要死因[3],肺癌并发 VTE风险率为5.2%~7.2%,是血栓形成发病率较高 的恶性肿瘤[4,5]。研究表明纤溶系统参与的细胞外 基质降解是肿瘤侵袭和转移的关键步骤[6],本研究 重点探讨肺癌患者uPA纤溶系统的变化。
uPA纤溶系统组分中最重要的酶为纤溶酶,而 纤溶酶原激活物则是负责将其由酶原形式激活的 重要物质,主要包括tPA和uPA。两者都是丝氨酸 蛋白超家族成员,但被不同基因编码,故免疫学 和酶学特征也不同,tPA主要由内皮细胞合成,参 与血纤维蛋白溶解,是溶栓的关键酶,而uPA由单 核细胞、巨噬细胞和上皮细胞合成,是细胞周围 蛋白水解和细胞外基质重塑的关键因子,与细胞 外基质降解和细胞迁徙相关[7]。
纤溶酶原激活物抑制剂有PAI-1、PAI-2两种, 在健康者血浆中,60%的PAI活性来自于PAI-1,是 uPA的主要抑制剂。PAI-1由血小板、上皮细胞、 颗粒细胞和肿瘤细胞生成,是Serpin超家族成员的 一种糖蛋白,以非共价键与结合在uPAR的uPA结 合,形成uPAR/uPA/PAI-1复合物,随后复合物被细 胞内吞,在溶酶体作用下,复合物被快速降解内 化,uPAR再循环至细胞表面与uPA、PAI-1结合形 成复合物,如此反复,维持胞外蛋白降解平衡。
体内纤溶系统激活与血栓形成同时发生,纤 维蛋白聚合体在纤溶酶作用下分解成多种多样的 降解产物碎片,其中包含r链相连的一个D片段, 即D-二聚体碎片,它在健康者血中含量极低,当 机体内出现凝血并继发纤溶时,血中才会大量出 现。D-dimer水平升高表明了凝血和纤溶系统的激 活及与肿瘤的生长、侵袭和转移有关[8]。
本实验发现,肺癌患者存在显著病理性高凝 状态,化疗可一定程度上加重这种异常。肿瘤细 胞不仅可以产生促凝物质,引起纤维蛋白溶解和 促聚集行为,促炎性反应和促血管生成的细胞因 子的释放,还可以通过黏附分子直接与宿主血管 和血细胞相互作用促进凝血级联反应。
本研究中肺癌患者化疗前、后各纤溶指标 D-dimer、tPA、uPA、PAI-1均显著高于健康人 群,且化疗后各指标均显著高于化疗前。肺癌患 者表现出的纤溶亢进更为显著,与高凝状态不完 全平行,表明除存在病理性高凝状态激发了纤溶 系统外,可能还存在其他原因促进了纤溶亢进。 肿瘤转移是一个多阶段过程,而细胞外基质的降 解是实现肿瘤侵袭的关键步骤,能降解细胞外基 质的蛋白酶已经被认为是肿瘤进展和侵袭临近正 常组织的关键因素。由于细胞外基质的多元化, 需要多种蛋白酶参与,其中以uPA系统研究最为广 泛。有研究已发现uPA纤溶系统不仅参与肿瘤的凝 血系统调节,更在肿瘤的侵袭、转移中起至关重 要的作用[9,10]。
本实验最为突出的是化疗前、后u PA、D-dimer在化疗进展组显著高于化疗有效组,且两 者有良好相关性,这表明uPA和D-dimer一定程度 上提示肺癌患者预后,联合监测可能指导意义更 强,有望成为评估肿瘤发展、缓解或疗效的定量 检测指标,国内外也有相关报道。一项NSCLC的 预后因素调查指出,肿瘤相关预后因素中确定的 生化指标包括LDH、血清蛋白和D-dimer [11]。国内 研究指出uPA、uPAR在肺癌侵袭和转移中起重要 作用,两者蛋白表达与淋巴道转移呈正相关,且 两者蛋白表达之间存在良好相关性,两者均可作 为评价肺癌患者预后的指标[12]。uPA对肿瘤的预后 影响不仅见于肺癌,在乳腺癌、卵巢癌、胃癌、 食管癌、结肠癌和肾癌中也被证实有独立预后因 素价值,因此可预示肿瘤的病程[13]。
本实验数据显示,D-dimer在化疗后明显升 高,D-dimer在提示高凝状态中的作用尤为突出, 而且与疾病预后密切相关。肺癌患者的D-dimer水 平与疾病严重程度平行性增加,尤其在腺癌,增 加的D-dimer水平是不良预后的强烈预测因素[14]。 而Ay等[15]实验证实D-dimer可以独立预测静脉血 栓栓塞发生。国外一项多中心肿瘤研究显示高 水平D-dimer在不同肿瘤中均提示不良预后[16], Komurcuoglu等[17]发现不同治疗效果的肺癌患者其 D-dimer水平也不同,在疾病进展期的D-dimer水平 明显升高。
因本次研究受时间限制,未能随访至入组患 者整个生存期,不能有效评价实验指标与患者生 存期之间的关系,但有文献报道纤溶组分中部分 指标可影响患者生存期[18]。
本实验化疗前、后升高的uPA系统纤溶指标、 D-dimer以及各自良好的线性正相关都为今后肺癌 患者高凝状态的筛选、甚至治疗提供了新的切入 点。研究表明晚期肿瘤患者中出现的凝血-纤溶系 统异常及其在肿瘤进展中的作用,为阻断肿瘤浸 润提供了新的契机,uPA系统组分可能成为肿瘤治 疗的新靶点[19]。
本实验证实肺癌患者本身处于高凝状态,化疗 又可增加血栓形成的风险,推测预防性抗凝在肺癌 晚期患者中应用是有意义的,但在晚期和转移阶段 肿瘤患者的VTE风险性的可变性仍是未知的[20,21]。 如何制定合适剂量、适当治疗时间以减少出血风 险,并保证预防性抗凝的治疗效果,这一工作任重 而道远,需要更多大样本的临床研究证实。
| [1] | Noble S, Pasi J. Epidemiology and pathophysiology of cancerassociated thrombosis[J]. Br J Cancer, 2010, 103(4): 593-4. |
| [2] | Xu C, Gui Q, Chen W, et al. Small interference RNA targeting tissue factor inhibits human lung adenocarcinoma growth in vitro and in vivo[J]. J Exp Clin Cancer Res, 2011, 30:63. |
| [3] | Wu R, Zhang ZY. Thrombosis diseases in lung cancer: clinical analysis of 18 cases[J]. Zhongguo Shi Yong Nei Ke Za Zhi, 2006, 26(12): 924-5. [吴荣, 张振勇. 肺癌合并血栓栓塞性疾病18例分析[J]. 中国实用内科杂志, 2006, 26(12): 924-5.] |
| [4] | Donati MB. Cancer and thrombosis[J]. Haemostasis, 1994, 24(2): 128-31. |
| [5] | Hall IE, Andersen MS, Krumholz HM, et al. Predictors of venous thromboembolism in patients with advanced common solid cancers[J]. J Cancer Epidemiol, 2009,2009: 182521. |
| [6] | Chen NH, Liu JW, Zhong JJ. Ganoderic acid T inhibits tumor invasion in vitro and in vivo through inhibition of MMP expression[J]. Pharmacol Rep, 2010, 62(1): 150-63. |
| [7] | Sgier D, Zuberbuehler K, Pfaffen S, et al. Isolation and characterization of an inhibitory human monoclonal antibody specific to the urokinase-type plasminogen activator, uPA[J]. Protein Eng Des Sel, 2010, 23(4): 261-9. |
| [8] | Jiang LY, Wan RY, Lou YG, et al. Evaluation of 300 cases of plasma D dimer detection to thrombotic disease in diagnosis and treatment[J]. Zhejiang Jian Yan Yi Xue, 2009, 7(3): 21-30.[ 蒋丽 娅, 万汝根, 楼永刚,等. 300例血浆D二聚体检测对血栓性疾病的诊疗评价[J]. 浙江检验医学, 2009, 7(3): 21-30.] |
| [9] | Luo J, Sun ZJ. Impact of uPA system on breast cancer and research progress on prognosis and therapy[J]. Xian Dai Zhong Liu Xue, 2010, 18(5): 1031-4.[罗杰, 孙治君. uPA系统对乳腺癌的影响 及在预后与治疗方面的研究进展 [J]. 现代肿瘤学, 2010, 18(5): 1031-4.] |
| [10] | Cheng B, Sun SZ, Quan LJ, et al. Quantification study of expression of uPA and uPAR and their significance[J]. Jun Shi Yi Xue Ke Xue Yuan Yuan Kan, 2010, 34(4): 361-3.[ 程波, 孙锁 柱, 权兰菊,等. 尿激酶型纤溶酶原激活剂及其受体在肺癌中表 达的定量研究及其意义[J]. 军事医学科学院院刊, 2010, 34(4): 361-3.] |
| [11] | Buccheri G, Ferrigno D. Prognostic factors[J]. Hematol Oncol Clin North Am, 2004, 18(1): 187-201. |
| [12] | Chen B, Sun SZ, Wu XZ, et al. Expression and significance of AP21 and its related genes uPA, uPAR in lung cancer[J]. Beijing Shi Fan Da Xue Xue Bao(Zi Ran Ke Xue Ban), 2010, 46(4): 492-6.[程波, 孙锁柱, 吴西钊,等. AP21及其相关基因uPA、 uPAR在肺癌中的表达及其意义[J]. 北京师范大学学报(自然科 学版), 2010, 46(4): 492-6.] |
| [13] | Malik G, Knowles LM, Dhir R,et al. Plasma fibronectin promotes lung metastasis by contributions to fibrin clots and tumor cell invasion[J]. Cancer Res, 2010, 70(11): 4327-34. |
| [14] | Buccheri G, Torchio P, Ferrigno D. Plasma levels of D-dimer in lung carcinoma: clinical and prognostic significance[J]. Cancer, 2003, 97(12): 3044-52. |
| [15] | Ay C, Vormittag R, Dunkler D, et al. D-dimer and prothrombin fragment 1+2 predict venous thromboembolism in patients with cancer: results from the Vienna Cancer and Thrombosis Study[J]. J Clin Oncol, 2009, 27(25): 4124-9. |
| [16] | Ay C, Dunkler D, Pirker R, et al. High D-dimer levels are associated with poor prognosis in cancer patients[J]. Haematologica, 2012, 97(8):1158-64. |
| [17] | Komurcuoglu B, Ulusoy S, Gayaf M, et al. Prognostic value of plasma D-dimer levels in lung carcinoma[J]. Tumori, 2011, 97(6): 743-8. |
| [18] | Chen WH, Wang C, Zhang YH, et al. Influence of overexpressed coagulantic and fibrolytic components in tumor tissues on the prognosis of non-small cell lung cancer[J]. Zhonghua Yi Xue Za Zhi,2007,87(45):3228-32. [陈文慧,王辰,张予辉,等. 肺癌组织中 凝血、纤溶成分过度表达对非小细胞肺癌预后的影响[J].中华 医学杂志,2007,87(45):3228-32.] |
| [19] | Gutova M, Najbauer J, Frank RT, et al. Urokinase plasminogen activator and urokinase plasminogen activator receptor mediate human stem cell tropism to malignant solid tumors[J]. Stem Cells, 2008, 26(6): 1406-13. |
| [20] | Wun T, White RH. Epidemiology of cancer-related venous thromboembolism[J]. Best Pract Res Clin Haematol, 2009, 22(1): 9-23. |
| [21] | Khorana AA, Francis CW, Culakova E, et al. Risk factors for chemotherapy-associated venous thromboembolism in a prospective observational study[J]. Cancer, 2005, 104(12): 2822-9. |
 2014, Vol.41
2014, Vol.41





