2.哈尔滨医科大学附属第二医院
2.The Second Affiliated Hospital of Harbin Medical University
Hedgehog信号通路最初在果蝇中发现, 其功能是胚胎发展的初始调节器,哺乳动物的 Hedgehog信号转导包含三个Hedgehog同源体: Sanic(Shh)、Indian和Desert[1]。Hedgehog信号级联 最初是Hedgehog结合在十二跨膜蛋白结合1内。内 在的Ptch和解除抑制的Smo激活胶质瘤相关癌基因(Gli)转录因子[2]。Gli转录因子存在三种形式,Gli-1、Gli-2和Gli-3 [3]。尽管这个通路的详细机制 尚未被了解,一个完整长度Gli-1被输送到细胞核 以激活Hedgehog靶基因。Gli-1是Hedgehog的靶基 因,其功能仅是作为一种反式作用因子,被认为 是Hedgehog通路激活的标志物[4]。
最近的研究显示各种器官的癌症,如皮肤[5]、小脑[6]、肺[7]、骨[8]、胰腺[9]、前列腺[10]、子宫颈[11] 和乳腺[12],都伴有配体依赖的Hedgehog信号通路 的激活。Shh、Ptch和Gli-1已被报道在乳腺癌中过度 表达。此外,已有报道雌激素受体和Gli-1核易位之 间呈正相关,并且进一步研究显示激素诱导的Shh 表达激活了Hedgehog通路、促进了细胞增殖[13]。
乳腺癌是异型性很高的肿瘤之一,伴有各种 组织学、表型和临床行为。总体来说,其系统治 疗取决于激素受体状态、人类表皮生长因子受体2 (HER2)和Ki 67标记指数。还有一些其他肿瘤标 志物与乳腺癌的预后相关。
这项研究的目的是评估乳腺癌中Hedgehog信 号蛋白的表达与已知临床病理参数的关系,并且 比较患者生存率的差异,进而研究Hedgehog信号 蛋白在乳腺癌预后中的意义。 1 资料和方法 1.1 临床样本
收集1999年1月—2007年8月在赣南医学院 第一附属医院行切除术的334例原发性乳腺癌患 者。患者均为女性,年龄30~82岁(平均年龄51.3 岁),研究人群的临床病理资料,见表 1。福尔 马林固定石蜡包埋组织并且对临床数据进行回顾 性收集。核分级和组织学分级均根据诺丁汉分级 系统进行评估。肿瘤分期按照美国癌症联合委员 会第7版(AJCC)标准进行评估。334例患者中, 322例患者有完整的生存资料及随访数据。中位 随访时间为术后75.1月(范围0~179月)。21例 (6.3%)患者出现局部复发,62例(18.6%)患 者发生远处转移和36例(10.8%)患者随访期间死 亡。本研究由赣南医学院医学伦理委员会批准。
|
|
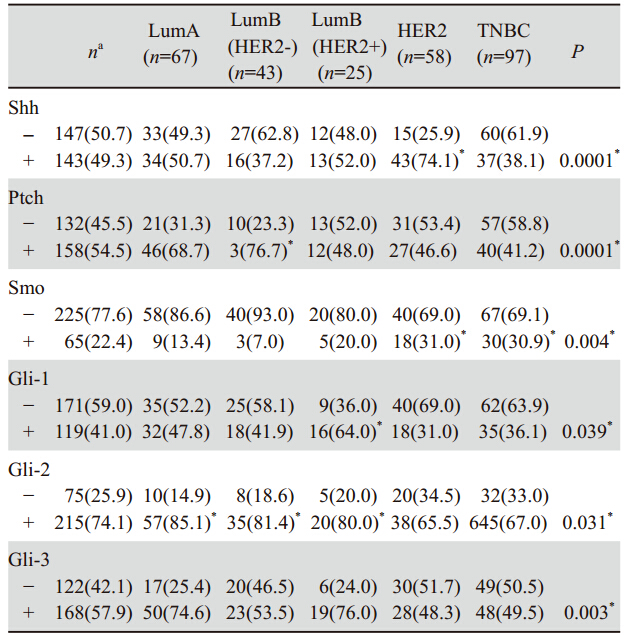
表 1 Hedgehog相关蛋白与乳腺癌患者临床病理特征之间的关系 Table 1 Relationship between Hedgehog related proteins expression and clinicopathologic factors of breast carcinoma |
组织块切片厚度为5μ m,置于多聚- L -赖 氨酸的载玻片上,60℃烤箱中烘烤40 min,脱 蜡,梯度乙醇水化,柠檬酸盐缓冲液微波抗原修 复。PBS冲洗,含3%H2O2的甲醇中室温下孵育10 min,阻断内源性过氧化物酶的活性,PBS冲 洗。主要抗体在4℃下孵育12 h。主要抗体为: Shh(1:200,EP1190Y,Epitomics公司),Ptch(1:200, ab53715,Abcam公司),Smo(1:100,ab72130,Abcam), Gli-1(1:50,ab92611,Abcam公司),Gli-2(1:400, ab7181,Abcam公司),Gli-3(1:400,PAB10052,Abnova 公司),E R ( 1:3 0 0 ,6 F 11 ,N o v o c a s t r a公司), PR(1:600,Novocastra公司),HER2(1:1 800,polyclonal 公司)和Ki-67(1:200,MM1公司)。免疫组织化学染色 使用过氧化物酶/DAB显色试剂盒(Dako公司)。 用苏木精对比染色,蒸馏水冲洗,60℃温水泡0.5 min,酒精脱水12 min、透明、包埋。
免疫组织化学染色玻片由两位病理医生独立 审查。Shh、Ptch、Smo阳性染色定位于细胞质, Gli-1、Gli-2、Gli-3定位于细胞核。染色强度分级 如下:0:阴性;1:弱;2:中度;3:强。百分 比分数按阳性细胞百分数分为:0:﹤5%;1: 5%~25%;2:>25%~50%;3:>50%~75%和4: >75%。强度得分与百分比得分相乘产生免疫反应 得分(IS)。阴性表达被定义为IS低于4。 1.3 肿瘤表型分类
乳腺癌表型按照2011圣加伦共有序列分类。 ER和P R免疫组织化学染色用奥尔雷德方法进 行评估。HER2免疫组织化学结果按如下得分判 定:0:无染色;+:在肿瘤细胞中完整膜染色≤ 10%;++:完整膜染色的强度>10%肿瘤细胞; +++:完整膜染色>30%浸润性肿瘤细胞。0和+ 为阴性,++、+++为阳性。表型分类如下:管腔 A(LumA)型:ER和(或)PR阳性,HER2阴性, Ki67指数<14%。管腔B型:HER2阴性(LumB、 HER2阴性)型:ER和(或)PR阳性,HER2阴 性和Ki67指数≥15%;HER2阳性(LumB、HER2 阳性)型:ER、PR阳性,HER2阳性和任意Ki67 值;三阴性型:ER、PR和HER2阴性。 1.4 统计学方法
数据分析使用SPSS 13.0版本完成。Hedgehog 相关蛋白与临床特征及乳腺癌表型之间的关系通 过卡方检验来分析。患者的生存使用Kaplan-Meier 生存分析,同时使用时序检验进行单因素分析。 P<0.05为差异有统计学意义。 2 结果 2.1 Shh、Ptch、Smo、Gli-1、Gli-2和Gli-3的免疫 组织化学结果
Shh、Ptch和Smo位于细胞质,Gli-1、Gli-2和 Gli-3位于细胞核,见图 1。334例乳腺癌中,Shh、 Ptch、Smo、Gli-1、Gli-2和Gli-3的阳性表达率 分别为49.1%(164/334)、54.8%(183/334)、 22.5%(75/334)、42.2%(141/334)、75.4% (252/334)和57.2%(191/334)。
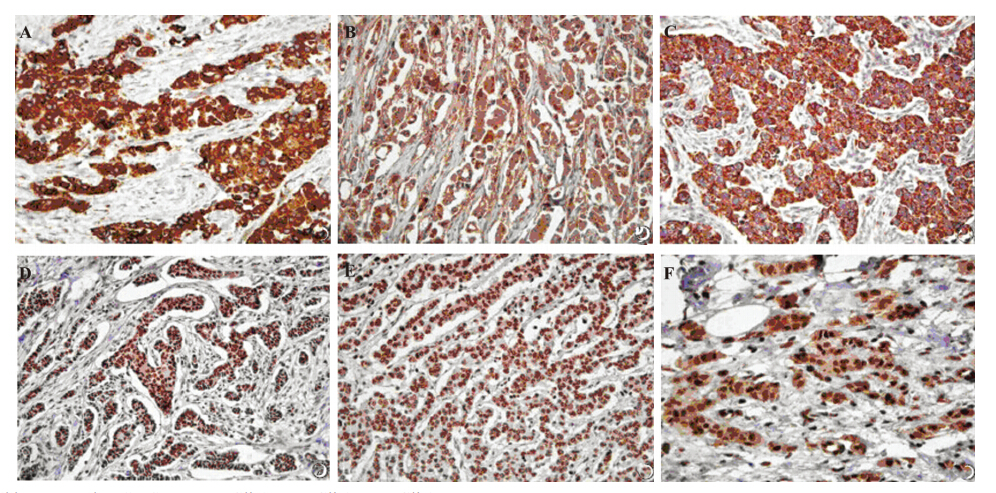 |
A:Shh;B:Ptch;C:Smo;D:Gli-1;E:Gli-2;F:Gli-3
图1 Shh、Ptch、Smo、Gli-1、Gli-2和Gli-3在乳腺癌组织中的阳性表达(SP ×40)
Figure 1 Positive expression of sonic hedgehog (Shh), patched (Ptch), smoothened (Smo), and glioma-associated oncogenes(Gli-1, Gli-2, and Gli-3) in breast carcinoma(SP ×40) |
淋巴结转移与Shh、Ptch、Gli-3的表达相关 (P分别为0.001、0.025和0.000)。Shh和Ptch表达 与分期显著相关(P分别为0.007和0.037)。核分 级与Smo(P=0.004)和Gli-3(P=0.026)有关。 组织学分级与Smo(P=0.007)有关。ER表达与 Ptch(P=0.000)、Smo(P=0.000)、Gli(P=0.008)、Gli-2(P=0.000)和Gli-3(P=0.004)有关。PR表 达与Smo(P=0.001)、Gli-1(P=0.031)和Gli-3 (P=0.003)有关。HER2表达与Shh(P=0.000)显著 相关,见表 1。 2.3 Hedgehog相关蛋白表达与乳腺癌表型之间的 关联
Shh、Ptch、Smo、Gli-1、Gli-2、Gli-3的表达 在乳腺癌不同表型之间显著不同(P分别为0.000、 0.000、0.004、0.039、0.031、0.003)。143例 (49.3%)乳腺癌组织中检测到Shh阳性表达,Shh 的表达与乳腺癌组织中HER2型(74.1%)的关系 有统计学意义。158例(54.4%)乳腺癌组织中检 测到Ptch表达,Ptch的表达与乳腺癌组织中LumB HER2阴性型(76.7%)的关系有统计学意义。在 65例(22.4%)乳腺癌组织中检测到Smo表达, Smo的表达与乳腺癌组织中HER2型、三阴型(分 别为31.0%、30.9%)的关系有统计学意义。在119 例(41.0%)乳腺癌组织中检测到Gli-1表达,Gli-1 表达与乳腺癌组织中LumBHER2阳性型(64.0%) 的关系有统计学意义。在215例(74.1%)乳腺 癌组织中检测到Gli-2表达,Gli-2的表达与LumA (85.1%)、LumBHER2阴性(81.4%)和LumB HER2阳性型(80.0%)的关系有统计学意义。在 168例(57.9%)乳腺癌组织中检测到Gli-3表达, 但Gli-3的表达与任何一种乳腺癌亚型的关系都无 统计学意义,见表 2。
|
|
表 2 Hedgehog相关蛋白与乳腺癌患者临床病理特征之间的关系 Table 2 Relationship between Hedgehog related proteins expression and clinicopathologic factors of breast carcinoma |
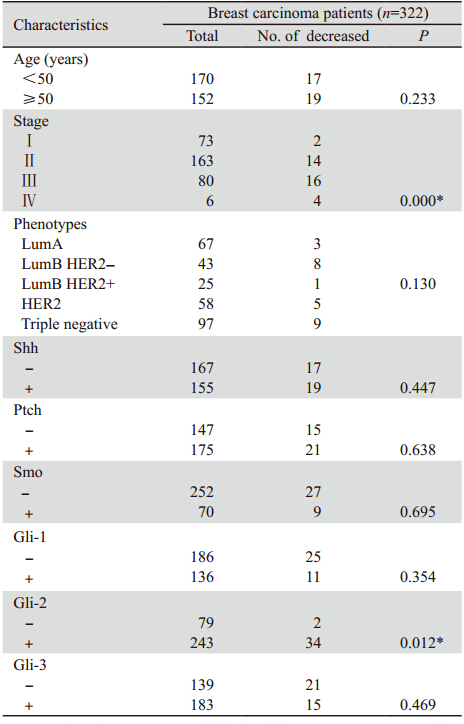
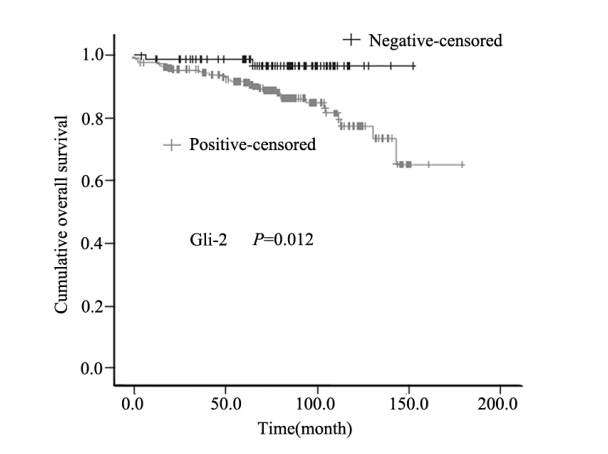
乳腺癌的肿瘤分期(P= 0 .0 0 01)与患者的 总体生存显著相关。在分析的所有Hedgehog相 关蛋白中,Gli-2阳性组较Gli-2阴性组生存率差 (P=0.012),见图 2。Shh、Ptch、Smo、Gli-1和Gli-3 与患者的预后关系无显著的统计学意义,见表 3。
 |
Cell proliferation was assessed by CyQUANT NF proliferation
kit at indicated times after serum stimulation. Proliferation rate was expressed as increased percentages = ( fluorescence density at nh – fluorescence density at 0h)/Fluorescence density at 0 h
图2 乳腺癌患者Gli-2阳性组和Gli-2阴性组的KaplanMeier生存分析
Figure 2 Kaplan-Meier survival analysis of breast
carcinoma patients in Gli-2 positive and Gli-2 negative groups |
|
|
表 3 所有生存患者临床病理特征与预后的关系 Table 3 Relationship of clinicopathologic factors and prognosis of all survival patients |
Hedgehog信号途径在胚胎发育期间控制细胞 命运和器官形成中发挥重要作用;Hedgehog信号 途径中断导致先天性无脑、面部和其他器官形成 缺陷[14]。Hedgehog信号途径激活突变与基底细胞 癌[15]和髓母细胞瘤[16]有关。
Kubo等[17]对52例乳腺癌组织进行免疫组织化 学染色,评估Shh、Ptch和Gli-1的表达,结果肿瘤 细胞分别在52个总标本中的第52、50和5个标本中 过度表达Shh、Ptch和Gli-1。另外,4个人类乳腺 癌细胞株显示Shh、Ptch和Gli-1表达增加。然而, 根据他们的结果,在T分期,淋巴结受累和肿瘤总淋巴结转移(TMN)分期之间差异无统计学意 义。ten Haaf等[18]确定在人类乳腺癌中Gli-1蛋白 水平升高与癌症的侵袭性行为相关,如高肿瘤分 期和淋巴结状态。此研究显示Hedgehog相关蛋白 的过度表达与较大的肿瘤大小(Gli-3)、更多的 淋巴结转移(Shh、Ptch和Gli-3)、更高的分期 (Shh和ptch)、更高的核分级(Smo和Gli-3)和 更高的组织学分级(Smo)有关联,均表明肿瘤的 侵袭性行为与Hedgehog相关蛋白有关。
Hedgehog相关蛋白和乳腺癌患者总体生存期 间的关系有很多研究。根据ten Haaf等[18]的报道, Gli-1高表达组总体生存率低。O'Toole等[19]评估了 在279例浸润性导管癌中Hedgehog过度表达,并且 报道Hedgehog配体表达与转移风险增加和乳腺癌 死亡显著相关。很少研究Hedgehog相关蛋白表达 和其他器官恶性肿瘤的关系。Zhang等[20]报道Gli-2 表达与肝细胞癌患者预后较差显著相关。Ding等[21] 报道结肠癌手术后无转移组其Smo表达更低。另一 方面,Lee等[22]报道Ptch和Gli-2阳性组的胃腺癌有 更好的总体生存率。然而,本研究显示Gli-2表达的 乳腺癌患者总体生存率更差,Hedgehog相关蛋白与 导致进一步侵袭性行为的临床病理特征相关。
Gli-2,哺乳动物Gli-转录因子家族的三员之 一,是已知主要作为介导Hedgehog信号细胞反应 的转录激活因子。Lewis [23]研究显示Gli-2在乳腺 发展中中断导致导管发育不良,从而导致人类乳 腺增生。然而,关于Gli-2和人类乳腺癌的研究 较少。根据Xuan等[24]的报道:Gli-2表达与PR、 Ki67、淋巴结转移和临床分期相关。我们的研究 最先报道Gli-2表达在乳腺癌患者中有较差的总体 生存率,结果表明Gli-2可作为一个预后指标。
在2011年,第12届圣加仑国际乳腺癌会议专 家面组采用一个新的方法基于治疗目的的患者 分类[25]。这个方法使用ER和PR免疫组织化学结 果、HER2状态和Ki67增殖指数识别肿瘤亚型。 (1)管腔A(LumA)型:ER和(或)PR阳性, HER2阴性,Ki67<14%;(2)管腔B型:HER阴 性(LumBHER2阴性):ER和(或)PR阳性, HER2阴性和Ki67≥15%;(3)HER2阳性(LumB HER2阳性)型:ER、PR阳性,HER2阳性和任意 Ki67值;(4)三阴型:ER、PR和HER2阴性。
本研究显示,Shh表达在HER2型更高,Ptch表 达在LumBHER2阴性型更高,Gli-1表达在LumB HER2阳性型更高。除了内分泌治疗或曲妥珠单 抗靶向治疗外,这些表型均需要化疗。Hedgehog 途径可能是这些病例中化疗的治疗目标。Smo在 HER2和三阴型中表达更低,这也要求使用药物进 行化疗。推断非甾体类化疗药通过直接结合Smo 来抑制Hedgehog途径激活。Gli-2表达在LumA、 LumBHER2阴性和LumBHER2阳性型中更高。这 三型都是ER和(或)PR阳型。Xuan等[24]报道Gli-2 表达与PR表达相关。然而,Gli-2和激素受体之间 的完整关系尚未发现。
在细胞中存在多条与乳腺癌发生发展相关的 信号转导通路:有归属于受体酪氨酸激酶(RTK) 介导的信号通路,有归属于雌激素调控的ER信号 通路,还有Notch信号转导通路、Wnt信号转导、 Hedgehog信号通路等都与乳腺癌的发生、浸润、 转移等有密切关系。随着对与乳腺癌相关信号转 导通路的深入研究发现,乳腺癌的发病机制十分 复杂,可能是上述信号途径中的两条或多条的共 同参与引起的[26,27],虽然具体的机制还不清楚,但 一定与癌基因和抑癌基因相关,这就说明一些因 子的生物学活性成为信号转导途径的关键环节。 因此,对细胞信号转导通路的研究有助于阐明乳 腺癌的发病机制。同时,对肿瘤细胞信号转导通 路的分子靶向药物研究为人类防治肿瘤开辟了新 的道路,尤其对肿瘤细胞增殖与生存、肿瘤血管 生成等方面的具有高选择性的分子靶向药物的研 究有助于我们联合化疗、放疗,显著提高疗效。
总之,Shh、Ptch、Smo、Gli- 1、Gli- 2和 Gli-3表达与各种临床病理指标显著相关,表明 Hedgehog途径的激活与更多的侵袭性临床行为相 关。最重要的是,Gli-2表达的患者预后较差,表 明Gli-2是一个有前途的预后指标。评估Hedgehog 相关蛋白可预测患者的预后,为患者选择进一步治疗方案时提供参考,Hedgehog途径可能是乳腺 癌患者化疗中一个有用的治疗靶点。
| [1] | Toftgård R. Hedgehog signalling in cancer[J].Cell Mol Life Sci,2000,57(12): 1720-31. |
| [2] | Gupta S,Takebe N,Lorusso P.Targeting the hedgehog pathway in cancer[J].Ther Adv Med Oncol,2010,2(4):237-50. |
| [3] | Katano M.Hedgehog signaling pathway as a therapeutic target in breast cancer[J].Cancer Lett,2005,227(2): 99-104. |
| [4] | Shahi MH,Rey JA,Castresana JS.The sonic hedgehog-GLI1 signaling pathway in brain tumor development[J].Expert Opin Ther Targets,2012,16(12):1227-38. |
| [5] | Rudin CM.Beyond the scalpel: targeting hedgehog in skin cancer prevention[J]. Cancer Prev Res (Phila),2010,3(1):1-3. |
| [6] | Bhatia B,Potts CR,Guldal C,et al.Hedgehog-mediated regulation of PPARγ controls metabolic patterns in neural precursors and shh-driven medulloblastoma[J].Acta Neuropathol,2012, 123(4):587-600. |
| [7] | Naqvi SH,Naqvi SH,Bandukda MY,et al.Present status and upcoming prospects of hedgehog pathway inhibitors in small cell lung cancer therapy[J]. Infect Agent Cancer,2013,8(1):17. |
| [8] | Huycke TR,Eames BF,Kimmel CB.Hedgehog-dependent proliferation drives modular growth during morphogenesis of a dermal bone[J].Development,2012,139(13):2371-80. |
| [9] | Ristorcelli E,Lombardo D.Targeting Notch signaling in pancreatic cancer[J].Expert Opin Ther Targets,2010,14(5):541-52. |
| [10] | McKee CM,Xu D,Cao Y,et al.Protease nexin 1 inhibits hedgehog signaling in prostate adenocarcinoma[J].J Clin Invest,2012,122(11): 4025-36. |
| [11] | Nakajima T,Iguchi T,Sato T.Hedgehog signaling plays roles in epithelial cell proliferation in neonatal mouse uterus and vagina[J].Cell Tissue Res,2012,348(1):239-47. |
| [12] | Das S,Samant RS,Shevde LA.The hedgehog pathway conditions the bone microenvironment for osteolytic metastasis of breast cancer[J].Int J Breast Cancer,2012,2012: 298623. |
| [13] | Onishi H,Katano M.Hedgehog signaling pathway as a therapeutic target in various types of cancer[J]. Cancer Sci,2011,102(10): 1756-60. |
| [14] | Cooper MK,Wassif CA,Krakowiak PA,et al.A defective response to Hedgehog signaling in disorders of cholesterol biosynthesis[J]. Nat Genet,2003,33(4):508-13. |
| [15] | Makinodan E,Marneros AG.Protein kinase A activation inhibits oncogenic Sonic hedgehog signalling and suppresses basal cell carcinoma of the skin[J].Exp Dermatol,2012,21(11):847-52. |
| [16] | Flora A,Klisch TJ,Schuster G,et al.Deletion of Atoh1 disrupts Sonic Hedgehog signaling in the developing cerebellum and prevents medulloblastoma[J]. Science, 2009, 326(5958): 1424-7. |
| [17] | Kubo M,Nakamura M,Tasaki A,et al.Hedgehog signaling pathway is a new therapeutic target for patients with breast cancer[J]. Cancer Res,2004,64(17): 6071-4. |
| [18] | ten Haaf A,Bektas N,von Serenyi S,et al.Expression of the glioma-associated oncogene homolog (GLI) 1 in human breast cancer is associated with unfavourable overall survival[J].BMC Cancer,2009,9:298. |
| [19] | O’Toole SA,Machalek DA,Shearer RF,et al.Hedgehog overexpression is associated with stromal interactions and predicts for poor outcome in breast cancer[J].Cancer Res,2011,71(11): 4002-14. |
| [20] | Zhang D,Cao L,Li Y,et al.Expression of glioma-associated oncogene 2 (Gli 2) is correlated with poor prognosis in patients with hepatocellular carcinoma undergoing hepatectomy[J].World J Surg Oncol,2013,11: 25. |
| [21] | Ding YL,Wang QS,Zhao WM,et al.Expression of smoothened protein in colon cancer and its prognostic value for postoperative liver metastasis[J].Asian Pac J Cancer Prev,2012,13(8): 4001-5. |
| [22] | Lee SJ,Cho SH,Yoon JY,et al.Phase II study of S-1 monotherapy in paclitaxel- and cisplatin-refractory gastric cancer[J].Cancer Chemother Pharmacol,2009,65(1):159-66. |
| [23] | Lewis MT.Hedgehog signaling in mouse mammary gland development and neoplasia[J].J Mammary Gland Biol Neoplasia, 2001,6(1):53-66. |
| [24] | Xuan Y,Lin Z.Expression of Indian Hedgehog signaling molecules in breast cancer[J].J Cancer Res Clin Oncol,2009,135(2): 235-40. |
| [25] | Goldhirsch A,Wood WC,Coates AS,et al.Strategies for subtypes--dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J].Ann Oncol,2011,22(8):1736-47. |
| [26] | Nagaria TS,Williams JL,Leduc C,et al.Flavopiridol synergizes with sorafenib to induce cytotoxicity and potentiate antitumorigenic activity in EGFR/HER- 2 and mutant RAS/RAF br east cancer model systems[J]. Neoplasia,2013,15(8):939-51. |
| [27] | Green JL,La J,Yum KW,et al.Paracrine Wnt signaling both promotes and inhibits human breast tumor growth[J].Proc Natl Acad Sci U S A,2013,110(17):6991-6. |
 2014, Vol.41
2014, Vol.41