2. 上海中医药大学附属普陀医院泌尿外科;
3.上海市(复旦大学附属)公共卫生临床中心医学检验科
前列腺癌是欧美男性发病率最高的恶性肿瘤[1], 近年来在我国的发病率逐年上升,已居男性泌尿生 系肿瘤第三位[2],前列腺癌进展机制尚不清楚。膜 联蛋白(Annexin)是一种高度保守、广泛表达,具有 多种重要功能的钙依赖磷脂结合蛋白超家族,可以 分为A1、A2、A3等近20种类型,在细胞信号转导、 钙离子通道的形成、炎性反应、肿瘤细胞的增殖与 分化、细胞骨架蛋白间的相互作用和维持细胞外 基质的完整性等方面具有重要作用[3-4]。AnnexinA2 属于膜联蛋白家族中的一员,又名Annexin Ⅱ、 ANXA2、P36、LIP2、LPC2等,近年来研究表明 AnnexinA2的异常表达与人类多种类型肿瘤的的 进展相关,例如和乳腺癌、肺癌、肝癌、结直肠 癌、肾癌、前列腺癌以及头颈部鳞状上皮癌等的 浸润和转移密切相关[5]。本文对AnnexinA2的异常 表达在前列腺癌中进展的作用机制作初步探讨。 1 材料与方法 1.1 主要实验材料、试剂及仪器
即用型免疫组织化学超敏SP试剂盒及DAB辣 根过氧化酶酶底物显色剂为福州迈新生物技术开 发公司产品。前列腺癌LNCaP(低转移潜能)、 PC-3(低转移潜能)、C4-2B(高转移潜能)细胞 株购自中南大学细胞中心,RPMI 1640培养液、胰 酶、胎牛血清为美国Gibco公司产品。pSilencer-空 载体为pSilencer 1.0-U6,AnnexinA2的siRNA干扰 重组载(ANXA2-siRNA -pSilencer 1.0-U6),对照干 扰重组载体(mock gene-siRNA-pSilencer 1.0-U6)。
AnnexinA2 siRNA干扰序列如下:5'- GCG GGA UGC UUU GAA CAU UDT DT -3'(正义), 5'- AAU GUU CAA AGC AUC CCG CDT DT -3'(反 义);对照mock gene序列为:5'- CGUACGCGG AAUACUUCGA dTdT- 3'(正义),3'- dTdTGCA U G C G C C U U A U G A A G C U - 5 ' ( 反义) 。 Lipofectamine2000,Transwell chamber,Matrigel 均为美国Santa Cruz 产品;BCA Assay Reagent、 鼠抗人Annexin A2抗体、鼠抗人β-actin抗体,辣根 过氧化物酶标记羊抗鼠二抗均为Santa Cruz公司产 品;ECL(Enhanced chemiluminescence)试剂盒,瑞 典Amersham公司产品。
1.2 临床资料
前列腺癌标本均来自上海中医药大学附属普 陀医院及中南大学湘雅二医院,2007年1月—2011年12月泌尿外科住院患者,经前列腺癌根治术或 穿刺活检获得,年龄56~85岁,中位年龄是72.8 岁,术前或穿刺前均无药物、外科去势及放射治 疗史,前列腺癌根治术36例,穿刺活检49例,所 有标本均由两位资深病理学家独立作出诊断, 并经组织病理学检查证实为前列腺腺癌并给予 Gleason评分。 1.3 研究方法 1.3.1 免疫组织化学染色及结果判定
AnnexinA2 免疫组织化学染色采用SP法,对AnnexinA2切片行 热抗原修复,将切片置0.01M枸橼酸缓冲液(pH 6.0)中煮沸(95℃,15~20min),自然冷却20 min以 上,再用冷水冲洗缸子,加快冷却至室温,PBS 冲洗5 min×3次,鼠抗人膜联蛋白Ⅱ一抗(1:200稀 释),4℃过夜。随机选取至少10个高倍镜视野(× 200),至少计数1 000个细胞,以积分法计算结 果。即根据每张切片的染色强度和阳性细胞比例 计分。着色强度:无色0分;浅黄色1分;棕黄色 2分;棕褐色3分。着色细胞比例:无着色0分; <30%为1分;30%~60%为2分;≥60%为3分。两 者相加0~2分为阴性或弱阳性;3~4分为阳性;5~6 分为强阳性。 1.3.2 脂质体转染及细胞系筛选
采用脂质体 转染试剂盒(Lipofectamine 2000)将AnnexinA2的 siRNA干扰载体(ANXA2-siRNA-pSilencer 1.0-U6) 质粒和对照载体(mock gene-siRNA-pSilencer 1.0-U6) 质粒分别转染AnnexinA2高表达PC-3细胞 系,同时将脂质体也转染PC-3细胞作为脂质体对 照组。共四个细胞株:PC-3、PC-3-Lip、PC-3- control vector、PC-3-ANXA2-siRNA。在转染24小 时收集细胞,采用Western blot检测AnnexinA2表达 水平,确定RNAi的效果,检测MMP-2/9的表达水 平。 1.3.3 噻唑蓝(methyl thiazolyl tetrazolium,MTT)绘制细胞生长曲线
将PC-3、PC-3-Lip、PC-3- 空载体、PC-3-ANXA2-siRNA细胞株分别进行计 数。以每孔500个细胞接种于96孔培养板中,每孔 体积200 μl,每组设定5孔平行复孔,同时设空白 对照(仅培养液),置CO2培养箱中孵育,每隔24 h 每组检测一次,小心吸去上清液,每孔加入200 μl 新鲜RPMI 1640培养液,再加入5 mg/ml的MTT 20 μl,37 ℃继续孵育4 h后,终止培养,小心吸弃孔 内上清液,加入150 μl DMSO,振荡10 min,使结 晶物充分溶解,以空白对照孔调零,ELX800酶标 仪490 nm处测定各孔的吸光度值(OD490值),相对应 OD490值表示细胞增殖能力大小。OD=每24 hOD值 /第24 hOD值。连续检测7天,Excel对数据进行分析 处理,绘制细胞生长曲线。 1.3.4 Western blot分析
常规行总蛋白质抽提, 样品制备,Bradford法测定蛋白浓度,转膜,丽春 红染色,封闭,一抗结合 (浓度1:1 000),摇床上 室温作用2 h,二抗结合,(浓度1:1 000),ECL化 学发光法检测,暗室中压上X光片,曝光30 s至10 min,显影,洗片。 1.3.5 体外细胞侵袭能力检测
(1)用Matrigel 包被Transwell的聚碳酯膜:① Matrigel 4℃ 冰上过 夜解冻,混匀Matrigel,用RPMI 1640无血清培养 基1:100稀释Matrigel,将侵袭小室的上室浸泡在上 述Matrigel中约5 min,放在24孔板内,无菌工作台 内紫外灯照射2~3 h;② 每个插入子内加入100 μl 用RPMI 1640无血清培养液基1:30稀释的Matrigel, 于37℃、5% CO2培养箱孵育至少4~5 h后,无菌工 作台内紫外灯照射过夜;③ 用预热的RPMI 1640 无血清培养液轻柔洗涤聚碳酯膜,包被好的聚碳 酯膜即可使用。(2)平衡侵袭小室腔:侵袭小室 腔的上下室分别加入200 μl、600 μl RPMI 1640无 血清培养液,37℃、5% CO2培养箱孵育至少1h, 以提高细胞的黏附能力。(3)侵袭能力检测:① 细胞培养至80%融合时,收集细胞用含1%FBS的 RPMI 1640 培养液洗涤细胞3次;② 用含1%FBS 的RPMI 1640 培养液重悬细胞,调整细胞数为12.5 ×104/ml;③ 侵袭小室腔的下室中加入600 μl 含 10%FBS的RPMI 1640培养液,上室中加入200 μl 细胞悬液,缓慢滴入,避免气泡;④ 37℃,5% CO2培养箱中孵育40 h;⑤ 结晶紫染色:取出插 入子,PBS冲洗3次,无水乙醇固定2 min,PBS冲 洗1次,0.1%结晶紫染色15 min,自来水漂洗;⑥ 用棉签轻轻擦拭掉聚碳酯膜上表面的细胞,显微 镜下计数穿过聚碳酯膜的细胞,观察8个高倍视野 (×200)。穿过包被Matrigel滤膜的细胞为侵袭的 细胞。实验重复3次。 1.3.6 划痕实验
在6孔板中加入PC-3、PC-3- Lip、PC-3-control vector、PC-3-ANXA2-siRNA, 每组约5×105个细胞,第二天用枪头在六孔板中作 横线划痕,枪头要垂直,不能倾斜。用PBS洗细胞 3次,除去划下的细胞,加入无血清培养液。放入 37℃,5%CO2培养箱,培养。按0 h,24 h取样, 拍照。 1.3.7 迁移实验
用Transwell 在 24 孔板中浸泡 1 h;分别消化对数生长期PC-3、PC-3-Lip、PC-3- Control Vector、PC-3-ANXA2-siRNA细胞,分别计 数,用无血清培养液洗涤2 次并配成细胞悬液,每 孔加入100 μl 细胞悬液(约1×105个细胞);下腔 室中加入含10%FBS的RPMI 1640 培养液;置37 ℃ 培养箱中孵育 20~24 h;取出 Transwell 用 PBS 洗 2 遍,5% 戊二醛固定; PBS 洗 2 遍,加入0.1%结 晶紫染色30 min,PBS 冲洗2 遍,用棉球擦去上表 面细胞,显微镜下观察计数。 1.4 统计学方法
应用SPSS17.0统计软件对实验结果进行统计 学分析,两两比较用t检验,组间多重比较采用 ANOVA LSD检验,P<0.05为差异有统计学意 义。 2 结果 2.1 AnnexinA2表达与前列腺癌Gleason评分的关系
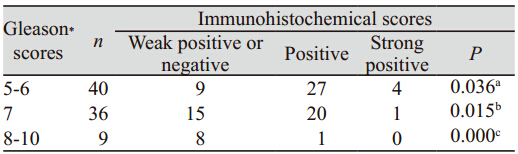
在Gl e a s o n 评分为5 ~ 6 、7 、8 ~ 1 0 分中的 AnnexinA2阳性率分别是77.5%(31/40)、58.3% (21/36)、11.1%(1/9),三者之间表达差异 有统计学意义(P<0.05),见图 1、表 1。随着 Gleason评分的增加,AnnexinA2表达下降。
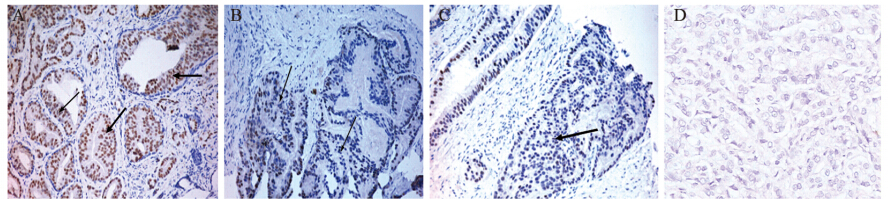 |
A:AnnexinA2 expression was strong positive in PC with Gleason scores 5-6(positive signal as shown in the black arrow); B:AnnexinA2 expression was positive in PC with Gleason scores 7(3+4);C:AnnexinA2 expression was positive in PC with Gleason scores 7(4+3);D:AnnexinA2 expression was negative in PC with Gleason scores 8-10;PC:prostate cancer 图 1 AnnexinA2在不同Gleason评分前列腺癌中的表达(SP ×200) Figure 1 AnnexinA2 expression in prostate cancer with different Gleason scores(SP ×200) |
|
|
表 1 AnnexinA2表达与前列腺癌Gleason评分的关系 Table 1 Relation between AnnexinA2 expression and Gleason scores in PC |
Western blot方法检测AnnexinA2在不同转移潜 能前列腺癌LNCaP(低转移潜能)、C4-2B(高转 移潜能)和PC-3(低转移潜能)、PC-3M(高转 移潜能)细胞系中的表达情况。Annexin A2在前列 腺癌高转移潜能细胞系C4-2B、PC-3M中的表达水 平较低转移潜能细胞系LNCaP、 PC-3中的表达水 平明显下调( P < 0.01),见图 2。
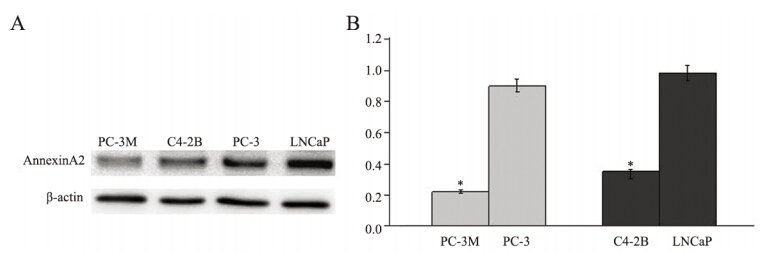 |
A: Annexin A2 expression detected by Western blot assay in four groups of PC cells;B: average relative gray of Annexin A2 expressions in four groups of PC cells;*: P < 0.01 图 2 不同转移潜能前列腺癌细胞系中AnnexinA2的表达情况 Figure 2 AnnexinA2 expression in prostate cancer cells with different metastasis potency |
将待测的四组细胞:PC-3、PC-3-Lip、PC-3- control vector、PC-3-ANXA2-siRNA,均以相同的 细胞数目接种六孔板,连续7天测定OD值,绘制生 长曲线。从生长曲线可见,PC-3、PC-3-Lip、PC- 3-control vector 三组生长速度差异无统计学意义(P >0.05);PC-3-ANXA2-siRNA生长速度增加,与 PC-3、PC-3-Lip、PC-3-control vector相比,差异有 统计学意义(P<0.05),见表 2、图 3。
|
|
表 2 四组细胞生长曲线OD值 Table 2 OD values of growth curves of four groups |
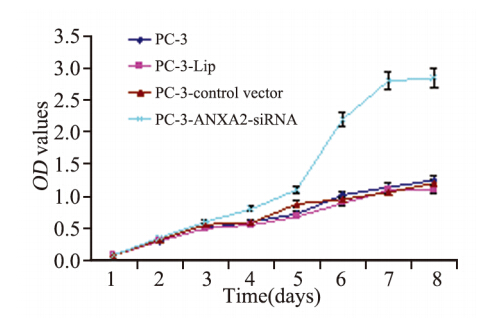 |
图 3 四组细胞生长曲线图 Figure 3 Growth curves of four groups |
Western blot检测到PC-3-ANXA2-siRNA中 Annexin A2表达明显下调,而PC-3组,PC-3-Lip 组,PC-3-control vector组AnnexinA2表达无明显改 变,说明RNAi干扰效果满意,而空白载体及脂质 体对Annexin A2的表达并无影响,见图 4。同时, PC-3-ANXA2-siRNA中Annexin A2表达下降时, MMP-2、MMP-9表达却明显增加,说明在PC-3细 胞系中Annexin A2下调能导致MMP-2、MMP-9表 达的增加。
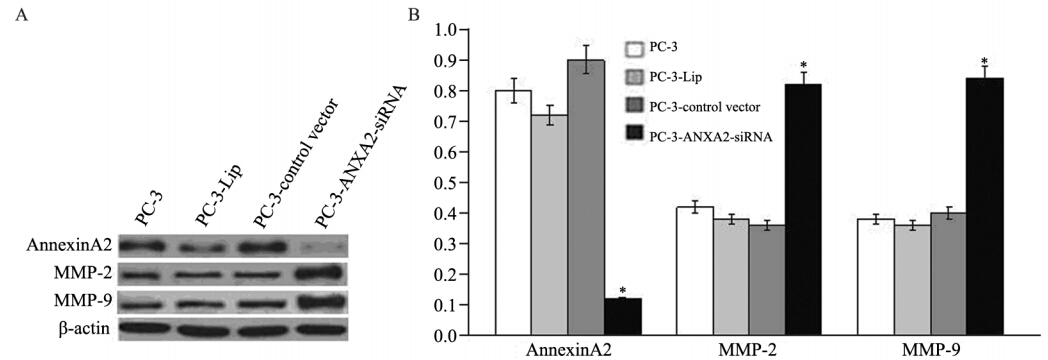 |
A: expressions of Annexin A2,MMP-2 and MMP-9 in PC-3,PC-3-Lip,PC-3-control vector and PC-3-ANXA2-siRNA cells detected by Western blot assay; B average relative gray of Annexin A2,MMP-2 and MMP-9 expressions in 4 groups of PC cells; *: P < 0.01 图 4 AnnexinA2下调对MMP-2、MMP-9表达的影响 Figure 4 Effects of down-regulating AnnexinA2 expression on MMP-2 and MMP-9 expression |
体外侵袭小室实验检测发现:PC-3-ANXA2- siRNA中的侵袭细胞计数明显高于PC-3组、PC-3- Lip组、PC-3-control vector组(P<0.05),见图 5。 说明下调Annexin A2表达能增加前列腺癌PC-3细胞的体外侵袭能力。
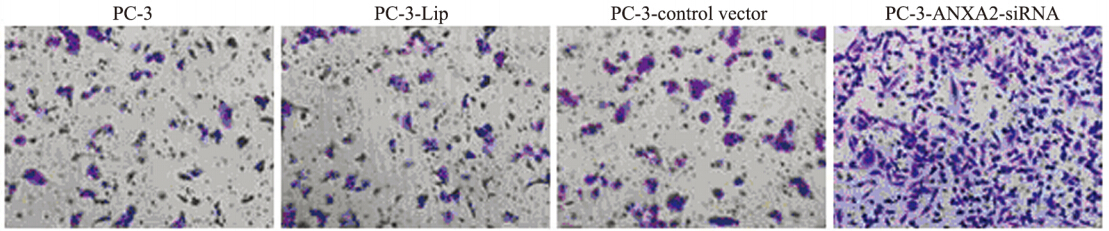 |
Invasion abilities of PC-3,PC-3-Lip,PC-3-control vector and PC-3-ANXA2-siRNA cells detected by Transwell cabinet test ×200 图 5 体外细胞侵袭实验检测结果 Figure 5 Cell invasion experiment results in vitro |
划痕实验检测发现:24 h后,往划痕中央迁移 的PC-3-ANXA2-siRNA组的细胞数目明显多于其 他三组(PC-3、PC-3-Lip、PC-3-control vector), 见图 6。
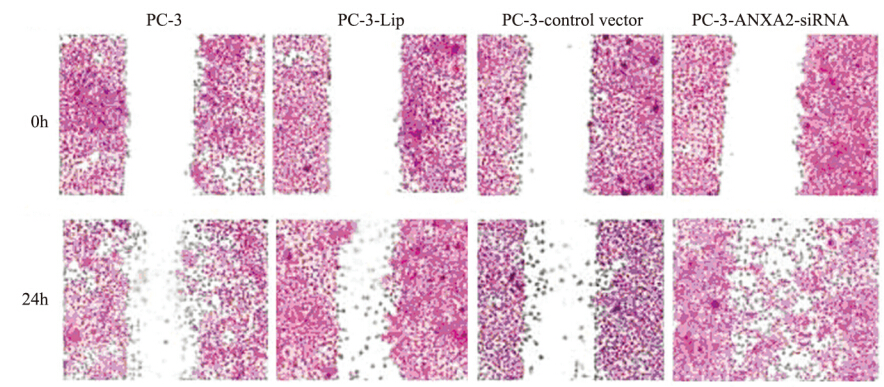 |
图 6 四组前列腺癌细胞划痕实验比较 Figure 6 Scratch test results of PC cells in four groups |
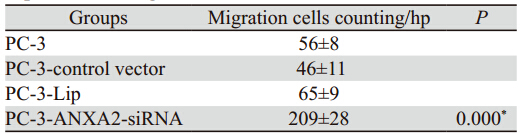
迁移实验检测发现,24 h后,迁移的PC-3- ANXA2-siRNA组细胞数目明显多于其他三组 (PC-3、PC-3-Lip、PC-3-control vector),见表 3。
|
|
表 3 Transwell小室检测Annexin A2表达改变对前列腺癌细胞迁移能力的影响 Table 3 Effects of down-regulating of AnnexinA2 expression on migration of PC cells in Transwell cabinet test |
近年来一些研究发现AnnexinA2的异常表达与人类前列腺癌的进展密切相关。我们研究发 现:AnnexinA2在Gleason评分为5~6、7、8~10 分的前列腺癌中阳性率分别是77.5%(31/40)、 58.3%(21/36)、11.1%(1/9),表明随着前列腺 癌Gleason评分的增加AnnexinA2表达下降,说明 AnnexinA2表达下调与前列腺癌的分化程度增加有 关,即AnnexinA2表达下调前列腺癌的侵袭转移能 力增强,为进一步验证AnnexinA2表达下调是否促 进前列腺癌侵袭转移,我们进行了一系列细胞功 能实验。
通过MTT实验发现AnnexinA2下调表达能促 进前列腺癌细胞的生长,说明AnnexinA2具有生长 抑制作用,即AnnexinA2表达下调能促进前列腺癌 细胞侵袭转移,与Hiozawa等研究结果一致[6],并 认为其生长抑制作用机制可能为AnnexinA2能与 c-myc结合,而c-myc基因编码的蛋白质作为转录 因子在细胞增殖中具有重要的调节作用,从而影 响肿瘤细胞的增值[7]。为进一步验证AnnexinA2表 达下调促进前列腺癌细胞侵袭转移能力增加的假 设。Western blot检测不同转移潜能前列腺癌细胞 系表达情况,AnnexinA2在高转移潜能C4-2B细胞 中的表达水平较低转移潜能PC-3、LNCaP明显下 调,差异具有统计学意义,说明AnnexinA2表达下 调促进前列腺癌细胞侵袭转移能力增加。我们进一步通过siRNA技术干扰AnnexinA2表达后,体外 侵袭实验发现siRNA组侵袭细胞计数明显高于其 他对照组,划痕实验和迁移实验发现siRNA组细 胞的体外迁移能力明显高于其他对照组,进一步 说明下调AnnexinA2表达能增加前列腺癌PC-3细胞 的体外侵袭和迁移能力。Yee等[8]发现伴随前列腺 腺癌的进展过程中,其AnnexinA2表达水平呈逐渐 下降或缺失的趋势,而转染AnnexinA2基因的前列 腺癌细胞转移能力受到了显著抑制。Stewart等[9]发 现AnnexinA2不表达的前列腺腺癌组织中mRNA水 平也很低,但AnnexinA2基因并没有缺失或突变, 推测AnnexinA2的表达可能是在转录或转录后水 平受到了抑制。我们的结果及以往的研究均提示 AnnexinA2可能是前列腺癌细胞转移特性的内源抑 制子,它的缺失表达可能在促进前列腺癌的侵袭 转移过程中起重要作用。
AnnexinA2可以和许多在肿瘤浸润和转移进程 中扮演重要角色的分子相互作用,促进多种类型 肿瘤的浸润和转移。主要包括S100家族成员、纤 溶酶原(PLG)、组织型纤溶酶原激活物(t-PA)、血 管内皮生长因子(VEGF)、腱生蛋白C(TN-C)、组 织蛋白酶B (cathepsin B)、活化的白细胞黏附分子 (ALCAM)和肌成束蛋白(fascin)等。其分子机制如 下:(1)促进肿瘤新生血管的生成从而促进肿瘤的 浸润转移:通过与VEGF及S100A4 相互作用促进 血管形成[10];活化t-PA、PLG、组织蛋白酶B等蛋 白质并促进其下游的蛋白水解级联反应,促进新 血管的生成[11]。(2) 通过以下途径促进肿瘤细胞的 浸润和转移:通过和抗黏附分子相互作用减弱肿 瘤细胞对细胞外基质成分的黏附,并刺激肿瘤细 胞释放大量蛋白酶水解细胞外基质,促进肿瘤细 胞的浸润和转移[12];通过和黏附分子(如ALCAM) 相互作用,调节不同时期肿瘤细胞的黏附和去黏 附,促进肿瘤的浸润和转移[13];通过和细胞骨架 成分结合分子(如肌成束蛋白)相互作用调节细胞运 动过程,促进肿瘤细胞的浸润和转移[6]。
细胞外基质(extracell matrix ,ECM) 是阻止 肿瘤侵袭、转移的天然屏障,恶性肿瘤在侵袭及 转移必须突破正常组织ECM,在ECM成分降解 过程中,基质金属蛋白酶(matrix metalloproteinase, MMPs) 发 挥 了 重 要 作用,MMPs被分成三组: 胶酶(Ⅳ型胶原酶) 、基质溶素和间质胶原酶。 ECM主要由Ⅳ型胶原组成,而基质金属蛋白酶-2 和 基质金属蛋白酶-9 (matrix metalloproteinase 2 and 9, MMP-2、MMP-9) 是降解Ⅳ型胶原最主要的酶, 可以降解上皮组织的ECM,从而促进恶性肿瘤的 侵袭与转移[14] ,目前MMP-2、MMP-9表达增加已 作为肿瘤的侵袭转移的重要标志物之一,Western blot检测到PC-3-ANXA2-siRNA中AnnexinA2表达明显下调,而前列腺癌细胞中MMP-2、MMP-9表 达却明显增加,表明AnnexinA2表达下调导致前 列腺癌细胞侵袭转移能力的增高可能与MMP-2和 MMP-9表达增加有关。这一研究发现有助于阐明 前列腺癌的致病机制,并可望为前列腺癌的防治 提供新的靶标。
| [1] | Ding Z, Wu CJ, Chu GC, et al. SMAD4-dependent barrier constrains prostate cancer growth and metastatic progression[J]. Nature, 2011,470(7333): 269-73. |
| [2] | Ye DW,Li CL. Epidemiological trends of prostate cancer: retrospect and prospect[J]. Zhongguo Fei Ai Za Zhi,2007,17(3):177-80. [叶定伟,李长岭. 前列腺癌发病趋势的回顾和展望[J]. 中国癌症杂志,2007, 17(3):177-80.] |
| [3] | Mussunoor S, Murray GI. The role of annexins in tumour development and progression[J]. J Pathol, 2008, 216(2):131-40. |
| [4] | Bandorowicz-Pikuła J, Woś M, Pikuła S. Participation of annexins in signal transduction, regulation of plasma membrane structure and membrane repair mechanisms[J]. Postepy Biochem,2012,58(2):135-48. |
| [5] | Bharadwaj A, Bydoun M, Holloway R, et al. Annexin A2 heterotetramer: structure and function[J]. Int J Mol Sci, 2013,14(3): 6259-305. |
| [6] | Hiozawa Y, Havens AM, Jung Y, et al. Annexin II/annexin II receptor axis regulates adhesion, migration, homing, and growth of prostate cancer[J]. J Cell Biochem, 2008, 105(2):370-80. |
| [7] | Zhang J, Guo B, Zhang Y, et al. Silencing of the annexin II gene down-regulates the level of S100A10, c-Myc, and plasmin and inhibits breast cancer cell proliferation and invasion[J]. Saudi Med J, 2010, 31(4):374-81. |
| [8] | Yee DS, Narula N, Ramzy I, et al. Reduced annexin II protein expression in high-grade prostatic intraepithelial neoplasia and prostate cancer[J]. Arch Pathol Lab Med, 2007, 131(6):902-8. |
| [9] | Stewart J, Fleshner N, Cole H, et al. Comparison of annexin II, p63 and alpha-methylacyl-CoA racemase immunoreactivity in prostatic tissue: a tissue microarray study[J]. J Clin Pathol, 2007, 60(7):773-80. |
| [10] | Bao H, Jiang M, Zhu M, et al. Overexpression of annexin II affects the proliferation, apoptosis, invasion and production of proangiogenic factors in multiple myeloma[J]. Int J Hematol, 2009, 90(2):177-85. |
| [11] | Díaz VM, Hurtado M, Thomson TM, et al. Specific interaction of tissue-type plasminogen activator (t-PA) with annexin II on the membrane of pancreatic cancer cells activates plasminogen and promotes invasion in vitro[J]. Gut, 2004, 53(7):993-1000. |
| [12] | Falsey RR, Marron MT, Gunaherath GM, et al. Actin microfilament aggregation induced by withaferin A is mediated by annexin II[J]. Nat Chem Biol, 2006, 2(1):33-8. |
| [13] | Kirshner J, Schumann D, Shively JE. CEACAM1, a cell-cell adhesion molecule, directly associates with annexin II in a threedimensional model of mammary morphogenesis[J]. J Biol Chem, 2003, 278(50):50338-45. |
| [14] | Kugler A, Hemmerlein B,Thelen P, et al. Expression of metalloproteinase-2 and 9 and their inhibitors in renal cell carcinoma[J]. J Urol, 1998, 160(5): 1914-8. |
 2014, Vol.41
2014, Vol.41