通信作者:周海波,E-mail: 276165915@qq.com
目前放射治疗为鼻咽癌的主要治疗手段,放 疗后局部区域复发是治疗失败的重要原因。鼻咽 癌存在放射敏感度的个体差异[1-2],影响鼻咽癌放 射敏感度的主要因素包括肿瘤细胞乏氧、DNA损 伤修复、细胞增殖、细胞凋亡、细胞周期等[3],有 文献报道血管内皮生长因子(vascular endothelial growth factor,VEGF)也在鼻咽癌中有不同程度 表达,并与鼻咽癌分期和放射敏感度密切相关[4]。 本研究的前期实验结果提示:通过RNAi技术阻断 VEGF的表达可改变鼻咽癌细胞的生长、增殖、迁 徙等生物学行为[5],改变VEGF水平可能影响鼻咽 癌细胞的放射敏感度,但其分子机制尚不清楚[6]。 本研究进一步探讨VEGF表达水平与鼻咽癌细胞放 疗敏感性的分子机制[7],为鼻咽癌的个体化治疗提 供重要参考。 1 材料与方法 1.1 稳定转染鼻咽癌细胞的构建
人鼻咽癌低分化上皮细胞株CNE-2,细胞来 源、真核表达载体pU-VEGF-siRNA的构建、基因 转染与稳定筛选、鉴定方法详细见文献[5]。构建针 对VEGF的siRNA真核表达载体pU-VEGF-siRNA细 胞系,分别设定CNE-2细胞实验组(CNE-2组)、 1个阴性对照质粒(CNE-2/Neg-siRNA组)和脂质 体稳定转染VEGF的CNE-2细胞(CNE-2/VEGFsiRNA 组)。 1.2 平板克隆形成实验检测细胞存活分数和放射生物学参数
将对数生长期的3组细胞分别以2.5 g/L胰蛋白 酶消化成单个细胞悬液,并作梯度倍比稀释,将不 同剂量所对应的细胞数种植到直径100 mm的培养 皿中(0、2、4 Gy照射组接种200个细胞,6 Gy 照射组接种400个细胞,8 Gy照射组接种600个细 胞,10 Gy照射组接种1000个细胞),每皿生长约 50~100个克隆的密度。每组各重复3次。待细胞 贴壁后分别接受0、2、4、6、8、10 Gy单次照射 (6 MV-X射线,剂量率为300 cGy/min)。静止 培养2~3周,当培养板出现肉眼可见的克隆时终止 培养。PBS清洗后加甲醇1 ml固定15 min,吉姆萨 液染色。将培养皿置于低倍显微镜下标记大于50 个细胞的克隆,肉眼计数克隆数。以0 Gy组计算 种植率:种植率(%) =克隆数/接种数×100%。并计 算存活分数SF,SF=照射后形成克隆数/(接种细 胞数×细胞种植率)。以SigmaPlot软件,根据单 击多靶模型SF=1-(1-e-D/D0) N拟合细胞存活曲线, 得出D0、N、Dq和2 Gy照射后的细胞存活分数 (surviving fraction after 2 Gy,SF2)等参数;根 据线性二次模型(L-Q模型)SF=e-αD-βD2拟合曲线 得到各细胞的α、β、SF2值。
1.3 流式细胞技术分析细胞周期分布和细胞凋亡的影响
对数生长期的细胞用胰酶消化后,以1.0×105 /ml 的密度传代、接种,贴壁后加入RPMI 1640培养 液培养24 h,加入新培养液。培养至72 h,胰酶消 化成单细胞悬液,冰PBS洗涤2次,1 000 g离心5 min。弃上清液,缓慢加入-20℃预冷的75%乙醇, 4℃保存。取细胞悬液,PBS洗涤,2 000 g离心5 min后,弃上清液。PI染液1.0 ml染30 min,488 nm 激发波长测定样品,620 nm带通滤片检测PI荧光。 每样本收集多于10 000个荧光信号,得出各期细胞 数占细胞总数的百分率[5]。每组重复3次。 1.4 反转录PCR(RT-PCR)定量
CNE-2组、CNE-2/Neg-siRNA组和CNE-2/ VEGF-siRNA组细胞分别以每孔3×106个细胞接种 于6孔板,细胞贴壁后予4 Gy照射剂量(6 MV X射 线),以RT-PCR法分别检测照射前(0 h)及照射 后6、12、24 h 4个时间点的三组细胞细胞周期相 关调控因子的相对表达量[5-8]。TRIzol试剂提取各 组细胞总RNA,使用紫外分光光度计调整RNA浓 度为1 g/L,以β-actin为内参照,在25μl体系中加入 VEGF上下引物0.5 μl,TaqDNA聚合酶1μl,95℃预 变性5 min后,按94℃ 30 s,58℃ 40 s,72℃30 s, 扩增39个循环,72℃延伸7 min。人VEGF、β-actin 引物由上海生工生物工程公司合成,VEGF上游引 物为5’-ATGAACTTTCTGCTGTCTTGGG-3’,下游 引物为5’-TCACCGCCTCGGCTTGTCACATC-3’, 扩增产物片断长为576 bp。β-actin上游引物为5’ -GAAGGTGAAGGTCGGAGTC-3’,下游引物为5’ -GAAGATGGTGATGGGATTTC-3’,扩增产物片断 长为226 bp。PCR产物经1%琼脂糖凝胶电泳鉴定, 紫外灯下拍照,根据各条带吸光度,采用GEL-Pro Analyzer软件分析VEGF mRNA的表达水平。 1.5 Western blot分析
取对数生长期的CNE-2、CNE-2/Neg-siRNA和 CNE-2/VEGF-siRNA细胞,消化接种于6孔板,待 90%~95%的细胞融合后继续培养24h再提取蛋白。 用Bradford法将所有蛋白调整至相同浓度性SDSPAGE 电泳,电转移法转至经甲醛处理的PVDF膜 中,封闭2 h加入一抗(兔抗人SHP-1、p53、Cyclin E 和Cyclin D1单克隆抗体),TBST漂洗40 min,HRP 标记的二抗孵育1 h漂洗45 min。暗室中行化学发光 显影扫描图、用凝胶图像处理系统分析各条带的灰 度值,并根据相对灰度值进行统计分析[5, 8]。上述实验独立重复3次。
1.6 统计学方法
以SPSS13.0软件进行统计分析,所有计量资 料以x±s表示,采用t检验,P<0.05为差异有统计学 意义。 2 结果 2.1 平板克隆形成实验检测细胞克隆形成率
3组细胞分别接受0、2、4、6、8、10 Gy单次 照射,培养2周后均有克隆形成,其克隆形成率见 表 1。CNE-2/VEGF-siRNA组克隆形成率较对照组 明显减少,差异有统计学意义(P<0.05),CNE-2组 与CNE-2/Neg-siRNA组对比无明显差异。
|
|
表 1 三组细胞接受不同剂量照射后克隆形成率(x±s,%) Table 1 Cloning efficiency of three groups after receiving different doses of radiation(x±s,%) |
计算出不同剂量下的细胞存活率,经单击 多靶模型拟合曲线显示,CNE-2组与CNE-2/NegsiRNA 组的放射生物学参数D0、N、Dq和SF2值相 似,见表 2,而CNE-2/VEGF-siRNA组的上述参数 均降低;同时从生存曲线上观察到CNE-2/VEGFsiRNA 组的斜率较另二组明显增加,“肩宽”明显缩 小变窄,各个剂量点存活分数均低于CNE-2组和 CNE-2/Neg-siRNA组,而CNE-2组和CNE-2/NegsiRNA 组差异不明显,见图 1。
 |
图 1 CNE细胞系不同剂量照射后的存活曲线 Figure 1 Cell survival curves of CNE cell lines after receiving different doses of radiation |
|
|
表 2 3组细胞单击多靶模型及线性二次模型拟合的相关参数 Table 2 Radiobiological parameters from single hit multitarget model and linear-quadratic model in three groups |
通过流式细胞技术分析不同细胞组的细胞周 期和细胞凋亡的影响,三组细胞中G0/G1、G2/M 和M期相对含量见表 3。与CNE-2组、CNE-2/NegsiRNA 组相比,CNE-2/VEGF-siRNA组G0/G1其细 胞含量明显增加,而M期细胞明显减少。三组细 胞凋亡检测见图 2,三组之间无明显差别。
|
|
表 3 流式细胞技术分析三组细胞周期相对表达量(%) Table 3 Cell expression in different cell cycles detected by flow cytometry(%) |
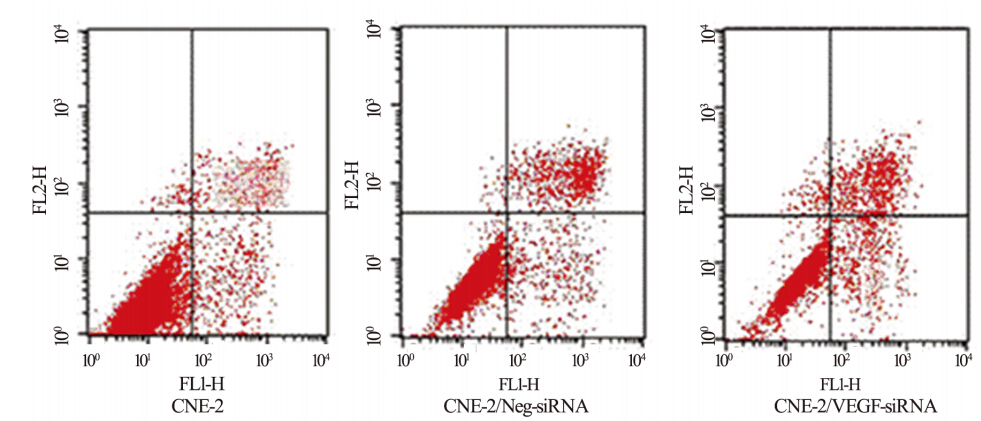 |
图 2 CNE细胞系照射后流失细胞检测细胞凋亡Figure 2 Cell apoptosis of CNE cell line measured by flow cytometry after receiving various doses of radiation |
上述流式细胞技术细胞周期分布表明CNE-2/ VEGF-siRNA组细胞发生G1/S阻滞,因此选择参与 G1/S调控因子Cyclin D1、Cyclin E、p16和p53基因 探讨可能信号通路。在这4个基因中Cyclin D1的 灰度值在放疗后6、12和24 h进行性升高,并且差 异有统计学意义,其他基因变化差异无统计学意 义,见图 3。通过Western blot检测提示Cyclin D1在 照射后24 h明显升高,而Cyclin E和p53无明显变 化,见图 4。
 |
*:P< 0.05 图 3 RT-PCR检测CNE-2细胞系中的Cyclin D1、Cyclin E、p16和p53的灰度值 Figure 3 The odds of gray value of Cyclin D1,Cyclin E ,p16,and p53 in different CNE-2 lines measured by RT-PCR |
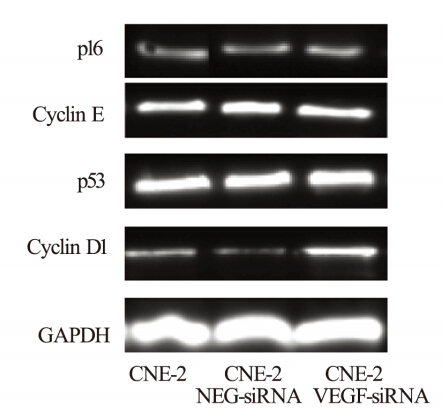 |
图 4 Western blot检测CNE-2细胞系中的Cyclin D1,p16,Cyclin E和p53照射后24 h的表达 Figure 4 Expression of Cyclin D1,p16,Cyclin E and p53 in CNE-2 cell line detected by Western blot after receiving irradiation for 24 h |
放射抗拒是鼻咽癌治疗局部区域失败的原因 之一,其抗拒的发生机制目前仍不清楚,寻找增 加放射敏感度的方法是提高治愈率的途径之一。 用肿瘤细胞内在放射敏感度的生物标志来预测鼻 咽癌放疗的可治愈性是当前的研究热点。已有的 研究表明肿瘤细胞乏氧相关因子(如乏氧诱导因 子-1、血红素加氧酶1)、DNA损伤修复相关因子 (如DNA 依赖性蛋白激酶)、细胞增殖相关因子 (如增殖细胞核抗原、p53)、细胞凋亡相关因子 (如Bcl-2和s urvivin)、细胞周期调控相关基因 (如细胞周期素和细胞周期激酶等)与鼻咽癌的 放射敏感度密切相关[3]。实际上,肿瘤细胞对电离 辐射反应呈现分子网络式的特点,网络通过相应 节点密切联系且相互调控[3],如与放射敏感度相关 的某些信号通路发生改变,则可能影响这些信号 通路活化及其相关基因的表达。本研究通过下调 VEGF的表达,探索VEGF参与鼻咽癌放射敏感度 的分子生物学机制。
血管内皮生长因子在肿瘤血管生成方面有重 要作用,有研究结果表明肿瘤组织的VEGF表达 水平与放射敏感度呈负相关[6-7]。对鼻咽癌、口咽 癌、口腔癌、肺癌、食管癌、脑胶质瘤和黑色素 瘤等的研究表明,阻滞VEGF的表达可增加射线对 肿瘤细胞的杀伤力,即增加放射敏感度[7]。本研究 证实阻断VEGF表达提高了鼻咽癌的放射敏感度, 阻断鼻咽癌细胞VEGF的表达导致其癌细胞发生细 胞周期G1/S阻滞。
细胞内存在一系列严密的调控机制确保细胞 周期严格按照时相转换有序进行。已发现的与细 胞周期调控有关的分子很多,主要包括细胞周期 蛋白、细胞周期蛋白依赖性激酶、细胞周期蛋白 依赖性激酶抑制因子。此外,细胞周期检验点在肿 瘤细胞和正常细胞中存在差异,细胞周期调控分子 在癌症发生、发展过程中均起着重要作用[8-9]。目 前研究表明细胞主要存在G1/S、S期和G2/M三个检 验点[9],本研究表明VEGF与放射敏感度的关系主 要是G1/S检验点。本研究中主要检测了参与G1/S细 胞周期调控相关的因子Cyclin D1、Cyclin E、p16 和p53基因,阻断VEGF表达后Cyclin D1在RNA和 蛋白质水平上均有不同程度的升高,而其他基因 或蛋白如Cyclin E、p16和p53基因则无明显差别, 因此提示VEGF参与鼻咽癌放射敏感度的调控与 Cyclin D1在RNA和蛋白质水平变化相关。
尽管本研究在RNA和蛋白水平上证实VEGF 参与鼻咽癌放射敏感度的调控过程,但是本研究 尚存在以下不足之处:(1)本研究仅为体外研 究,和体内的放射敏感度调节过程可能存在一定 差异,因此需进一步在临床上研究VEGF生物标 志物及VEGF抑制剂对鼻咽癌疗效的影响;(2) VEGF参与鼻咽癌的放射敏感度的调控通路可能有 多条,本研究仅仅探讨了VEGF与鼻咽癌细胞周期 的关系,但是否参与其他通途如血管生成、肿瘤 乏氧等尚需进一步探索;(3) 调控细胞周期的 机制也十分复杂,本研究的结果提示Cyclin D1是 VEGF调控鼻咽癌的放射敏感度的因素之一,但是 否还有其他分子生物学机制仍需进一步研究。
总之,本研究通过RNAi干扰技术阻断鼻咽癌 细胞系CNE-2的VEGF表达,表明鼻咽癌细胞中 VEGF的表达增加了其放射敏感度,可能通过细胞 周期调控蛋白Cyclin D1的细胞周期调控信号通路 发挥作用,并发生了细胞G1/S周期阻滞。研究结果 为如何减低鼻咽癌放疗的放射抗拒、增加放射敏 感度提供了一个参考。
| [1] | Lee AW, Lin JC, Ng WT. Current management of nasopharyngeal cancer[J]. Semin Radiat Oncol, 2012,22(3):233-44. |
| [2] | Lee AW,Ng WT, Chan YH, et al. The battle against nasopharyngeal cancer[J]. Radiother Oncol, 2012,104(3):272-8. |
| [3] | Qu S. Advances in the molecular biological research on the radiosensitivity of nasopharyngeal carcinoma[J]. Zhongguo Zhong Liu Lin Chuang,2012,39(24):2040-3. [曲颂. 鼻咽癌放射敏感性的分子生物学研究进展[J]. 中国肿瘤临床,2012,39(24): 2040-3.] |
| [4] | Li YM, Lin XG, Luo M.Relationship of VEGF expression and MVD in TNM staging of nasopharyngeal carcinoma[J]. Zhong Liu Fang Zhi Yan Jiu, 2009,36(11):973-5.[刘宜敏,林显敢,罗铭. 血管内皮生长因子表达及微血管密度与鼻咽癌TNM分期的关系[J]. 肿瘤防治研究,2009,36(11):973-5.] |
| [5] | Zhou Haibo, Wu Guang, Peng Gang, et al. Suppression of VEGF via RNA interference modulates the biological features of human nasopharyngeal carcinoma CEN-2 cell line[J]. Lin Chuang Zhong Liu Xue Za Zhi,2008,13(6):485-90.[周海波,伍钢,彭纲,等.siRNA抑制VEGF基因表达对鼻咽癌细胞生物学行为的影响[J]. 临床肿瘤学杂志, 2008,13(6):485-90.] |
| [6] | Ye WJ, Min HQ, Cao XP, et al.Correlations of bimolecular markers, such as P53 protein and vascular endothelial growth factor, to radiosensitivity of nasopharyngeal carcinoma[J]. Ai Zheng, 2006,25(9):1168-72.[叶伟军,闵华庆,曹新平, 等. P53 蛋白、血管内皮生长因子等生物分子指标与鼻咽癌放射敏感性的关系[J].癌症,2006,25(9):1168-72.] |
| [7] | Yin L, Zhu GY. Advances of study in affecting factors of tumor radiosensitivity[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2012,19(8):629-33.[尹丽,朱广迎.肿瘤放射敏感性影响因素的研究进展[J]. 中华肿瘤防治杂志,2012,19(8):629-33.] |
| [8] | Peng G, Chen J, Zou ZW, et al.Expression and significance of SHP-1/p21/CDK6 /Cyclin D1 in nasopharyngeal carcinoma cells with different radiosensitivity[J]. Zhong Liu Fang Zhi Yan Jiu, 2012,39(10):1193-6. [彭纲, 陈静, 邹枕玮,等. SHP-1/p21/CDK6/Cyclin D1在不同放射敏感度鼻咽癌细胞中的表达[J]. 肿瘤防治研究, 2012, 39(10):1193-6.] |
| [9] | Wang X. Research on the control of cell cycle and carcinogenesis[J]. Zhongguo Min Kang Yi Xue, 2010,22(16):2135-6.[王昕. 细胞周期调控与肿瘤发生的研究[J].中国民康医学, 2010,22(16):2135-6.] |
 2014, Vol.41
2014, Vol.41






