脑胶质瘤是人类中枢神经系统中最常见的恶性 肿瘤,主要采取手术为主辅以放射及化学治疗的综 合治疗方案,但其预后并未得到明显改善。放化疗 抵抗和肿瘤复发仍是治疗效果不佳的主要原因[1]。 目前关于胶质瘤多药耐药的研究较多,但具体分子 机制仍不清楚,是研究热点之一。本课题在前期建 立胶质瘤耐药细胞株的基础上,探讨p38MAPK信 号通路在脑胶质瘤细胞化疗耐药中的作用。 1 材料与方法 1.1 实验细胞及主要试剂
人脑恶性胶质瘤细胞系U251购于中国科学院上 海生命科学研究院生物化学与细胞生物学研究所。 U251/TMZ耐药细胞株由本实验室自行构建并保存 [2]。DMEM培养液及胰蛋白酶购自美国Gibico公司; 胎牛血清购自杭州四季青生物材料公司;DMSO 购自武汉天源生物技术公司。PVDF膜购自瑞典 Amersham公司;Bcl-2、TopoⅡ、MDR1抗体(兔来 源的多克隆)和辣根过氧化物酶标记山羊抗兔(羊 抗鼠二抗)购自Santa Cruz公司;DAB试剂盒购自福 州迈新公司;细胞凋亡-Hoechst染色试剂盒购自碧 云天生物技术公司;SB20358购自Alexis公司。 1.2 主要仪器
80 L细胞培养箱购自德国HERAENS公司; 超净工作台为苏州净化集团产品,CK-40倒置相 差显微镜及照相系统购自日本Olympus公司;电 子分析天平购自美国丹佛公司,恒温摇床为上海 振华公司产品;LS6500多功能液体闪烁计数仪为 Beckman Counlter公司产品,5301型真空干燥仪 由德国Eppendorf公司提供,高速台式离心购自 Hitachi公司,低温高速离心机购自Beckman公司。 HV3000多用电泳仪购自北京东方仪器厂,TS-1型 脱色摇床购自上海亚荣生化仪器厂。 1.3 细胞培养
将本实验室自行建立并保存的U251/TMZ细胞 复苏,将细胞悬液接种于培养瓶,置于体积分数 5%CO2,95%湿度条件的培养箱37℃条件下连续培 养。每2 d更换1次培养液,待细胞铺满瓶底约80% 以上时,用0.25%胰蛋白酶溶液消化,1∶3传代。 1.4 p38MAPK信号通路的阻断
U251/TMZ耐药细胞在培养瓶中长至80%融合 时,换含1%血清培养液,继续培养24 h使细胞同 步化,后加SB203580(20 μM)预孵育1 h,设立 阴性对照组,两组中分别加入替莫唑胺作用,检 测细胞活性及相关耐药基因的表达变化。 1.5 MTT法检测细胞活性变化
将每孔1×104个细胞接种于96孔板,37℃培养过 夜。按不同浓度替莫唑胺(0、1、2、4、8 μg/ml) 进行给药,并设未阻断空白对照组,各24个复孔。 避光孵育48 h,孵育结束前4 h加入5 μg/ml MTT 20 μl,4 h后弃孔内液,每孔加入150 μl DMSO溶液, 避光震荡10 min,分光光度计测490 nm处光吸收值 (A),计算细胞抑制率=(1-抑制组平均A值/细胞 空白对照组A值) ×100%。实验重复3次,取其均值。 1.6 Western blot检测相关耐药基因蛋白表达
收集8 μg/ml替莫唑胺作用48 h的细胞,提取 总蛋白,取蛋白20 μg以10%SDS-PAGE电泳分离, 浓缩胶电压50~80 V,分离胶80~100 V。PVDF转 膜,转膜条件为200 mA 60 min,丽春红染色,以 相应蛋白的抗体鉴定MDR1蛋白、TopoⅡ蛋白、 BCL-2蛋白,ECL增强试剂盒显色,GAPDH做对 照,将结果行凝胶图像分析。 1.7 统计学方法
收集并整理实验数据,运用Excel 2007处理 MTT的数据,用SPSS17.0统计软件包作统计学 处理,计量资料以均数±标准差(x±s)表示。以 P<0.05为差异有统计学意义。 2 结果 2.1 细胞活性的变化
用特异性抑制剂SB203580阻断p38MAPK通路 后,不同浓度替莫唑胺作用48 h,MTT法检测未 阻断及阻断后U251/TMZ耐药细胞的活性,观察耐 药细胞化疗敏感度的变化。结果显示,阻断通路 后,不同浓度替莫唑胺作用下细胞的抑制率明显 低于未阻断组,两组之间比较差异有统计学意义 (P<0.05),说明p38MAPK被阻断后,细胞的耐 药性有所增强,见图 1。
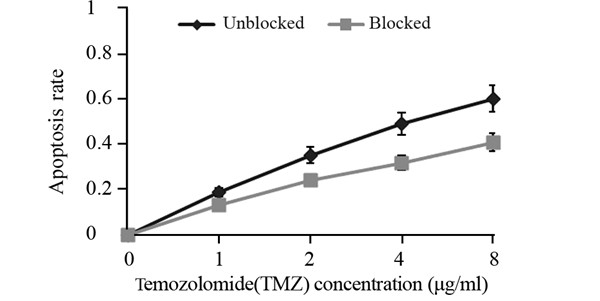 |
图 1 阻断P38MAPK通路后细胞活性的变化 Figure 1 Change of cell activity after p38MAPK signal pathway was blocked |
我们检测了在阻断前后耐药相关基因MDR1、 Bcl-2、TopoⅡ在U251/TMZ耐药细胞中的表达变 化情况。结果显示,阻断后耐药细胞中Bcl-2、 MDR1的表达明显升高,TopoⅡ的表达明显降低, 见图 2A。与未阻断的耐药细胞相比较,差异有统 计学意义,见图 2B。提示p38MAPK信号通路的阻 断后细胞耐药性的变化,可能与耐药株中耐药相 关基因Bcl-2、TopoⅡ、MDR1的表达变化有关。
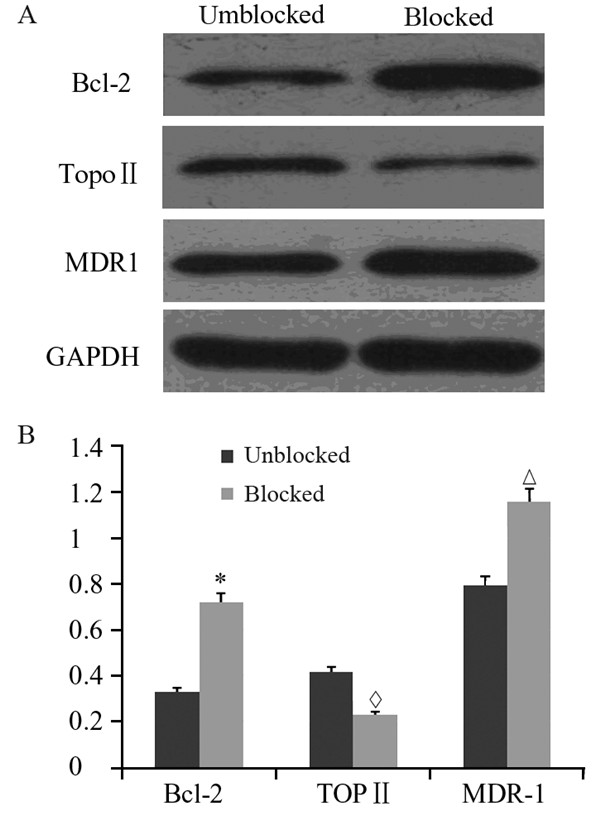 |
*:P<0.05,Δ:P<0.05,◊:P<0.05 图 2 阻断P38MAPK通路后耐药相关基因表达变化 Figure 2 Changes of resistance-associated gene expression after P38MAPK signal pathway was blocked |
胶质瘤是中枢神经系统肿瘤中最常见的恶性 肿瘤,约占颅内肿瘤的35.26%~60.96%[3],术后复 发率高,患者预后差。尽管目前普遍认为化疗可 使脑胶质瘤患者生存获益,但临床证实其延长生 存期的作用十分有限。研究胶质瘤的化疗耐药机 制是目前研究的热点之一。
丝裂原活化的蛋白激酶( mitogen-activated protein kinase,MAPK) 是一组可被多种信号激 活的丝/苏氨酸激酶。研究证实,MAPK信号转 导通路存在于大多数细胞内,其作用过程涉及多 层次的细胞调节,对生理、病理刺激可作出不同 反应,同时其可将细胞外刺激信号转导至细胞核 内,并引起细胞增殖、分化、转化、凋亡等生物 学反应[4],目前已有诸多实验发现MAPK信号转导 通路可能参与肿瘤化疗耐药。Zhao等[5]通过检测3 株人胰腺癌耐药细胞株发现,ERK的表达升高, 且使用ERK/MAPK通路阻断剂后,耐药细胞株对 化疗药物(氟尿嘧啶、阿霉素、吉西他滨)的敏 感度发生变化,因此推断ERK/MAPK通路参与了 胰腺癌细胞耐药过程,同时检测了磷酸化Bcl-2 的表达,结果表明ERK/MAPK通路可能是通过调 节Bcl-2而导致胰腺癌细胞耐药。Hernández Losa 等[6]发现顺铂可持续、特异性激活多株癌细胞中 p38MAPK并引发细胞毒作用,而顺铂耐药的细胞 株相对于非耐药株在顺铂作用下p38活性明显减弱 或缺失,经p38特异性抑制剂SKF860002预处理的 肿瘤细胞在顺铂作用下表现出细胞活性增强,说 明p38MAPK受抑制可能是顺铂耐药的原因。在本 组实验中,我们使用特异性阻断剂阻断p38MAPK 信号通路后,胶质瘤耐药株的细胞耐药性明显增 强,与以上结论一致,说明p38MAPK信号通路参 与了胶质瘤化疗耐药的形成。
详细充分地了解肿瘤细胞多药耐药的机制, 是寻找有效的逆转肿瘤化疗多药耐药方法的必要 条件。目前研究普遍认为,由ABC转运子超家族 (ATP-binding cassette transporter superfamily) 的跨膜转运蛋白所介导的机制是导致多药耐药的 主要原因。在ABC转运子超家族中,对P糖蛋白 (P-glycoprotein,P-gp)的研究最多[7],但研究提 示MDR1在胶质瘤患者中的表达也并不十分常见, P-gp的高表达并不是胶质瘤MDR的唯一因素。但 我们在前期的实验中明显发现MDR1在胶质瘤耐药 细胞中的表达升高,说明MDR1可能与胶质瘤的耐 药相关[2],在本实验中,我们发现U251/TMZ耐药 细胞在p38MAPK信号通路阻断后,细胞耐药性增 强,同时伴随有MDR1表达的明显升高,进一步说 明MDR1可能参与了胶质瘤化疗耐药的形成。
拓扑异构酶Ⅱ(TopoⅡ)是一种重要的酶, 主要作用为控制DNA双链结构的切割和重组结合 而影响DNA拓扑,是很多抗肿瘤药物的靶蛋白。 TopoⅡ含量的高低与肿瘤细胞的耐药性密切相 关,被认为是人脑胶质瘤化疗耐药的重要原因之 一。已有很多研究证实原发胶质瘤的分级与Topo Ⅱα的表达呈明显正相关,即胶质瘤的级别越高, 其中TopoⅡα的表达越强。Uesaka等[8]研究发现, 依托泊苷对成神经管细胞瘤的化疗具有良好的作 用,机制可能是其TopoⅡα与TopoⅡβ均有高表 达,提示TopoⅡ含量和活性的降低可能与肿瘤在 治疗过程的获得性耐药密切相关。本实验中也发 现,阻断p38MAPK信号通路后,TopoⅡ的表达含 量下降,胶质瘤耐药细胞的耐药性增强,研究结 果与以上结论一致。
Bcl-2在正常组织中的作用主要是保护正常细 胞免受毒物的侵害,保证细胞的存活。Bcl-2与化 疗耐药的关系也有所研究。Bcl-2的表达升高可 以导致肿瘤的化疗耐药性和肿瘤细胞的增殖,同 时,将Bcl-2基因转染到恶性胶质瘤细胞中可以导 致放疗和细胞毒性药物的效果明显降低[9]。在本实 验中发现,细胞耐药性的升高明显伴有Bcl-2表达 的升高,说明Bcl-2与胶质瘤的耐药性明确相关。
总之,本文初步研究了p38MAPK信号通路在 脑胶质瘤细胞化疗耐药中的作用及相关机制,证 实p38MAPK信号通路的活化可明显提高胶质瘤耐 药细胞的化疗耐药性,提示我们p38MAPK信号通 路可作为一个作用靶点,为下一步寻找逆转胶质 瘤耐药策略提供理论依据。
| [1] | Calatozzolo C, Pollo B, Botturi A, et al. Multidrug resistance proteins expression in glioma patients with epilepsy[J]. J Neurooncol,2012,110(1):129-35. |
| [2] | Liu B, Chen Q, Tian D, et al. BMP4 reverses multidrug resistance through modulation of BCL-2 and GDNF in glioblastoma[J]. Brain Res, 2013, 1507:115-24. |
| [3] | Suk K. Proteomic analysis of glioma chemoresistance[J]. Curr Neuropharmacol, 2012, 10(1): 72-9. |
| [4] | Johnson GL, Lapadat R. Mitgen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 2002, 298(5600):1911-2. |
| [5] | Zhao Y,Shen S,Guo J,et al.Mitogen-activated protein kinases and chemoresistance in pancreatic cancer cells[J]. J Surg Res,2006,136(2) : 325-35. |
| [6] | Hernández Losa J, Parada Cobo C, Guinea Viniegra J, et al. Role of the p38 MAPK pathway in cisplatin-based therapy[J]. Oncogene, 2003, 22(26):3998-4006. |
| [7] | Shi H, Lu D, Shu Y,et al. Expression of multidrug-resistancerelated proteins P-glycoprotein, glutathione-S-transferases, topoisomerase-II and lung resistance protein in primary gastric cardiac adenocarcinoma[J]. Cancer Invest, 2008, 26(4):344-51. |
| [8] | Uesaka T, Shono T, Kuga D, et al. Enhanced expression of DNA topoisomerase Ⅱ genes in human medulloblastoma and its possible association with etoposide sensitivity[J]. J Neurooncol, 2007,84(2):119-29. |
| [9] | van de Donk NW, Bloem AC, van der Spek E, et al. New treatment strategies for multiple myeloma by targeting BCL-2 and the mevalonate pathway[J]. Curr Pharm Des, 2006,12(3):327-40. |
 2014, Vol.41
2014, Vol.41



