2.广州军区广州总医院泌尿外科
2.Department of Urology,Guangzhou General Hospital of Guangzhou Military Command
microRNA-205(miR-205)是一种非编码微小 RNA,国内外研究表明,miR-205与肿瘤的发生、 侵袭、转移等密切相关[1,2,3],大多数肿瘤中表达水 平下降。肾上腺皮质癌(adrenocortical carcinoma cell,ACC)是一种临床罕见的恶性肿瘤,发病机 制特别是分子水平的机制仍旧模糊,早期诊断十 分困难[4]。治疗上仍然以手术治疗为主,缺乏有效 的药物治疗,术后复发率高,预后差[5]。ACC对化 疗药物不敏感,miR-205可促进肿瘤细胞的凋亡, 但是否能加强ACC对化疗药物的敏感度尚未见报道。我们前期研究发现肾上腺皮质癌中miR-205表达 水平较肾上腺皮质腺瘤及正常肾上腺皮质组织低, 并且成功构建了miR-205过表达的稳定细胞株[6] ,为本研究提供了重要的实验材料。 1 材料与方法 1.1 材料与试剂
转染 pcDNA3.1 (+) -miR-205细胞及转染 pcDNA3.1(+) SW-13细胞由吴义高等成功构建并 验证[6],冻存于广州军区总医院实验科。Cisplatin (简称CDDP,购自美国Sigma公司),H33342及 CCK-8(日本同仁公司),AnnexinV-FITC/PI(美 国Biovision公司),Guava NexinR凋亡检测试剂 (美国Millipore公司),单抗Bax、Bcl-2(美国BD 公司),多抗Caspase-9、单抗β-actin(美国CST公 司),反转录试剂盒、荧光染料SYBR Green(瑞 士罗氏公司),L-15培养液(杭州吉诺公司), 胎牛血清(美国Gib c o公司),DMS O(美国 Millipore公司)。 1.2 细胞及培养方法
设立转染 pcDNA3.1(+)的SW-13细胞为对照 组,转染pcDNA3.1 (+) -miR-205的SW-13细胞为 实验组。两组均用含10%胎牛血清的L-15培养液, 37℃,无CO2培养。每3~5天传代一次,传代2~3 次细胞状态趋于稳定,取对数生长期细胞进行实 验。CDDP试剂用DMSO溶解,并配制浓度为10 mg/ml的母液,-20℃保存备用。 1.3 CCK-8法测定CDDP对细胞抑制率
将培养的SW-13细胞制备成浓度为5×104/ml 的细胞悬液,接种于2块96孔板中,每孔体积为 100 μl。接种8~12 h后,按分组加入新鲜配制的含 有CDDP的培养液并避光培养。分为6组,分别为 DMSO溶剂组、CDDP5 μg/ml组、CDDP10 μg/ml 组、CDDP20 μg/ml组、CDDP30 μg/ml组、CDDP 40 μg/ml组,每组均设10个复孔。加药后48 h进 行CCK-8法检测,酶标仪450 nm波长测定各孔OD 值。 1.4 H33342、AnnexinV-FITC/PI染色
制备细胞爬片,按DMSO溶剂组、CDDP20 μg/ml组、CDDP30 μg/ml组加药,继续培养48 h。 倒置显微镜拍照后参照H33342及AnnexinV-FITC/ PI荧光说明书进行染色,荧光显微镜下观察。 1.5 流式细胞术检测细胞凋亡
按DMSO溶剂组、CDDP20 μg/ml组、CDDP 30 μg/ml组进行处理后收集细胞,按Guava NexinR 凋亡检测试剂盒说明书进行染色。每孔加入预混 试剂避光孵育20 min后进行流式细胞检测。实验重 复3次,结果取其平均值。 1.6 Western blot检测蛋白表达
不同浓度CDDP作用48 h后,收集细胞并提 取细胞总蛋白。用10%聚丙烯酰胺凝胶电泳,蛋 白转移到PVDF膜上,并用含5%脱脂奶粉的TBST 摇床封闭1 h,加入一抗稀释液(Bax、Bcl-2、 Caspase-9浓度分别为1:500、1:500、1:2 000)4℃ 孵育过夜。TBST洗膜3次,每次10 min,加入HRP 标记的二抗,37℃孵育1 h。洗膜4次,每次10 min 后进行ECL显色并曝光。 1.7 QPCR检测mRNA水平
分别提取未转染、转染pcDNA3.1 (+)及转染 pcDNA3.1 (+) -miR-205细胞的总RNA,并反转 录合成cDNA,PCR条件:预变性 95℃ 2 min,两 步法95℃ 15 s,60℃ 1 min,40个循环。E2F1-: 上游引物:5’-CGTGGACTCTTCGGAGAACTTT -3’,下游引物:5’-ACCTCCTGGGATGGGGTCTT-3 ’ ; V E G F - A: 上 游 引 物 :5 ’ - G G A G G G C A G A A T C A T C A C G A A G - 3 ’ ,下 游 引 物:5’-GAAGATGTACTCGATCTCATCAGGG-3’;β-actin:上游引物:5’-GGGAAATCGTGCGTGACA TTAAGG-3’; 下游引物:5’-CAGGAAGGAAGGCT GGAAGAGTC-3’。以β-actin作为内参,以2-△△CT 法进行相对定量分析。 1.8 统计学方法
应用SPSS 13.0统计软件进行统计分析,计量数 据用均数±标准差(x±s)表示,两个样本均数之间 的比较采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 miR-205对细胞的CDDP药物敏感度的影响
实验组0、5、10、20、30、40 μg/mlCDDP对 细胞的生长抑制率分别为0、(14.58±0.75)%、 (41.02±1.02)%、(61.44±1.2)%、(72.00± 0.85)%、(80.72±1.3)%;对照组上述浓度细 胞抑制率分别为:0、(9.84±1.05)%、(22.70± 1.68)%、(43.48±1.27)%、(65.87±0.86)%、 (78.34±0.94)%。实验组的细胞对CDDP的敏感 度明显高于对照组(P<0.05),见图 1。
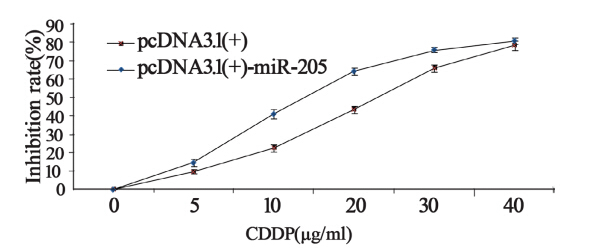 |
图1 miR-205对肾上腺皮质癌细胞CDDP药物敏感度的影响 Figure 1 Effect of miR-205 on drug sensitivity of adrenocortical carcinoma cells to CDDP |
H33342染色及AnnexinV-FITC/PI染色均可见 实验组每高倍镜视野细胞凋亡率明显高于对照 组。浓度为0、20、30 μg/ml CDDP作用下,荧光显微镜观察两组的细胞凋亡情况,见图 2A。在上 述三个浓度CDDP作用下,流式细胞仪检测早期 凋亡率,对照组和实验组凋亡率分别为:(1.88 ±0.22)%和(2.66±0.45)%、(6.04±0.78)%和 (11.74±1.15)%、(15.06±1.36)%和(24.62± 2.01)%。提示在不同浓度的CDDP诱导下,实验 组凋亡率明显高于对照组,见图 2B、2C。
 |
A,B:effect of miR-205 on apoptosis of SW-13 cells detected by flow
cytometry; C: nuclei stained with H33324 and FITC/PI(×200)
图2 miR-205对CDDP诱导肾上腺皮质癌细胞凋亡的影响
Figure 2 Effect of miR-205 on CDDP-induced cell apoptosis
of adrenocortical carcinoma |
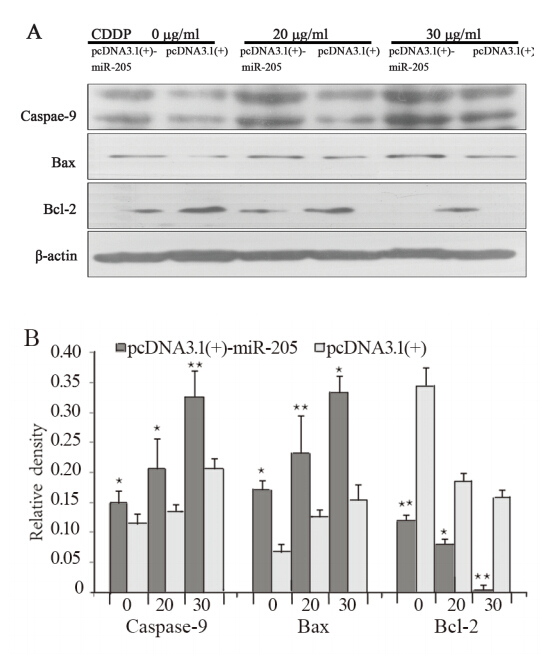
在浓度分别为0、20、30 μg/ml CDDP作用下, 实验组促凋亡蛋白Bax和Caspase-9表达水平较对照 组明显升高,而凋亡抑制蛋白Bcl-2表达水平明显 降低,见图 3。
 |
*:P<0.05, **:P<0.01 compared with pcDNA3.1(+) group
图3 miR-205对CDDP作用后相关蛋白表达水平的影响
Figure 3 Effects of miR-205 on the expression of
apoptosis-related proteins induced by CDDP |
m i R - 205实验组与对照组相比,E2F1、 VEGF- A 相对表达水平分别为(0.35±0.045) 倍、(0.21 ± 0.062)倍,显著低于对照组(P<0.01)。 3 讨论
肾上腺皮质癌是一种临床罕见的恶性肿瘤, 每年发病率约1~2/100万,但其恶性程度高、进展 快、预后差,严重威胁患者生命,早期诊断十分 困难,甚至术后病理也不容易诊断[7,8]。目前手术 切除肿瘤是国内外治疗ACC的首选方法,也是改 善患者生存期最可靠的手段,一旦发现本病,应 尽早行手术切除。
ACC对化疗药物不敏感,缺乏有效药物治 疗,如何改善其化疗药物敏感度是治疗ACC的一 大难题。CDDP是治疗多种恶性肿瘤的最常用和最 有效的化疗药物之一[9],也用于ACC患者的化疗。 但化疗的效果仍然不令人满意,提高化疗药物效 率也是众多学者研究的方向。
发现非编码基因及其作用规律是肿瘤学领域 一个重要的成就,研究表明miRNA表达谱在不 同肿瘤内表达是不同的。micro RNAs是一种长度 仅20~24 核苷酸的非编码RNA,其作用机制是通 过碱基配对来靶定某种mRNA的特定部位从而调 节这种蛋白的表达。将近30%的基因表达是通过 miRNAs在转录后水平来调节的[10,11]。miRNA-205 是一种高度保守的miRNA,它可以抑制肿瘤的发 生、发展,也可以促进肿瘤的形成,至于是以抑 癌基因存在还是癌基因,取决于它所调控的下游 靶基因以及肿瘤的类型[12]。
我们前期研究表明miRNA在ACC中为低表达。构建了真核表达载体p cDNA3 .1 (+) - m iR - 205,通过重组质粒转染至肾上腺皮质 癌S W- 1 3细胞株中,后期实时定量P C R表明 pcDNA3.1(+) -miR-205在SW-13中稳定转染。本 研究将选用转染pcDNA3.1(+) -miR-205和转染 pcDNA3.1(+)的SW-13细胞进行试验,分别为实 验组和对照组。在不同浓度的CDDP作用下,实验 组的细胞生长抑制率及凋亡率明显高于对照组, 其凋亡相关蛋白Bax、Caspase-9表达升高,抗凋 亡蛋白Bcl-2表达下降,表明miRNA-205可以改善 SW-13对CDDP的敏感度。肾上腺皮质癌中E2F1 和VEGF-A表达水平较肾上腺皮质腺瘤及瘤旁正 常组织明显升高。肿瘤的生长和存活依赖血管提 供的养分,VEGF可促进肿瘤细胞的生长、增殖及 迁移,在肿瘤新生血管中起着至关重要的作用。 VEGF-A是属于血管内皮生长因子的重要成员, 是目前研究最多应用最广的血管内皮生长因子, VEGF-A可促进肿瘤细胞的增殖,抑制细胞凋亡。 研究发现E2F1与VEGF- A间存在重要的关系, VEGF-A可通过作用转录因子E2F1来促进细胞增 殖生长,同样E2F1可以下调VEGF-A启动子的活 性[13,14]。qPCR结果显示miRNA-205实验组E2F1、 VEGF-A水平较对照组明显降低,在众多肿瘤的研 究[14,15]中发现VEGF-A对E2F1的调节作用占优势, 与本实验的发现相符,但具体的通路还需深层次 的探索。故从研究结果推测:miRNA-205可直接 或间接下调肾上腺皮质癌细胞内E2F1及VEGF-A的 表达,从而促进肿瘤细胞凋亡,下一步将对其具 体作用通路进行研究。
结论:miRNA- 205可直接或间接降低肾上 腺皮质癌细胞E2F1及VEGF-A的表达水平,增强 SW-13细胞对CDDP的敏感度,促进顺铂诱导的细 胞凋亡。
| [1] | Yue X,Wang P,Xu J,et al.MicroRNA-205 functions as a tumor suppressor in human glioblastoma cells by targeting VEGF-A[J]. Oncol Rep,2012,27(4):1200-6. |
| [2] | Majid S,Saini S,Dar AA,et al.MicroRNA-205 inhibits Srcmediated oncogenic pathways in renal cancer[J].Cancer Res,2011,71(7):2611-21. |
| [3] | Matsushima K,Isomoto H,Yamaguchi N,et al.MiRNA-205 modulates cellular invasion and migration via regulating zinc finger E-box binding homeobox 2 expression in esophageal squamous cell carcinoma cells[J].J Transl Med,2011,9:30. [4] Lebastchi AH,Kunstman JW,Carling T.Adrenocortical carcinoma: current therapeutic state-of-the-art[J].J Oncol,2012,2012:234726. [5] Soon PS,Libe R,Benn DE,et al.Loss of heterozygosity of 17p13, with possible involvement of ACADVL and ALOX15B, in the pathogenesis of adrenocortical tumors[J].Ann Surg,2008,247(1): 157-64. |
| [4] | Wu YG,Xiao G,Xu WQ,et al.Construction and identification of eukaryotic expression vector of human miR-205[J].Shandong Yi Yao,2012,52(44):20-2,cover 2.[吴义高,肖戈,徐文清,等.人 miR-205真核表达载体的构建及鉴定[J].山东医药. 2012,52(44): 20-2,封2]. |
| [5] | Shen W,Hu WL.Cellular senescence and adrenal tumors[J].Shi Yong Yi Xue Za Zhi,2006,22(23):2819-20.[沈文,胡卫列.细胞衰老与肾上腺肿瘤[J].实用医学杂志,2006,22(23):2819-20.] |
| [6] | Brewer CA,Blessing JA,Nagourney RA,et al.Cisplatin plus gemcitabine in previously treated squamous cell carcinoma of the cervix: a phase Ⅱ study of the Gynecologic Oncology Group[J]. Gynecol Oncol,2006,100(2):385-8. |
| [7] | Mattie MD,Benz CC,Bowers J,et al.Optimized high-throughput microRNA expression profiling provides novel biomarker assessment of clinical prostate and breast cancer biopsies[J].Mol Cancer,2006,5:24. |
| [8] | Obernosterer G,Leuschner PJ,Alenius M,et al.Post-transcriptional regulation of microRNA expression[J].RNA,2006,12(7):1161-7. |
| [9] | Qin AY,Zhang XW,Liu L,et al.MiR-205 in cancer: an angel or a devil?[J].Eur J Cell Biol,2013,92(2):54-60. |
| [10] | Qin G,Kishore R,Dolan CM,et al.Cell cycle regulator E2F1 modulates angiogenesis via p53-dependent transcriptional control of VEGF[J].Proc Natl Acad Sci U S A,2006,103(29):11015-20. |
| [11] | Zhu Y,Jin K,Mao XO,et al.Vascular endothelial growth factor promotes proliferation of cortical neuron precursors by regulating E2F expression[J].FASEB J,2003,17(2):186-93. |
| [12] | Merdzhanova G,Gout S,Keramidas M,et al.The transcription factor E2F1 and the SR protein SC35 control the ratio of pro-angiogenic versus ountiangiogenic isoforms of vascular endothelial growth factor-A to inhibit neovascularization in vivo[J].Oncogene,2010, 29(39):5392-403. |
 2014, Vol.41
2014, Vol.41


