2.医学转化中心
2.Center for Laboratory Medicine
膀胱移行细胞癌(bladder transitional cell carcinoma,BTCC)是泌尿系统最常见的恶性肿 瘤,具有复发率高的临床特点。植物多酚紫铆因 (Butein)具有抗炎、抗纤维化、抗癌等作用,还是NF-κB通路的有效抑制剂。NF-κB在膀胱癌中常表 现为组成性激活。天然药物紫铆因是否能够抑制 膀胱癌细胞的增殖,及其抑瘤机制尚不清楚。 1 材料与方法 1.1 材料
BLS膀胱移行细胞癌细胞系来自西安交通大学 医学院第一附属医院医学分子中心[1]。实验动物: 6周龄BALB/c-nude裸鼠12只,雌性,平均体质量 17~20 g,购自中国科学院上海实验动物中心。 紫铆因购自美国Aldrich-Sigma公司,兔抗人组蛋 白H3、NF-κB p65、COX2及鼠抗人CyclinD1、β-actin、Tubulin购自美国Santa Cruz公司。兔抗 人p44/42 MAPK(ERK1/2)及Phospho-p44/42 MAPK(p-ERK1/2)购自美国Cell signaling公司。 1.2 紫铆因工作液的准备
紫铆因相对分子质量272.12,将5 mg紫铆因溶 于230 µl DMSO中,配制成(8×104) µM的母液,置 于-20℃冰箱保存。临用时,以RPMI 1640培养液 稀释紫铆因到所需浓度,保证DMSO的浓度小于 1‰,排除DMSO的细胞毒性作用,工作液的最大 浓度是80 µM,即稀释1 000倍。 1.3 细胞生长抑制实验(MTT法
将细胞按5 000个/孔接种于96孔板,分别加入 终浓度为0、2.5、5、10、20、40、80 µM的紫铆 因培养液。每浓度组均设 5个平行孔。培养48 h; 弃上清液,每孔加入200 μl无血清培养液及20 μl MTT溶液继续培养4 h。弃上清液,加入DMSO, 振荡10 min,于自动酶标仪上进行比色,在波长 490 nm处测各孔光密度值,该实验重复3次,取平 均值。 1.4 平板克隆形成试验
取对数生长期的细胞制备成单细胞悬液,以 200个/孔的浓度接种到6孔板,分别加入10、20、 40 µM的紫铆因,每组设置5个平行孔,静止培养 2周,弃培养液,固定,染色,计数,按下式计算 克隆形成率:克隆形成率(%)=克隆数/接种细胞数×100%。 1.5 流式细胞仪检测细胞周期
将细胞培养至对数生长期,无血清RPMI 1640 培养液过夜培养,血清饥饿使细胞同步化在G0 期。弃掉无血清培养液,加入含10%胎牛血清的 RPMI 1640培养液。经过恢复期后进行相关实验。 加入含20、40、80 µM的紫铆因培养液,继续培养 24 h。消化制备成单细胞悬液,用PBS洗两遍,加 入70%冰乙醇固定,4℃过夜。上机前,1 000转离 心5 min,弃去乙醇,PBS洗三遍,加50 µl PI,避 光30 min,上机检测细胞周期。重复试验3次。 1.6 蛋白印迹法
提取总蛋白,测定蛋白浓度;进行SDS-PAGE 电泳,蛋白电泳转移仪将分离后的蛋白条带转至 硝酸纤维素膜上,一抗4℃冰箱孵育过夜;二抗室 温孵育1.5 h,暗室中ECL曝光显影。发光成像仪取 像并测定条带A值,以待检基因条带与内参条带的 比值作为目的蛋白的相对量。重复实验3次。 1. 7 膀胱癌裸鼠移植瘤体内研究
取对数生长期细胞,用PBS调整浓度到4×107/ml。将裸鼠常规消毒后,在裸鼠左后肢皮下接 种细胞,每只8×106/0.2 ml。接种肿瘤细胞后,在 西安交通大学医学院动物中心无菌空气层流室内 饲养,全部实验饲养过程达到SPF(special pathogen free)条件,定期观察小鼠的精神、饮食及排便等 情况,称量小鼠体质量。接种1周左右,可见接 种部位皮下长出米粒大小的硬结,待瘤体达到 (100~200)mm3时开始治疗。治疗前随机分组, 每组6只,各组裸鼠治疗前体质量经统计学分析无 显著性差异(P>0.05),表明各组裸鼠体质量在治疗 前具有均衡性。治疗前对照组和紫铆因治疗组间 肿瘤体积经统计学分析无显著性差异(P>0.05)。对 照组:腹腔注射PBS,二天注射一次。药物组:腹 腔注射PBS稀释的紫铆因,每只每次40 μm,二天 给药一次,连续治疗4周。皮下移植瘤疗效观察: 皮下接种成瘤后,每三天用游标卡尺测量肿瘤瘤 体的长径(a)、短径(b),按公式求出肿瘤近似体积 (V),V=1/2ab2。治疗后每日观察裸鼠进食、精神 状况及活动情况。实验结束时处死小鼠,称取瘤 体质量。 1.8 统计学方法
使用SPSS 19.0统计软件进行统计学分析,结 果以均数±标准差(x±s)表示,组间比较采用单 因素方差分析和t检验,以P<0.05为差异有统计学 意义。 2 结果 2.1 紫铆因对细胞增殖的抑制作用
不同浓度的紫铆因(2.5、5、10、20、40、80 µM)作用48 h,MTT法检测结果表明细胞的存活 率分别为(98.4±3.5)%、(96.7±5.2)%、(94.7 ±7.6)%、(91.4±9.24)%、(65.8±10.3)%、 (20±6.8)%,紫铆因抑制BLS细胞的增殖呈浓度 依赖性方式。当紫铆因40 µM及80 µM时对细胞增 殖的抑制与对照组(紫铆因 0 µM)相比差异有统 计学意义(P=0.00),见图 1。
 |
*: P=0.00,Butein 40 um and Butein 80 um vs. control group
图1 紫铆因对膀胱移行细胞癌细胞增殖的影响
Figure 1 Effects of Butein on cell proliferation of bladder transitional cell carcinoma |
用不同浓度的紫铆因(0、10、20、40 µM) 处理细胞,培养12天,计算 0、10、20 µM紫铆因 作用下克隆形成率分别为(90.6±3.8)%、(51.6± 3.0)%、(33.6±6.3)%,当紫铆因浓度为40 µM 时无细胞克隆形成。显示紫铆因以浓度依赖性方 式抑制细胞克隆形成能力,差异有统计学意义 (P=0.00)。 2.3 紫铆因对细胞周期的影响
用20、40、80 µM的紫铆因处理细胞24 h,流 式细胞仪观察细胞周期改变。随剂量的进一步增 加,G2/M期的细胞比例明显增加,见表 1。
|
|
表 1 FCM检测膀胱移行细胞癌细胞生长周期 Table 1 Cell cycles of bladder transitional cell carcinoma detected by flow cytometry |
20 µM的紫铆因处理后,蛋白印迹检测细胞 核蛋白及胞质蛋白中NF-κB p65的表达,以间接 了解NF-κB信号的激活状态,结果显示处理8 h 后紫铆因即显著抑制了NF- κB p65的胞核表达 (P=0.00),对照组与紫铆因组NF-κB p65蛋白 胞核内相对表达量分别为(1.03±0.12)及(0.16± 0.02),而紫铆因对胞质内NF-κB p65的表达无显 著性影响,见图 2。
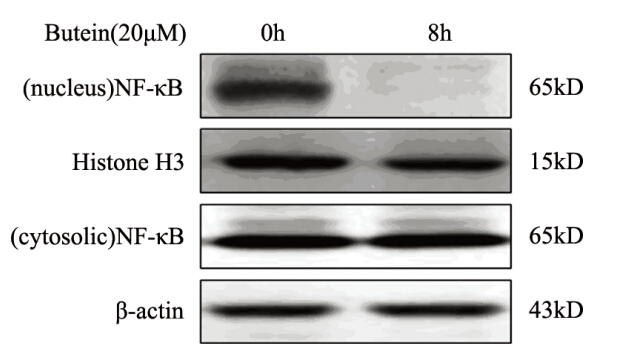 |
图2蛋白印迹检测紫铆因对膀胱移行细胞癌中NF-κB p65表达的作用 Figure 2 Effects of Butein on NF-κB p65 expression in bladder transitional cell carcinoma detected by Western blot |
20µM的紫铆因分别处理BLS细胞0、4、8、 24h,Western bolt检测ERK1/2,磷酸化ERK1/2和 内参β-actin的表达。发现紫铆因对ERK1/2的表达 没有显著影响,而抑制了磷酸化ERK1/2的表达水 平,呈时间依赖性方式,其中作用24 h后磷酸化 ERK1/2的表达水平与对照组(紫铆因0 h)相比差 异有统计学意义(P=0.00),见图 3。
 |
*: P=0.00, compared with Butein 0 h
图3 蛋白印迹检测紫铆因对膀胱移行细胞癌中ERK1/2信号的作用
Figure 3 Effects of Butein on ERK1/2 and p-ERK1/2 of
bladder transitional cell carcinoma detected by Western blot |
20 µM紫铆因处理24 h后,紫铆因处理组和未 处理组细胞中Cyclin D1蛋白相对表达量为(0.98 ±0.16)和(0.23±0.04)。COX2蛋白相对表达量 为(0.87±0.11)和(0.29±0.06),提示紫铆因 显著抑制了Cyclin D1(P=0.02)及COX2的表达 (P=0.01),见图 4。
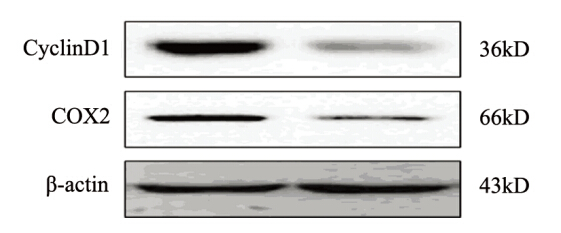 |
图4 蛋白印迹检测膀胱移行细胞癌中CyclinD1及COX2的表达 Figure 4 Effects of Butein on CyclinD1 and COX2 expression in bladder transitional cell carcinoma detected by Western blot |
每只裸鼠皮下注射 8×106癌细胞后,各组裸鼠 未出现消瘦、行动迟缓等症状。接种7天后可观察 到皮下小结节,成瘤率100%,治疗后每日观察两 组裸鼠进食、精神状况及活动情况无明显变化。 治疗后,各组裸鼠肿瘤体积均逐渐增大,瘤体起 初为椭圆形,以后生长渐不规则,凸凹不平。对照组肿瘤生长较快,紫铆因组治疗2周后肿瘤生 长停止并呈缩小趋势,统计学分析显示治疗结束 后,治疗组肿瘤体积均小于对照组(P=0.00),比较 切除肿瘤标本的重量,显示紫铆因治疗组的移植 瘤重量明显小于对照组(P=0.00),见表 2。
|
|
表 2 紫铆因对膀胱癌裸鼠移植瘤生长的作用 Table 2 Effects of Butein on transplanted tumor growth of bladder carcinoma in nude mice |
在目前的肿瘤治疗中,存在着作用小、费用 高、不良反应大的缺点,寻找高效、价廉、不良 反应相对小的天然药物有着非常重要的意义。紫 铆因是一种植物多酚,是漆树科植物漆树(rhus verniciflua stokes)皮的主要活性成分。在亚洲 是一种中药,在韩国也被用于食品添加剂。许多 体外研究发现紫铆因除了具有抗炎及抗纤维化作 用,可以抑制包括乳腺癌、前列腺癌、肝癌等许 多种人类肿瘤细胞的增殖[2,3,4],本研究结果显示, 膀胱癌细胞的存活率及克隆形成率随着紫铆因处 理浓度的增加逐渐下降,显示出明显的剂量依赖 关系;体内实验证实紫铆因对膀胱移行细胞癌皮 下移植瘤有明显的抑制作用,这些结果表明紫铆 因显著地抑制了膀胱癌细胞的增殖能力。细胞经 药物作用后,发生DNA损伤,细胞会启动细胞周 期检查点,产生细胞周期阻滞,从而抑制了细胞 的增殖。本实验采用流式细胞术测定紫铆因不同 处理浓度下细胞处于细胞周期各时相的百分比。 结果表明:紫铆因处理细胞后G2/M期细胞明显增 多,提示紫铆因可能通过阻滞细胞在G2/M期发挥 生长抑制作用。
ERK是丝裂原活化蛋白激酶K(mitogen activated protein kinase,MAPK)家族的主要成员,是调节细 胞周期及促进细胞增殖分化的重要因子[5]。紫铆因 是特异性的酪氨酸激酶抑制剂。它抑制了表皮生 长因子(EGF)受体的磷酸化激活[6]。Yang等[7]研 究发现紫铆因通过调控MAPK通路抑制了乳腺癌细 胞的增殖,本研究证实紫铆因显著抑制了ERK1/2 的磷酸化。ERK1/2作为传递细胞增殖信号的重要 因子,也在NF-κB的激活中发挥重要作用[8]。NF-κB是重要的核转录因子,最常见的形式是由p50和p65组成的异源二聚体,与其抑制蛋白IκBs形成复合物,以非活性形式存在于细胞质中,受到各种 活化因素的作用后,NF-κB被激活进入到核内, 调控多种涉及细胞增殖、存活、肿瘤侵袭和转移 及肿瘤血管形成等基因的表达。由于基因突变、 慢性炎性反应等因素所致的NF-κB异常活化可促进 细胞增殖、加速肿瘤细胞转移、提高肿瘤细胞对 放、化疗的抗性,最终促进肿瘤的发生与发展, 因此,NF-κB活性抑制剂将有助于肿瘤的防治[9]。 研究表明紫铆因通过直接抑制IKKβ的磷酸化抑制 了NF-κB的活性以及NF-κB调控基因的表达[10]。 NF-κB在膀胱癌中常表现为组成性激活,我们的数 据进一步证实紫铆因抑制了膀胱癌细胞中NF-κB活 性。这些结果暗示紫铆因发挥抗癌作用可能涉及 ERK1/2和NF-κB两条信号通路。
Cyclin D1基因中有NF-κB连接位点,NF-κB通 过调控Cyclin D1参与细胞周期的调控,促进细胞 增殖[11]。COX2也是NF-κB的重要下游靶点,COX2 在正常组织中基本不表达,而在炎性反应和多数 肿瘤组织中高表达,通过启动炎性反应,促进肿瘤 细胞增殖及肿瘤微血管形成影响肿瘤发生发展[12]。 那么紫铆因是否抑制这些蛋白的表达,我们通过 蛋白印迹检测了紫铆因处理组和未处理组细胞中 Cyclin D1及COX2参与肿瘤增殖的蛋白表达,发现 紫铆因处理后Cyclin D1及COX2显著下调。
综上所述,本研究发现紫铆因在膀胱癌细胞 中通过阻断ERK1/2和NF-κB信号通路,继而下调 Cyclin D1及COX2细胞增殖相关基因而发挥了明显 的抗膀胱癌增殖作用。因此,紫铆因作为一种天 然化合物有望成为膀胱癌治疗中的辅助用药。
| [1] | Yang YC, Li X, Chen W. Differential expression of immuneassociated genes in two subcloned cell lines from a same human bladder cancer[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2006, 22(5): 625-7.[杨玉琮,李旭,陈葳.免疫相关基因在同一膀胱癌亚克隆细胞株中的差异表达[J]. 细胞与分子免疫学杂志, 2006, 22(5): 625-7.] |
| [2] | Lau GT, Huang H, Lin SM, et al. Butein downregulates phorbol 12-myristate 13-acetate- induced COX-2 transcriptional activity in cancerous and non-cancerous breast cells[J]. Eur J Pharmacol, 2010, 648(1-3): 24-30. |
| [3] | Chua AW, Hay HS, Rajendran P, et al. Butein downregulates chemokine receptor CXCR4 expression and function through suppression of NF-κB activation in breast and pancreatic tumor cells[J]. Biochem Pharmacol, 2010, 80(10): 1553-62. |
| [4] | Rajendran P, Ong TH, Chen L, et al. Suppression of signal transducer and activator of transcription 3 activation by butein inhibits growth of human hepatocellular carcinoma in vivo[J]. Clin Cancer Res, 2011, 17(6): 1425-39. |
| [5] | Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 2002, 298(5600): 1911-2. |
| [6] | Yang EB, Zhang K, Cheng LY,et al. Butein, a specific protein tyrosine kinase inhibitor[J]. Biochem Biophys Res Commun, 1998, 245(2): 435-8. |
| [7] | Yang LH, Ho YJ, Lin JF, et al. Butein inhibits the proliferation of breast cancer cells through generation of reactive oxygen species and modulation of ERK and p38 activities[J]. Mol Med Rep, 2012, 6(5): 1126-32. |
| [8] | Nakano H, Shindo M, Sakon S, et al. Differential regulation of lkappaB kinase alpha and beta by two upstream kinases, NFkappaB-inducing kinase and mitogen-activated protein kinase/ ERK kinase kinase-1[J]. Proc Natl Acad Sci U S A, 1998, 95(7): 3537-42. |
| [9] | Mang YX, Li M. Progress in NF-κB Targeting Drugs for the Prevention and Treatment of Tumor[J]. Zhong Liu Fang Zhi Yan Jiu, 2006, 33(6): 465-7. [马艳霞, 李敏. NF-κB与肿瘤防治药物 研究进展[J]. 肿瘤防治研究, 2006, 33(6): 465-7.] |
| [10] | Pandey MK, Sandur SK, Sung B, et al. Butein, atetrahydroxychalcone, inhibits nuclear factor (NF)-kappa B and NF-kappaB-regulated gene expression through direct inhibition of lkappaBalpha kinase beta on cysteine-179 residue[J]. J Biol Chem, 2007, 282(24): 17340-50. |
| [11] | Dahlman JM, Wang J, Bakkar N, et al. The RelA/p65 subunit of NF-kappaB specifically regulates cyclin D1 protein stability: implications for cell cycle withdrawal and skeletal myogenesis[J]. J Cell Biochem, 2009, 106(1): 42-51. |
| [12] | Wang S, Liu Z, Wang L, et al. NF-kappaB signaling pathway, inflammation and colorectal cancer[J]. Cell Mol Immunol, 2009, 6(5): 327-34. |
 2014, Vol.41
2014, Vol.41





