STK11(serine/threonine kinase 11,STK11) 基因最早是从Peutz-Jeghers 综合征(Peutz-Jeghers syndrome,PJS)患者中发现的,目前被认为是一 种抑癌基因,参与多个生物学过程和信号通路[1]。 我们构建含目的基因STK11的EGFP融合载体转染 A549和H460细胞,并探讨其对肺癌细胞迁移能力 的影响。 1 材料与方法 1.1 材料
健康者胚肾细胞系293和人肺癌细胞株A549、 H460细胞、EGFP-N1、大肠埃希菌DH5α由徐州医学院肿瘤生物治疗实验室保存;人H460细胞购 买于南京凯基生物有限公司;引物合成及测序工 作由上海生工生物工程技术服务有限公司完成; RPMI 1640培养液购自赛默飞世尔生物化学有限公 司;胎牛血清购于浙江天杭生物科技公司;限制 性内切酶、连接酶、RT-PCRKit Ver.2试剂盒、凝 胶回收试剂盒、质粒中量提取试剂盒均购自北京 TIANGEN公司;脂质体(lipofectamine 2000) 购于 Invitrogen 公司;STK11抗体、辣根过氧化物酶标 记的二抗购于abcam公司。 1.2 引物设计及STK11基因扩增
根据GenBank的LKB1基因序列(N M 000455.4),利用Primer predict和DNAclub软件 设计引物,引物由上海英俊生物技术有限公司合 成。引物上下游分别引入Hin dⅢ/KpnⅠ酶切位 点。上游引物:5’-ATAGCTAGCATGGAGGTGGT GGACCCG-3’,下游引物:5’-AGAGAATTCCTG CTGCTTGCAGGCC-3’。
按照Trizol试剂盒说明书,从293细胞中提取总 RNA,获得STK11全长。 1.3 重组质粒构建及鉴定
将末端加A后的目的基因STK11连接到PMD18- T载体上,得到pMD18- T- STK11重组 质粒。分别双酶切质粒pEGFP-N1和pMD18-TSTK11,获得pEGFP-STK11重组质粒。 用含阳性克隆的细菌抽提质粒 ,对质粒p EGF P - S TK11进行NheⅠ和EcoRⅠ双酶切, 37℃、2h,1%琼脂糖凝胶电泳鉴定。重组质粒送 交上海英俊生物技术有限公司进行基因测序,将 测序结果与质粒中插入序列的ORF对比,验证重 组质粒插入片段的正确性。 1.4 转染及实验分组
转染前一天,将处于对数生长期的细胞用 0.25%胰酶消化,分别将A549和H460细胞浓度调 整至为(2~5)×107 cells/ml,接种至6孔板,待细 胞铺满板底80%~90%时,按照Lipofectamine 2000 转染试剂说明书进行转染。实验分pEGFP-STK11 重组质粒转染组和0.9%氯化钠溶液对照组。每组6 个复孔。 1.5 荧光显微镜观测和Western blot检测
在转染后12、24、48和72 h荧光显微镜下分 别观测两组细胞EGFP的表达情况。分别在转染后 24、48和72 h收集细胞,按照细胞蛋白提取试剂盒 要求提取蛋白,−80℃冰箱保存,Western blot检测 STK11蛋白表达。 1.6 划痕实验
在6孔板背面画平行直线做标记,每孔3条。 分别将两组细胞常规消化后,5×105细胞/孔种植到 6孔板内过夜,待细胞基本融合达到80%时,弃去 培养液,用PBS清洗三遍后,用10 μl微量移液头 在6孔板内垂直于标记纵向划痕,PBS冲洗3次去 除细胞,加入无血清培养液继续培养。倒置显微 镜下,在3个不同的划痕部位拍照,48 h后在同样 的位置再拍照观察创伤愈合情况,应用Photoshop 软件计算划痕间距。实验重复3次,细胞迁移率= (划痕后即刻测量的划痕间距-划痕后48 h测量的 划痕间距)/划痕后即刻测量的划痕间距×100%。 1.7 统计学方法
应用SPSS19.0软件对实验数据进行统计分 析。统计描述、均数采用x±s表示,两组间均数比 较采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 重组质粒鉴定
酶切鉴定结果显示在1 300 bp左右出现条带, 与STK11基因大小相同,见图 1。对pEGFP-STK11 插入片段进行测序,结果显示插入序列无突变, 与GenBank中STK11序列一致。
 |
图1 pEGFP-STK11重组质粒双酶切鉴定结果 Figure 1 Double restriction enzyme digestion identif ication result of pEGFP-STK11 recombinant plasmid |
A549细胞和H460细胞在转染后各时间点,荧 光显微镜下均可见pEGFP-STK11重组质粒组细胞 呈绿色,细胞形态完好,在转染后24 h EGFP表达 最强,见图 2;0.9%氯化钠溶液对照组细胞在转染 后各时间点,荧光显微镜下均未观察到绿色荧光。 在转染后各时间点,Western blot检测结果均 显示与目的蛋白分子量一致的目的条带,24 h时条 带颜色最深;而0.9%氯化钠溶液对照组未见目的 条带表达,见图 3。
 |
A-D:Fluorescence microscopy detection of SKT11 gene expression after A549 cells transfected with pEGFP-STK11 for 12,24,48 and 72h, respectively;E-H:Fluorescence microscopy detection of SKT11 gene expression after H460 cells transfected with pEGFP-STK11 for 12,24, 48 and 72 h, respectively
图2 pEGFP-STK11质粒转染A549和H460细胞后绿色荧光表达情况( ×100)
Figure 2 Fluorescent microscopy detection of A549 and H460 cells transfected with pEGFP-STK11 ( ×100) |
 |
Control:0.9% NaCl control group; 24 h:cells transfected with pEGFPSTK11 for 24 h;48 h:cells transfected with pEGFP-STK11 for 48 h;72 h: cells transfected with pEGFP-STK11 for 72 h
图3 Western blot检测STK11蛋白表达
Figure 3 STK11 expression detected by Western blot |
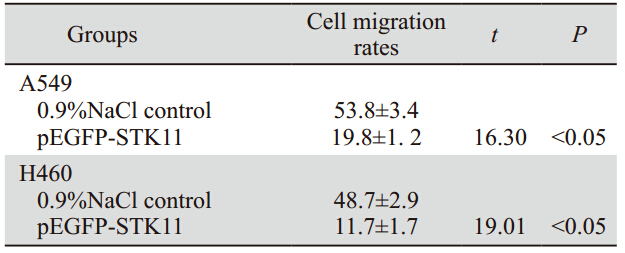
与划痕后即刻测量相比,各组细胞在划痕后48 h,划痕距离均明显缩小,有融合的趋势,见图 4。两种细胞均显示pEGFP-STK1重组质粒转染组 划痕较0.9%氯化钠溶液对照组细胞愈合慢,转染 组细胞迁移率小于0.9%氯化钠溶液对照组,差异 有统计学意义(P<0.05),且H460细胞迁移率小 于A549细胞,见表 1。
 |
A,B: wound closure of A549 cells in 0.9%NaCl control group after 0 and 48 h; C,D: wound closure of A549 cells in pEGFP-STK11 group after 0 and 48 h; E,F: wound closure of H460 cells in 0.9%NaCl control group after 0 and 48 h; G,H: wound closure of H460cells in pEGFP-STK11group after 0 and 48 h, respectively
图4 A549和H460细胞划痕实验检测细胞迁移情况 ( ×200)
Figure 4 Wound closure of A549 and H460 cells detected by Wound-healing assay( ×200) |
|
|
表 1 A549和H460细胞划痕实验结果(x±s, %, n=3) Table 1 Migration rates of A549 and H460 cells detected by Wound-healing assay(x±s, %, n=3) |
STK11基因位于人类染色体19p13.3区域上, DNA全长2155 bp,编码区含1302 bp,包括9个外 显子,其转录的mRNA约3.0 kb[2] 。STK11编码的丝氨酸/苏氨酸蛋白激酶包含433个氨基酸残基, 功能结构域包含一个激酶区域和氨基端非催化区 域的核定位信号通路[3]。STK11虽然最早在PJS综 合症中发现,但是有文献报道其在非小细胞肺癌 中也有散发性突变,突变率高达30% [4]。据文献报道,我们选择的H460和A549肺癌细胞株STK11基 因存在37密码子突变,无STK11蛋白表达[5]。针对这两种细胞株进行STK11重组质粒转染,使之过表 达,更有利于研究STK11基因的生物学功能。对我 们构建的重组质粒双酶切琼脂电泳可显示1 302 bp 的目的基因条带,基因测序与GenBank中STK11序 列一致,提示STK11重组质粒成功构建。荧光显微 镜检测pEGFP-STK11重组质粒转染组细胞EGFP表 达,也提示STK11重组质粒成功构建。Western blot 结果显示转染后细胞有STK11蛋白条带出现,表明 重组质粒在细胞内正确表达。
STK11基因调节多项生物学过程包括细胞生 长、细胞周期、极化、转移和能量代谢[6]。高益 军等[7]报道STK11通过下游mTOR-HIF-1α信号通路 调控肿瘤转移相关基因LOX(lysyl oxidase)而介 导肺癌的转移,LOX上调可激活β-1-integrin信号 通路,增强细胞的侵袭能力。文献报道,在临床上观察到发生远处转移的肺癌患者中STK11突变 率增高[8]。我们的细胞划痕实验提示,重组质粒转 染组细胞有细胞划痕愈合减慢的现象,初步证实 STK11有抑制肺癌迁移作用。我们下一步会采用 Transwell等方法进一步验证STK11基因的迁移抑制 作用,并通过检测Lox、Pdgf R和Vegfc等转移基因 来探讨其可能机制。
| [1] | van Lier MG, Wagner A, Mathus-Vliegen EM, et al. High cancer risk in Peutz-Jeghers syndrome: a systematic review and surveillance recommendations[J]. Am J Gastroenterol, 2010,105(6): 1258-64. |
| [2] | Hemminki A, Markie D, Tomlinson I, et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome[J]. Nature, 1998,391(6663):184-7. |
| [3] | Alessi DR, Sakamoto K, Bayascas JR. Lkb1-dependent signaling pathways[J]. Annu Rev Biochem, 2006,75:137-63. |
| [4] | Zhong D, Guo L, de Aguirre I, et al. Lkb1 mutation in large cell carcinoma of the lung[J]. Lung Cancer, 2006,53(3):285-94. |
| [5] | Sun LL, Zhong DS, Wu S, et al. Establishment and gene expression profiling of LKB1 stable knockdown lung cancer cell line[J]. Chin Med J (Engl), 2011,124(13):2028-32. |
| [6] | Lützner N, De-Castro Arce J, R?sl F. Gene expression of the tumour suppressor LKB1 is mediated by Sp1, NF-Y and FOXO transcription factors[J]. PLoS One, 2012,7(3):e32590. |
| [7] | Gao Y, Xiao Q, Ma H, et al. LKB1 inhibits lung cancer progression through lysyl oxidase and extracellular matrix remodeling[J]. Proc Natl Acad Sci U S A, 2010, 107(44):18892-7. |
| [8] | Matsumoto S, Iwakawa R, Takahashi K, et al. Prevalence and specificity of LKB1 genetic alterations in lung cancers[J]. Oncogene, 2007, 26(40): 5911-8. |
 2014, Vol.41
2014, Vol.41