2.四川大学华西医院呼吸内科
2.Department of Respiratory Medicine,West China Hospital,Sichuan University
肺癌是全球发病率和死亡率最高的恶性肿瘤 之一。据世界卫生组织(WHO)统计全球每年肺癌 新发病例超过120万,并呈逐年上升趋势。在中国 其死亡率也居恶性肿瘤死亡率之首[1]。放疗是目前 临床最普遍和重要的肺癌治疗手段之一,但疗效 不理想,尤其是非小细胞肺癌对放疗不敏感,因此 肿瘤基因治疗联合放疗增敏成为国内外研究的热 点。EGR-1(early growth response-1 gene,EGR-1) 基因启动子序列中的放射敏感度CArG盒可在电 离辐射作用下启动并诱导下游基因大量表达,实 现基因射线双重杀伤效应[2,3]。Bax是Bcl-2相关蛋 白,能抑制癌基因Bcl-2表达,促进细胞凋亡[4]。本 实验室以Bax作为目的基因,已成功构建重组质粒 pGL3/EGR1-Bax,并在此基础上将该质粒转染肺 癌H460细胞,研究放射治疗后该质粒中Bax基因在 肺癌H460细胞中表达和诱导凋亡的作用。 1 材料与方法 1.1 主要材料
人肺癌H460细胞株(中国科学院上海细胞 所);Bax兔多克隆抗体(Santa Cruz Biotechnology, Inc. USA);RNA抽提试剂盒及RT-PCR试剂盒(日 本TOYOBO公司);Lipofectamine™ 2000基因转染 试剂(美国Invitrogen公司);Annexin V-PI双染试 剂盒(北京碧云天公司) ;PCR System 7500 美 国应用生物系统公司(Applied Biosy Stems);酶 标仪(美国Thermo Varioskan Flash公司);直线 加速器(美国Varian Medical Systems,Inc公司); Quantity One凝胶分析系统(美国伯乐公司)。 1.2 重组质粒pGL3/EGR1-Bax的构建与鉴定 1.2.1 pTA2/EGR1、pTA2/Bax载体的构建与鉴定
分别设计扩增EGR1、Bax基因的引物,以小鼠 脑组织基因组DNA为模板,PCR法分别扩增(反应 条件:95℃ 1 min、95℃ 30 s、62℃ 1 min、72℃ 5 min,35个循环)EGR1、Bax基因的全长编码序列, 分别克隆入载体pTA2中,采用EcoRⅠ酶切与测序 进行鉴定,所构建的重组载体分别命名为pTA2/ EGR1、pTA2/Bax。 1.2.2 pGL3/EGR1-Bax质粒的构建与鉴定
再次设 计扩增EGR1、Bax基因,并含酶切位点及保护碱基 的引物,以pTA2/EGR1、pTA2/Bax为模板分别扩增 EGR1、Bax基因,分别采用KpnⅠ、NheⅠ,Hind Ⅲ、 XbaⅠ酶切位点将EGR1、Bax基因亚克隆至pGL3-Basic载体中,采用切酶与测序进行鉴定,所构建的 重组质粒命名为pGL3/EGR1-Bax。具体方法见参考 文献[5]。 1.3 EGR1、Bax基因向H460细胞株的转染
复苏、培养及传代所购买的H 460细胞株,待细胞生长至60 %~ 80 %融合状态时,以 Lipofectamine™ 2000介导纯化的pGL3/EGR1-Bax质 粒转染细胞,具体按Lipofectamine™ 2000说明书 进行。采用Amp筛选获得足够数量阳性克隆的含 pGL3/EGR1-Bax质粒的H460细胞。以未转染及空 pGL3-Basic载体转染的细胞做对照。
分组设计为H460空白对照组(不转染,不 照射),空载体组,载体组,单纯照射组,空载 体照射组,载体照射组,脂质体对照组。照射条 件:直线加速器(6 Mev电子线)照射或假照射各 组H460细胞10 Gy(剂量率:3 Gy/min),7 h后收 集细胞。 1.4 RT-PCR检测H460细胞Bax mRNA的表达
抽提H460细胞总RNA,进行RT-PCR分析,同 时设β-actin作为内参对照。Bax上游引物:5’-ACC CGGTGCCTCAGGATGCG-3’,下游引物:5’-GC TGCCACTCGGAAAAAGACCTC-3’;内参β-actin 上游引物:5’-CATGTTCGAGACCTTCAAC-3’, 下游引物:5’-CAGCTCGTAGCTCTTCTC-3’。 PCR反应条件:94℃ 5 min;94℃ 30 s,57℃ 30s, 72℃ 30 s,30个循环;72℃ 10 min。PCR产物于 1.2%琼脂糖凝胶电泳,应用凝胶图像扫描系统进 行密度扫描,计算Bax与β-actin的灰度比。 1.5 Western blot检测Bax蛋白的含量
提取每实验组H460的总蛋白,蛋白含量测定 按BCA法,以牛血清白蛋白为标准蛋白。以每孔50 μg上样,10%十二烷基磺酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE)凝胶电泳分离,通过电转移法将蛋白 质从SDS-PAGE 凝胶转移至PVDF膜上。PVDF膜 在含5%脱脂奶粉的TTBS中室温封闭2 h,加入鼠抗 人Bax一抗(1∶500倍稀释)4℃摇床过夜,转至室 温放置约30 min,TTBS充分漂洗(10 min×3次);加 入山羊抗小鼠二抗(稀释浓度为1∶1 000)室温反 应2 h,TTBS充分漂洗 (10 min×3次)。化学荧光法 (ECL)显色,以β-actin蛋白为内参照,曝光获取 图像。采用Quanity one 软件分析灰度值,比较各组 蛋白相对含量。 1.6 流式细胞仪检测细胞凋亡
将纯化的H460细胞直接收集到10 ml的离心管 中,每样本调整细胞浓度为5×105 /ml,800 r/min离 心5 min,弃上清液,加入预冷1×结合缓冲液100μl 重悬细胞,再加入标记有异硫氰酸荧光素的磷脂 结合蛋白(Annexin V-FITC)和碘化丙啶(PI)各 5 μl于细胞悬液中,4℃下避光染色10 min,补加 490 μl结合缓冲液混悬细胞后行流式细胞仪分析。 结果判断:细胞的凋亡率为早期及晚期细胞凋亡 数/细胞总数×100%。 1.7 统计学方法
采用SPSS12.0软件包进行统计分析,数据采 用(x±s)表示,样本均数比较采用q检验,P<0.05 表示差异有统计学意义。 2 结果 2.1 重组质粒的构建及鉴定
重组 pTA2/EGR1、pTA2/Bax质粒DNA分别 经EcoRⅠ酶切,0.7%琼脂糖凝胶电泳分别显示 2 957 bp 的pTA2骨架片段,含EGR1的907 bp与含 Bax的701 bp的目的片段。测序证实,所克隆到的 EGR1、Bax基因序列与GenBank发布的EGR1、Bax基因序列完全一致。重组pGL3/EGR1-Bax载 体经KpnⅠ、NheⅠ酶切,切下约3 794 bp与883 bp 的EGR1 片段;经Hind Ⅲ、XbaⅠ酶切,切下约4 000 bp 与677 bp 的Bax片段。测序证实,重组pGL3/ EGR1-Bax质粒构建成功,见图 1。
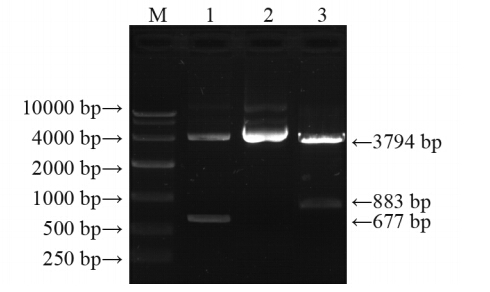 |
M:DNA marker;1:Hind Ⅲ, XbaⅠenzyme digestion PGL3-basic/
BAX-EGR1;2:PGL3-basic/BAX-EGR1;3:KpnⅠ,NheⅠenzyme digestion PGL3-basic/BAX-EGR1
图1 重组pGL3/EGR1-Bax载体的酶切分析
Figure 1 The restriction analysis of pGL3/EGR1-Bax |
pGL3/EGR1-Bax 重组质粒转染H460细胞后, 分组予以直线加速器10 Gy照射或假照射。7 h后收 集细胞行RT-PCR法检测各组Bax基因转录水平; 裂解细胞,提取蛋白,用Western blot法检测Bax蛋 白表达水平。电泳结果见图 2,蛋白印迹见图 3。用Quantity One凝胶分析系统行半定量分析结果见 表 1、2,各载体组及载体照射组Bax基因转录及蛋 白表达水平与未转染组、空载体组、单纯照射组 比显著升高,P值均<0.05。且以转染载体并照射组 升高最为明显(P<0.01)。本实验表明辐射能诱导 pGL3/EGR1-Bax重组质粒中Bax基因在肺癌H460 细胞表达明显增强。
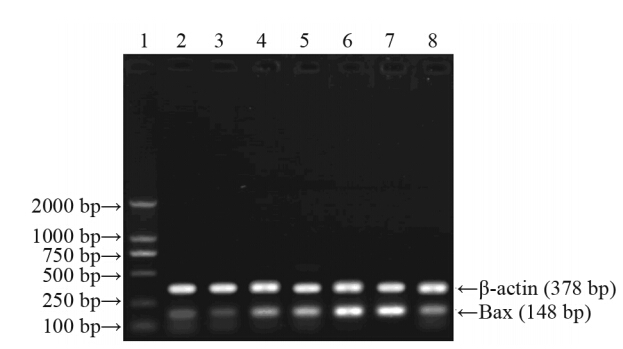 |
1: marker( DL2000);2: control group;3:empty vector group;4:empty
vector irradiated group;5: irradiation group;6:vector group;7: carrier irradiated group;8:liposome control group
图2 各组H460细胞Bax mRNA的表达
Figure 2 Bax mRNA expression in H460 cells in each group |
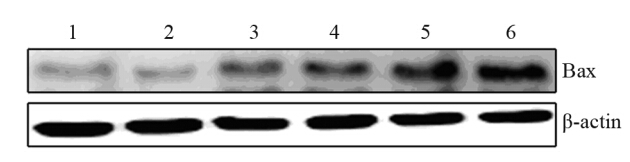 |
1: control group;2:empty vector group ;3: empty vector irradiated
group;4: irradiation group;5: vector group;6: carrier irradiated group
图3 各组H460细胞Bax基因编码蛋白的表达
Figure 3 Bax protein expression in H460 cells in each group |
|
|
表 1 各组H460细胞Bax mRNA的表达结果 (x±s,n=3) Table 1 Bax mRNA levels in H460 cells in each group (x±s,n=3) |
|
|
表 2 各组H460细胞Bax 蛋白的表达结果 (x±s,n=3) Table 2 Bax protein Levels in H460 cells in each group (x±s,n=3) |
Annexin V-PI双染,流式细胞仪检测显示, 见图 4,H460细胞凋亡率照射组(空载体照射组、 单纯照射组、载体照射组)较非照射组(即对照 组、空载体组、载体组)显著升高,P值均小于 0.01。载体加照射组与空载体加照射组细胞凋亡率 分别为(19.17±1.10) %与(13.31±1.11) %,两者相比 差异有统计学意义(P=0.00)。提示放疗能促进肺癌 H460细胞的凋亡,基因结合放疗能加速肺癌H460 细胞凋亡,见表 3。
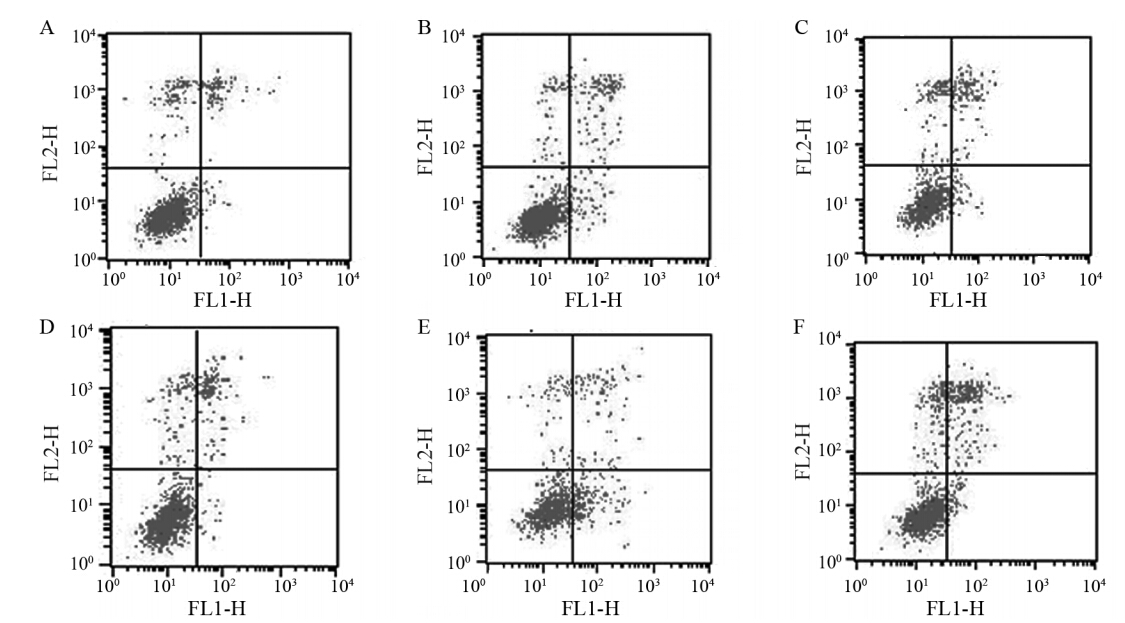 |
A: control group;B: irradiation group;C: empty vector irradiated group;D: vector group;E: carrier irradiated group;F: empty vector group
图4 H460细胞凋亡率的Annexin V-FITC/PI流式细胞图
Figure 4 Annexin V-FITC/PI flow cytometry of apoptosis rate of H460 cells |
|
|
表 3 各组H460细胞凋亡率 (x±s,n=3) Table 3 Apoptosis rate of H460 cells in each group (x±s,n=3) |
以手术、化疗、放疗为主的综合治疗是肺癌 的主要治疗方法,但疗效尚不理想,肺癌患者5年 生存率仍很低,美国约为15%,我国仅为10% [6]。
因此亟待寻找治疗肺癌的更为有效的手段。肿瘤 基因治疗联合放疗增敏是继手术、放疗及化疗之后兴起的一种新的治疗肺癌的方法,被认为是目 前治疗肺癌极有前景的治疗手段之一。肿瘤基因 治疗是将对肿瘤有直接或间接杀伤作用的基因经 载体转入体内,在肿瘤生长部位表达而发挥杀伤 肿瘤作用。Egr-1启动子的发现使放疗和基因治疗 得到了有效结合。国内外研究表明,Egr-1启动子 可受电离辐射等因素刺激而激活,进而诱导其下 游基因表达。Weichselbaum等于1992年首先提出基 因放射治疗的设想,该研究小组其后的实验结果 亦证实将具有辐射诱导特性的基因和肿瘤杀伤基 因一同转入肿瘤局部,在实施局部放疗的同时诱 导肿瘤杀伤基因表达,产生双重杀伤效果[7]。
Bax是Bcl-2的相关蛋白,是Bcl-2家族中研究 最广泛的促凋亡蛋白,它作用于肿瘤的抑制物促 进细胞凋亡。Bax可与抗凋亡基因Bcl-2形成异源二 聚体,Bax与Bcl-2两者之间的比例决定了细胞的 命运,若Bax占多数,则Bcl-2被抑制,凋亡被诱 导,加速细胞死亡;反之则Bax受到抑制,细胞得 以生存[8,9]。当细胞内Bax较多时,Bax自身亦可形 成同源二聚体占主导,从而促进细胞凋亡[10]。由 于肿瘤细胞对放射的敏感度不同,不同程度上影 响了非小细胞肺癌放射治疗的效果。凋亡相关基 因Bcl-2在许多人类肿瘤中都存在着过表达,过高 的抗凋亡蛋白基因Bcl-2表达打破了正常的细胞凋 亡机制,使细胞对放疗和化疗表现出广泛的抵抗 性[11]。因此我们构建pGL3/EGR1-Bax重组载体, 脂质体介导重组质粒转染肺癌细胞H460后进行电 离辐射的诱导。实验发现重组载体照射组Bax的 mRNA与蛋白表达量均较其他各组明显升高。提 示Egr-1启动子经辐射激活,刺激下游Bax基因在肿 瘤细胞表达显著增强,从而抑制了肿瘤细胞中高 表达的抗凋亡基因Bcl-2,增加了肺癌细胞的放射 敏感度,进一步促进Egr-1启动子的激活。
国内外学者将Egr - 1启动子连接P16 [12]、 INF[13]、TNF-α[13,14]、TRAIL [15]、endostatin [16]等不同的下游基因,联合放射治疗胰腺癌、食管癌等 不同的肿瘤都取得了明显的抑瘤效应。为了探讨 Bax基因联合放射治疗对非小细胞肺癌的作用, 本实验在构建辐射诱导表达载体pGL3/EGR1-Bax 的基础上,研究了体外转染联合辐射对肺癌H460 细胞凋亡的影响。结果表明,pGL3/EGR1-Bax重 组质粒转染H460细胞后联合照射组细胞凋亡率较 其他照射组明显升高,提示射线通过激活Egr-1启 动子诱导治疗基因Bax表达增强,从而加强了基因对肿瘤细胞的凋亡杀伤作用。本实验同时发现重 组载体组Bax的mRNA与蛋白表达量低于载体照射 组,高于其他各组;但重组载体组细胞凋亡率却 低于各单纯照射组,那么高表达Bax的载体组与单 纯照射组和空载体照射组相比凋亡率为什么更低 呢?可能由于辐射较高表达的Bax基因更为显著抑 制了肺癌细胞过高表达的抗凋亡基因Bcl-2,而致 单纯照射组和空载体照射组凋亡率较单纯重组载 体组更高。重组载体联合照射双重因素作用下导 致H460细胞凋亡显著增加。本研究为促凋亡基因 Bax联合放射治疗的临床应用提供了重要的理论和 实验依据。我们希望在以后的相关研究中继续探 索并逐步得到解决和论证。
| [1] | Peng H, Han BH, Li XQ, et al. Analysis of clinical characteristics and survival rates in 1 279 lung cancer patients[J]. Zhongguo Ai Zheng Za Zhi,2011,21(5):354-8. [彭红,韩宝惠,李小青, 等.1279例肺癌患者临床特征及生存率分析[J].中国癌症杂志,2011,21(5):354-8.] |
| [2] | Liu C,Calogero A,Ragona G,et al. EGR-1, the reluctant suppression factor: EGR-1 is known to function in the regulation of growth, differentiation, and also has significant tumor suppressor activity and a mechanism involving the induction of TGF-beta1 is postulated to account for this suppressor activity[J]. Crit Rev Oncog,1996,7(1-2):101-25. |
| [3] | Papanikolaou NA, Sabban EL. Ability of Egr1 to activate tyrosine hydroxylase transcription in PC12 cells. Cross-talk with AP-1 factors[J]. J Biol Chem,2000,275(35):26683-9. |
| [4] | Valentijn AJ,Upton JP,Gilmore AP.Analysis of endogenous Bax complexes during apoptosis using blue native PAGE: implications for Bax activation and oligomerization[J]. Biochem J,2008,412(2):347-57. |
| [5] | Huang J, Shen Q, Feng YL,et al. Constructon of recombinant vector pGL3/EGR1-Bax and its transfection into the cell of nonsmall-cell lung carcinoma[J]. Shanghai Jiao Tong Da Xue Xue Bao(Yi Xue Ban),2012,32(12):1659-62. [黄静,沈庆,冯玉麟,等. pGL3/EGR1-Bax重组载体的构建及对非小细胞肺癌细胞的转染[J].上海交通大学学报(医学版),2012,32(12):1659-62.] |
| [6] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin,2009,59(4):225-49. |
| [7] | Staba MJ, Mauceri HJ, Kufe DW, et al.Adenovioral TNF-alpha gene therapy and radiation damage tumor vasculature in a human malignant glioma xenograft[J]. Gene Ther,1998,5(3):293-300. |
| [8] | Lai MY, Huang JA, Liang ZH, et al. Mechanisms underlying aspirin-mediated growth inhibition and apoptosis induction of cyclooxygenase-2 negative colon cancer cell line SW480[J]. World J Gastroenterol,2008,14(26):4227-33. |
| [9] | Huang JH, Ling CH, Yang JC, et al. The in vitro and in vivo effects of adenovirus-mediated inhibitor of growth 4 and interleukin-24 co-expression on the radiosensitivity of human lung adenocarcinoma[J]. Zhonghua Jie He He Hu Xi Za Zhi,2011,34(6):413-8. [黄锦宏,凌春华,杨吉成,等.腺病毒介 导的肿瘤生长抑制因子4和白细胞介素-24双基因共表达对 肺腺癌放疗增敏的体内外实验研究[ J] .中华结核和呼吸杂志,2011,34(6):413-8.] |
| [10] | Yethon JA, Epand RF, Leber B, et al. Interaction with a membrane surface triggers a reversible conformational change in Bax normally associated with induction of apoptosis[J]. J Biol Chem,2003,278(49):48935-41. |
| [11] | Xu XY, Xu DQ, Chen M, et al. To Explore the activity of generation and the cell cycle of NCI-H460 by RNAi inhibiting Bcl-2 gene expression and combining treatment with radiation[J]. Shi Yong Zhong Liu Xue Za Zhi,2012,26(1):37-41. [徐向英, 许德权,陈蜜,等. Bcl-2基因表达抑制联合射线对NCI-H460 细胞增殖状态及细胞周期影响的研究[ J ] .实用肿瘤学杂志,2012,26(1):37-41.]. |
| [12] | Ma HB,Wang XJ, Hu HT,et al. Anti-tumor effect of pcDNA3.1-Egr.1p-p16 gene combined with radiotherapy in tumorbear ing nude mice[ J] . Zhong Nan Da Xue Xue Bao( Yi Xue Ban),2005,30(1):7-10,15. [马红兵,王西京,胡海涛,等. pcDNA3.1-Egr.1p-p16基因联合放射治疗对裸鼠肿瘤的作用[J]. 中南大学学报(医学版), 2005,30(1):7-10,15.] |
| [13] | Kufe D, Weichselbaum R. Radiation therapy: activation f or gene tr anscr iption and the development of genetic radiotherapy-therapeutic strategies in oncology[J]. Cancer Biol Ther,2003,2(4):326-9. |
| [14] | Wu CM,Huang TH,Wu DS,et al. Experimental study on inhibition of pEgr- TNFα gene ther apy combined with radiotherapy on esophageal cancer cells[J]. Ai Bian·Ji Bian·Tu Bian,2006,18(1):6-8.[吴丛梅,黄天华,吴德生,等. pEgr-TNFα基因联合放疗抑制食管癌细胞生长的实验研究[J]. 癌变·畸变·突 变,2006,18(1):6-8.] |
| [15] | Hu Y, Ouyang W, Wu F,et al. Enhanced radiosensitivity of SW480 cells via TRAIL up-regulation mediated by Egr-1 promoter[J]. Oncol Rep,2009,22(4):765-71. |
| [16] | Zhong YC, Jiang P, Wang LP,et al. Experimental study on antitumor effect of PIRES-EGR-1-endostatin gene by radiotherapy[J]. Zhonghua Fang She Zhong Liu Xue Za Zhi,2010,19(1):12-3. [张 永春,姜鹏,王路平,等. PIRES-EGR-1-endostatin基因放疗抗肿瘤效应的实验性研究[J]. 中华放射肿瘤学杂志,2010,19(1):12-3.] |
 2014, Vol.41
2014, Vol.41






