2.中国科学院重离子束辐射生物医学重点实验室;
3.甘 肃省重离子束辐射医学应用基础重点实验室;
4.中国科学 院大学
2.Key Laboratory of Heavy Ion Radiation Biology and Medicine of Chinese Academy of Sciences;
3. Key Laboratory of Heavy Ion Radiation Medicine of Gansu Province;
4. Graduate University of Chinese Academy of Sciences
线粒体DNA突变主要有两种主要形式: 线粒体DNA大片段缺失和线粒体DNA点突变 (SNPs)。线粒体DNA大片段缺失是线粒体DNA 环中因为复制错误或DNA损伤重排等原因丢失掉 一部分大于1 000个碱基对序列的基因信息。这种 突变因为使线粒体编码信息大量遗失而会导致严 重的线粒体功能障碍,在一些老化细胞和组织中 具有显著的累积趋势。一些学者认为由于大片段 缺失能够使线粒体DNA环缩小,赋予其相对的复 制优势,因而这种突变随着衰老的进程会逐渐累 积在细胞中,最终加速衰老的进程[1]。线粒体DNA 点突变也在相关的疾病发展中起着重要作用,如 rRNA基因A7445G突变引起非综合征感觉性神经 性耳聋,线粒体DNA D-loop区突变由于在肿瘤组 织细胞中较为普遍,近几年逐渐得到了研究者们 的重视[2]。
线粒体DNA突变与很多疾病有关,如帕金森 症,阿尔兹海默症,线粒体肌病等[3,4,5,6]。重离子由 于剂量分布具有Bragg峰,能使高吸收剂量区集中 于肿瘤部位,从而有效地保护周围的健康组织,且 具有相对生物效应高、修复效率低等特点,在放疗 方面比较理想,被认为是潜在的更有效的放射治 疗手段。尽管重离子束能够更好地杀死肿瘤细胞, 我们也不得不考虑其潜在的致突变能力。放疗引起 的二次肿瘤一直是放射生物学研究的重要内容。重 离子辐射引起的线粒体DNA突变亟待研究。 在此,我们分别采用近代物理研究所重离子 加速器产生的12C6+离子束对肿瘤细胞进行辐照, 就线粒体突变中最典型常见的两种突变:线粒体 DNA 4 977bp大片段缺失和D310区突变进行了研 究,定性定量地确定了重离子辐照所引起的典型 线粒体DNA突变。 1 材料与方法 1.1 材料
人乳腺癌细胞MCF-7购自上海细胞中心,高 糖型DMEM培养液购自美国Invitrogen公司,小牛 血清购自美国Gibco公司,Taq酶购自日本Takara公 司,DNA提取试剂盒购自中国天根公司,PCR荧 光染料购自日本Takara公司,DNA凝胶回收试剂 盒购自中国碧云天公司。 1.2 线粒体DNA 4 977大片段缺失检测
线粒体DNA 4 977大片段缺失定量检测使用 罗氏LightCycler 2.0荧光定量PCR系统进行分析。 分别在毛细管中加入含有50 ng总DNA模板,1× SYBR premix Ex Taq Ⅱ以及200 nmol/L 的线粒体 DNA或核DNA标志物引物。引物序列信息如下: 线粒体DNA 4 977大片段:HSAS8542: 5'-TGTG GTCTTTGGAGTAGAAACC-3';HSSN8416:5'- CCTTACATTCCTCATCACC-3';线粒体DNA拷贝 数内参:ND1F:5'-CACCCAAGAACAGGGTTTGT-3';ND1R: 5'-TGGCCATGGGTATGTTGTTAA-3'。 每次实验重复三次。扩增条件如下:95℃ 5 s, 55℃ 10 s,72℃ 10 s,共40个循环。每次扩增结束 后进行溶解曲线分析。溶解曲线检测条件如下: 95℃变性1 min,65℃下复性15 s,以0.1℃每秒的 检测速率重新回复到95℃。 1.3 线粒体D310区点突变检测 1.3.1 克隆存活检测
指数期生长的MCF-7细胞经过1~8 Gy X射线或 重离子射线辐照后在1 h内接种到100 mm的培养皿 内,接种细胞数量根据照射剂量的提高而提高。 每种处理进行至少4个平行实验。细胞接种后继续 培养2周后取样。洗净培养液后使用PBS轻柔清洗 一遍,甲醇固定20 min,新鲜配制的吉姆萨染液染 色并计数。样品于普通显微镜下进行计数,克隆 群落中至少含有50个细胞才能被计入。 1.3.2 线粒体D310区点突变克隆检测
根据克隆存活实验得到的D10剂量,即能使细 胞存活下降到10%的相对X射线或重离子射线剂量 对MCF-7细胞进行照射处理,重复以上的克隆存 活步骤以得到在D10剂量下存活的细胞克隆。含有 克隆的培养皿经PBS漂洗3次后加入少量胰酶短暂 消化,随后在普通光学显微镜下使用100 μl枪头 挑取存活克隆,转移到100 μl PCR管中进行PCR 扩增检测。线粒体D 310区片段扩增在Eppendorf Mastercycycler PCR仪上进行,引物序列信息如 下:正向引物5'-ACAATTGAATGTCTTGCACAGC CACTT-3';反向引物5'-GGCAGAGATGTGTTTAA GTGCTG-3'。
循环反应如下:94℃ 30 s预变性;94℃ 10 s, 55℃ 30 s,72℃ 15 s共30个循环;72℃最终延伸 10 min。实验分为三组:对照组、X射线辐照组和 重离子射线辐照组。每组样品各挑取50个克隆样 本进行扩增,扩增产物送往上海生物工程有限公 司进行测序分析。 1.4 统计学方法
数据使用LightCycler 自带软件进行分析,实 验结果通过相对定量分析结果(△△Ct)进行表示。 测序结果通过DNAMAN分析软件进行比对分析。 2 结果 2.1 重离子射线与X射线生物学效应结果
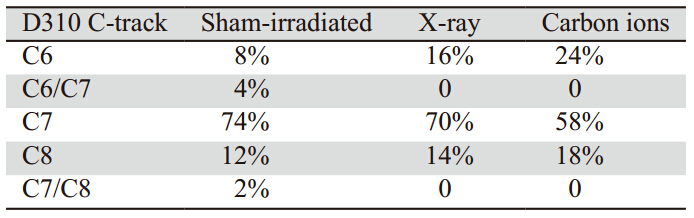
使用克隆存活分析MCF-7细胞对重离子和X 射线的辐射敏感度。结果显示,X射线辐照后的 MCF-7存活曲线存在一个明显的肩区,而重离子 辐照后没有。在相同剂量的电离辐射条件下,重 离子射线对MCF-7细胞的杀伤作用明显强于X射 线,见图 1。以10%存活分数(D10)作为标准, 重离子射线对MCF-7细胞的相对生物学效应为3.1 (1.5 Gy碳重离子/4.65 Gy X射线)。以此为基 础,选择在具有相同杀伤效果的辐射剂量下(1.5 Gy碳重离子/4.65 Gy X射线)对两种射线引起的线 粒体DNA突变进行定量分析。
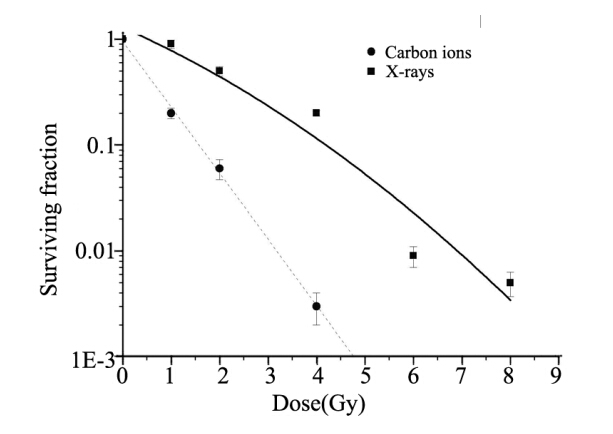 |
图1 不同剂量碳重离子或X射线处理后MCF-7细胞的存活 曲线 Figure 1 Survival curves of MCF-7 cells after different doses of carbon ion or X-ray irradiation |
D310区SNP位点克隆突变检测发现X射线能够 在存活细胞中引起一定程度的D310区突变,重离 子射线辐照后存活的MCF-7细胞中正常C7序列明显减少(58% vs. 74%),单碱基插入C8和单碱基 缺失C6的丰度则明显升高,分别是18%和24%,见 表 1。这表明重离子射线辐照在MCF-7细胞中能够 引起严重的D310区点突变。
|
|
表 1 转染TGFBI的乳腺癌细胞对裸鼠体内肿瘤发生率的影响 Table 1 D310 polymorphism distribution in cell clone under two treatment conditions |
重离子和X射线辐照后MCF-7 细胞中线粒体 DNA 4 977缺失含量的变化情况在72 h内表现一 致。如图 2所示,线粒体DNA 4 977缺失含量在照 后24 h达到峰值,并在随后的48和72 h时间点迅速 下降至本底水平。射线类型对线粒体DNA 4 977缺 失的产生无明显区别。
 |
图2 MCF-7细胞经1.5 Gy 碳重离子或4.65 Gy X射线辐照 后72小时以内线粒体DNA4 977缺失含量变化情况 Figure 2 Quantification of mtDNA4 977 deletions in MCF-7 cells after 1.5Gy carbon-ion or 4.65 X-ray irradiation for 72h |
已经有实验表明X射线辐射能够在肿瘤细胞中 诱导产生线粒体DNA 4 977缺失[7],本实验的前期 初步结果发现重离子辐射能够在肿瘤细胞HeLa中 引起线粒体DNA 4 977缺失的产生[8,9]。为了进一 步确定重离子辐射诱导的线粒体DNA 4 977缺失 的动态变化,我们使用real-time PCR定量检测了 MCF-7细胞中线粒体DNA 4 977缺失在幅照72小 时以内含量的变化。实验结果表明,线粒体DNA 4 977 bp缺失的存在对宿主细胞能够产生严重的 氧化胁迫,这种胁迫很可能是由于线粒体功能 障碍所引起的。由于这种胁迫能够引起线粒体 DNA 4 977bp缺失宿主细胞的程序性死亡,从而 使得辐照后存活细胞中线粒体DNA 4 977bp缺失比 例大量减少。以上结果说明线粒体DNA 4 977bp缺 失对宿主细胞来说是一种有害突变,在大多数情 况下不能在存活细胞中得到遗传。实验中我们 发现碳重离子和X射线都能够引起线粒体DNA 4 977缺失的产生,且其产生和消除的规律都基本 一致,说明碳重离子所引起的线粒体DNA大片段 确实与X射线所引起的没有本质区别。
相对于线粒体DNA大片段缺失这种可能直接 影响线粒体功能的突变来说,线粒体DNA突变的 另一种主要形式就是DNA点突变。尽管线粒体 DNA点突变在功能上对线粒体的影响不如线粒体 DNA大片段缺失剧烈,但由于线粒体DNA序列中 仅存很少的非编码序列,辐射引起的点突变也可 能在功能上对线粒体产生影响,从而最终影响细 胞生命活动的改变和存亡。我们对目前已知线粒 体DNA上最常见的突变—D310区点突变进行了 定量分析,发现重离子辐照对于D310区的致突变 能力显著高于X射线辐照。D310序列位于线粒体 基因组的D-loop区(Displacement-loop region), D-loop区全长为1 120 bp,是mtDNA复制和转录的 重要调控区域。最近的研究表明D310序列突变在 肿瘤组织中相当普遍,而D-loop突变也被证实在头 颈部肿瘤、结肠癌、肺癌、胃癌、肝癌、卵巢癌、 子宫浆液性癌等多种肿瘤细胞中明显升高[10,11], 因此D-loop突变,尤其是D310序列突变有望成为 肿瘤诊断的分子标记及作为早期肿瘤发生阶段的 检测标记。由于线粒体D310区位于线粒体复制转 录的调控区,这种点突变可能影响线粒体DNA的 复制、线粒体特异蛋白的转录和翻译,从而导致 细胞中线粒体功能的改变,因此也应对其后续引 起的变化予以重视。另外,由于重离子辐射引起的线粒体D310区突变主要以单碱基插入或缺失为 主,这种突变本身不会对线粒体相关蛋白的功能 产生影响,可以视为一种较为中性的突变。与辐 射引起的线粒体DNA 4 977缺失不同,重离子辐射 引起的D310突变在照后MCF-7细胞中随时间逐渐 累积。这是因为线粒体DNA 4 977bp 缺失能够照 成严重的线粒体功能障碍,将进一步导致细胞内 氧化胁迫情况的加重,进而引起细胞的死亡。因 此,含有大量线粒体DNA 4 977bp缺失的细胞在 照后长时间培养的过程中通过程序性死亡而被清 除,从而导致细胞群体中线粒体DNA 4 977bp缺失 的显著下降。由于D310区直接影响线粒体DNA的 转录与复制,D310突变可能会直接影响辐照后线 粒体DNA拷贝数量的变化。具有突变D310区域的 线粒体DNA相对于正常线粒体DNA可能具有复制 优势,从而导致了这种突变在照后细胞中的逐渐 累积。
综上所述,重离子辐照能够引起肿瘤细胞线 粒体DNA的突变。在线粒体DNA突变的两种主 要形式,即大片段缺失和点突变中,照后存活的 细胞中线粒体DNA 4 977缺失仅能短暂存在,而 D310突变则能稳定存在于存活细胞中。由于很多 肿瘤细胞缺乏完善的质量调控体系,我们认为在 细胞中的线粒体可以视作一个异质性的群落,这 种群落不仅能够容许一定程度上的个体遗传信息 差异,也能够对群落中的突变进行筛选。尽管重 离子辐射所引起的线粒体DNA大片段缺失情况与 X射线基本一致,但其造成的D310区点突变累积 现象还应警惕。这可能是由于重离子射线由于其 物理性质上与X射线的不同所引起的。重离子辐 照可以引起更多数量的双链断裂,而双链断裂修 复本身就更容易产生突变。尽管功能性的突变在 肿瘤细胞中仅能短暂存在,但非功能性突变(如 D310)的累积也可能间接影响肿瘤细胞的表型, 存在着促进肿瘤恶化的风险。这对我们进一步了 解肿瘤发生发展过程中线粒体的变化具有一定参 考价值。
| [1] | Clayton DA. Mitochondrial DNA replication: what we know[J]. IUBMB Life, 2003, 55(4-5): 213-7. |
| [2] | Parrella P, Seripa D, Matera MG, et al. Mutations of the D310 mitochondrial mononucleotide repeat in primary tumors and cytological specimens[J]. Cancer Lett, 2003, 190(1): 73-7. |
| [3] | Pachalska M, DiMauro S, Formińska-Kapu?cik M, et al. The course of vision disturbances in a patient with the MELAS syndrome[J]. Med Sci Monit,2002, 8(2): CS11-20. |
| [4] | Liu CS, Ko LY, Lim PS, et al. Biomarkers of DNA damage in patients with end-stage renal disease: mitochondrial DNA mutation in hair follicles[J]. Nephrol Dial Transplant, 2001, 16(3): 561-5. |
| [5] | Wallace DC. Mitochondrial defects in cardiomyopathy and neuromuscular disease[J]. Am Heart J, 2000, 139(2 Pt 3): S70-85. |
| [6] | Becher MW, Wills ML, Noll WW, et al. Kearns-Sayre syndrome with features of Pearson’s marrow-pancreas syndrome and a novel 2905-base pair mitochondrial DNA deletion[J]. Hum Pathol, 1999, 30(5): 577-81. |
| [7] | Prithivirajsingh S, Story MD, Bergh SA, et al. Accumulation of the common mitochondrial DNA deletion induced by ionizing radiation[J]. FEBS Lett, 2004, 571(1-3): 227-32. |
| [8] | Zhou X, Li N, Wang Y, et al. Effects of X-irradiation on mitochondrial DNA damage and its supercoiling formation change[J]. Mitochondrion, 2011, 11(6): 886-92. |
| [9] | Zhou X, Zhang H, Li N, et al. Common mitochondrial DNA 4977 bp deletion in Hela cells induced by 12C(superscript 6+) ion irradiation[J]. Zhongguo Zu Zhi Gong Cheng Yan Jiu Yu Lin Chuang Kang Fu, 2009,13(9):1665-8.[周鑫, 张红,李宁,等.碳离子辐射引起Hela细胞线粒体DNA 4 977 bp的缺失[J]. 中国组织工程研究与临床康复, 2009, 13(9):1665-8.] |
| [10] | Simonnet H, Alazard N, Pfeiffer K, et al. Low mitochondrial respiratory chain content correlates with tumor aggressiveness in renal cell carcinoma[J]. Carcinogenesis, 2002, 23(5): 759-68. |
| [11] | Tengan CH, Ferreiro-Barros C, Cardeal M, et al. Frequency of duplications in the D-loop in patients with mitochondrial DNA deletions[J]. Biochim Biophys Acta, 2002, 1588(1): 65-70. |
 2014, Vol.41
2014, Vol.41