2. 哥伦比亚大学放射研究中心
2. Center for Radiological Research, Columbia University Medical Center, New York, U.S.A.
乳腺癌在女性癌症死因中占首位[1],且因其新 发病例最多[2],发病年龄呈年轻化趋势,严重威胁 女性健康。但乳腺癌患病原因和恶性进程的精确分 子机制仍不十分清楚。 转化生长因子β诱导基因(transforming growth factor-β induced gene,TGFBI)也被称为Betaig-3, 是一种由TGF-β诱导的分泌蛋白,最初认为其与肿 瘤相关,是因为发现TGFBI能够使接种裸鼠体内肿 瘤细胞的致瘤能力减弱[3]。最近研究发现,TGFBI 的FAS1结构域有抑制肿瘤作用,表现在抑制肿瘤 生长、血管发生及促凋亡作用[4]。Zhao等[4,5,6,7,8]发现很 多肿瘤细胞中TGFBI表达下降,并且体内、外实验 都发现外源性TGFBI能够抑制肿瘤细胞的恶性转 变。
本研究将外源性TGFBI转染到人乳腺癌细胞 (MDA-MB-231)中,得到稳定性表达TGFBI的细胞 株,观察TGFBI对乳腺癌细胞的生长和侵袭是否具 有抑制作用。 1 材料与方法 1.1 TGFBI转染及鉴定
人乳腺癌细胞株(MDA-MB-231)来源于美国 模式培养物集库存,使用DMEM完全培养液(英杰 公司,美国),10%胎牛血清( Gibco公司,美国), 100 µg/ml 链霉素,100 u/ml青霉素。TGFBI转染 的主要过程为:制备4 µg载体pRc/CMV2-TGFBI或 pRc/CMV2-空载体与转染试剂Lipofectamine Plus (英杰公司,美国)混合后,加入已接种细胞的6孔 培养板培养3 h;然后换完全培养液继续培养72 h。按1∶10比例把已转染TGFBI或空载体的细胞 分到100 mm的培养板中,在400 mg/ml 的G418培 养液(Sigma公司,美国)中培养,挑选稳定性表达 TGFBI或空载体的抗性集落。
采用实时定量PCR检测TGFBI mRNA的表达。 TRIzol (Invitrogen公司,美国) 提取细胞总RNA; RT试剂盒(英杰公司,美国)将提取的总RNA反 转录成cDNA;实时定量 PCR仪7300 (AB公司,美 国),用SYBR Green定量分析TGFBI mRNA。内参 基因GAPDH (目录号PPH00150E) ,靶基因TGFBI (目录号PPH01904B)。PCR循环参数:95℃ 15 min;95℃ 30 s,55℃ 30 s,72℃ 30 s,40个循环。 实验结果以倍数的变化2-∆∆Ct表示,ΔCt = CtTGFBI- CtGAPDH ΔΔCt = Ct样品-Ct对照。
细胞培养24 h提取蛋白,加10%的三氯乙酸后 离心,用丙酮洗涤沉淀物两次,室温干燥;加50 µl 上样缓冲液煮沸5 min,上样,Western blot法检 测细胞培养上清液中TGFBI蛋白的表达。免疫组 织化学方法鉴定TGFBI在细胞内分布情况。使用 染色试剂盒 (Vector Laboratories公司,美国),先用 1.5%马血清封闭样品,加1:1 000的人抗TGFBI单 抗(Minneapolis公司,美国)37℃孵育2 h,PBS 洗3次后;加1:5 000的二抗,室温孵育30 min,加 VECTASTAIN Elite ABC室温反应30 min,最后加 DAB ( 3,3’ - 二氨基联苯胺)底物显色6 min,双蒸水 冲洗;酒精梯度脱水后,加封片剂封固样品。在 BX60 奥林巴斯显微镜下观察TGFBI蛋白在细胞内 的分布。 1.2 细胞增殖测定
细胞增殖测定试剂盒(英杰公司,美国)检 测细胞增殖,先用无血清的 DMEM培养液培养细 胞36h,然后换用含 10% 胎牛血清的 DMEM 培 养液培养 0、12、16、20及24后用PBS冲洗,加 入100 µl染料结合液,37℃孵育1 h。使用酶标仪 (Bio-Tec公司,美国)测定荧光强度。细胞增殖 率用增加的荧光强度百分数表示,即增加的百分 比 = ( n 时的荧光强度 - 0时的荧光强度) /0时的荧 光强度。 1.3 软琼脂克隆形成测定
将1 000个细胞与1 ml 0.35%琼脂糖混合,接 种于底部铺有0.75%琼脂糖的培养皿中,每组4个 平行样本。在10倍显微镜下观察并计算集落数, 实验结果用相对集落数表示,即相对克隆形成数 = 外源性TGFBI表达细胞的克隆形成数 /母代细胞的 克隆形成数。 1.4 细胞周期分析
无血清培养液培养细胞36 h,使细胞周期同 步化于G0/G1期。换用含10%胎牛血清的培养液培 养,在0、4、8、12、16、20及24 h后,收集包括 培养液中悬浮的全部细胞,75%冰乙醇4℃固定过 夜,用PI标记细胞,流式细胞仪(BD公司,美国)分 析细胞周期。 1.5 Western blot检测
将细胞接种于100 mm的培养皿中,使细胞 同步化于G0/G1期,换用10%胎牛血清培养液刺激 细胞进入新的细胞周期,在血清刺激后的不同时 间点,用冷的PBS冲洗细胞。用细胞裂解液(50 mMTris-Hcl,pH8,150 mM Nacl,1%SDS,1mM PMSF)提取蛋白质,用蛋白浓度试剂盒(美国伯 乐公司)测蛋白浓度,取30 µg蛋白质加入到50 µl 的上样缓冲液中煮沸5 min,上样于10%~20%SDS 胶(伯乐公司,美国),在电压20V的条件下电泳 2~4 h,在半干燥条件下将蛋白样品转移到PVDF膜 上。洗膜,5%脱脂牛奶封闭,分别加入1∶1 000 的P21、P53或β-actin一抗,4℃过夜,洗膜三次; 1∶5 000的二抗孵育2 h,洗膜三次;ECL显色液 (Amersham Biosciences公司,美国),全自动洗片 机(KODAK公司,美国)进行全自动显色、洗片 和烘干。 1.6 体内致瘤性检测
2月龄裸鼠饲养在特殊的无病原体的环境中, 小鼠可以自由进食,饮水,日光/黑暗为12 h/12 h。 每组皮下注射5×106个肿瘤细胞于裸鼠背部。每周 称体重,观察肿瘤的发生情况,注射细胞16周后 处死裸鼠。 1.7 免疫组织化学染色
将裸鼠皮下取出的肿瘤组织用10%福尔马林固 定一周左右,送病理室进行脱水、石蜡包埋、切片 后,进行Ki67和MECA-32的免疫组织化学染色。 一抗分别是Ki67和MECA-32,浓度为1∶100。每个样品随机选择5个视野共100个细胞,计数细胞 核或胞质呈棕黄色的Ki67或MECA-32的阳性细胞 数,数据以相对阳性细胞百分比表示,即阳性细 胞减少率 =( 实验组-对照组)/ 对照组。 1.8 统计学方法
采用SPSS 17.0进行统计学分析,各组实验数 据均重复3次,以均数±标准差 (x±s) 表示。先作 方差齐性检验,再用t-test进行两个均数之间的比 较。P<0.05为差异具有统计学意义。 2 结果 2.1 TGFBI稳定性表达细胞株的鉴定
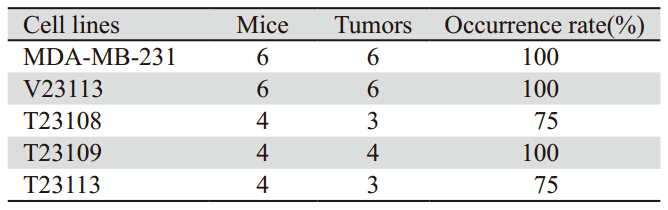
将外源性pRc/CMV2-TGFBI载体转染到 MDAMB-231中,转染细胞株命名为T231,从中挑选 T23108、23109和T23113细胞株用于本研究。实 时定量PCR结果显示,T23108、23109和T23113细 胞株中TGFBI mRNA表达明显高于其母代MDAMB-231细胞,与永生化乳腺上皮细胞MCF-10F中 的表达一致,见图 1A。免疫组织化学结果显示, T23113的细胞质和细胞核中均有TGFBI蛋白的表 达,见图 1B。Western blot结果显示,T23113细胞 培养上清液中TGFBI蛋白也明显高于母代细胞, 见图 1C。以上结果表明,外源性TGFBI转染后得 到了稳定性高表达的乳腺癌细胞株,接近于永生 化乳腺上皮细胞MCF-10F中TGFBI的表达。
 |
A: the fold change of TGFBI mRNA expression level of the
stable transfected cells calculated by 2-∆∆Ct; B: TGFBI protein expression in MDA-MB-231 transfected with TGFBI detected by
immunohistochemical staining (DAB); C: TGFBI protein expression in
MDA-MB-231 transfected with TGFBI detected by Western blot
图1 外源性TGFBI稳定性转染的乳腺癌细胞株中mRNA和蛋白表达
Figure 1 Expression of mRNA and protein in breast cancer cells transfected with ectopic TGFBI |
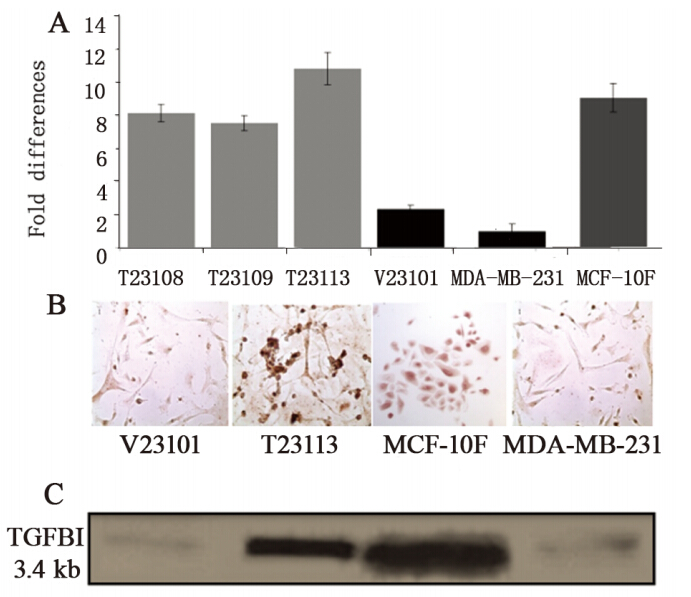
图 2的结果表明,母代MDA-MB-231细胞在 血清刺激后12 h和24 h的增殖率分别为5.02%和 64.44%,而外源性TGFBI表达的T23108、T23109 和T23113细胞在血清刺激后的12 h,细胞几乎没有 增殖,在血清刺激后24 h的平均增殖率为39.62%。 说明外源性TGFBI可以明显地抑制乳腺癌细胞因 血清生长因子刺激的增殖。
 |
Cell proliferation was assessed by CyQUANT NF proliferation
kit at indicated times after serum stimulation. Proliferation rate was expressed as increased percentages = ( fluorescence density at nh – fluorescence density at 0h)/Fluorescence density at 0 h
图2 稳定转染外源性TGFBI与母代乳腺癌细胞株MDAMB-231增殖率比较
Figure 2 Comparison of proliferation rates of parental
ectopic MDA-MB-231 cells and cells transfected with ectopic TGFBI |
与转染空质粒的V 2 3 1 0 1细胞相比,外源 性TGFBI表达的细胞T23113,形成了较少的克 隆(P<0.01),相对软琼脂克隆形成数减少了 90.89%,表明TGFBI显著地抑制了乳腺癌细胞的 锚着独立性生长能力,见图 3。
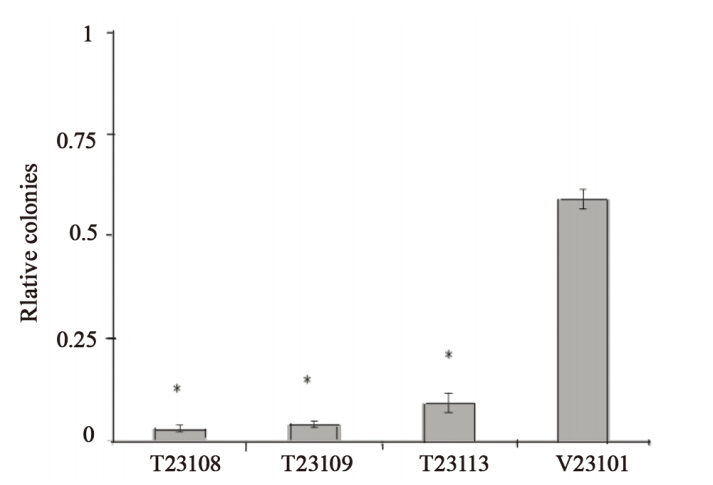 |
Data were expressed as relative colonies = (colonies in TGFBIexpression tumor cells) / (colonies in parental tumor cells), *: P< 0.01,
compared with V23101 transfected with vector control
图3 转染外源性TGFBI与空质粒的乳腺癌细胞株锚定独立性生长能力比较
Figure 3 Comparison of anchorage independent growth of
breast cancer cell lines transfected with ectopic TGFBI and MDA-MB-231 cells |
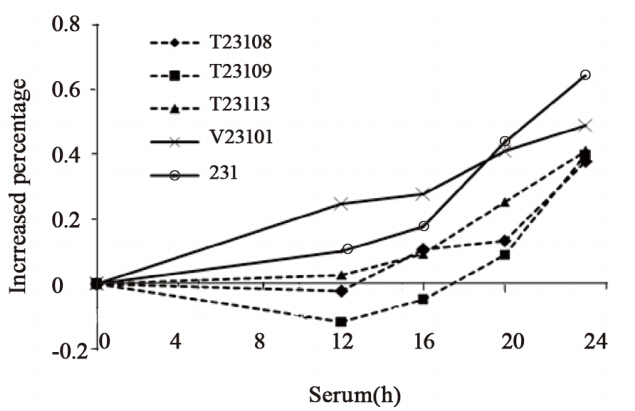
细胞周期同步化后,外源性TGFBI表达和母 代乳腺癌细胞处在G1期的比例分别是68.57%和 64.29%。血清刺激后的不同时间,与母代细胞相 比较,外源性TGFBI表达的细胞处于 G1期的比例 明显增多(P<0.05),而处于S期细胞比例减少, 尤其是在血清刺激后16 h更为明显(P<0.05)。表 明外源性TGFBI使乳腺癌细胞阻滞于G1期,延缓 细胞分裂的进程,结果与2.2对细胞增殖的影响结 果相一致。
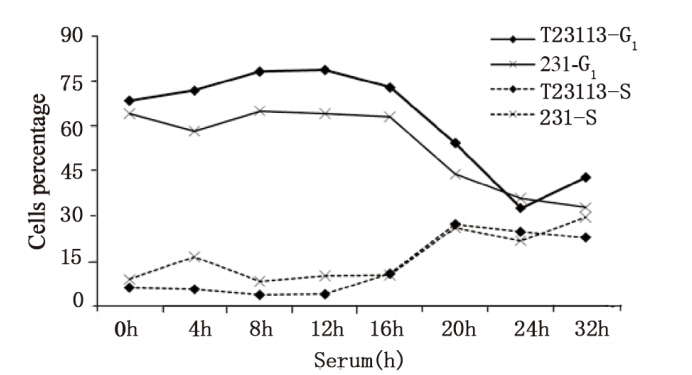 |
Line graph and plot illustrated the distribution of cells in the G1 and S
phases over a time period of 32h
图4 外源性TGFBI对乳腺癌细胞周期的影响
Figure 4 Effects of ectopic TGFBI on cell cycle of breast
cancer cells |
转染空载体的V23101细胞与母代乳腺癌细胞 一样,在血清刺激后12和24 h 时P21和P53表达没 有明显变化,而外源性TGFBI表达的T23113细胞在血清刺激12和24 h时,P21和P53表达明显增多, 见图 5。实验结果提示,TGFBI是通过上调P21和 P53表达延缓乳腺癌细胞进入S期的。
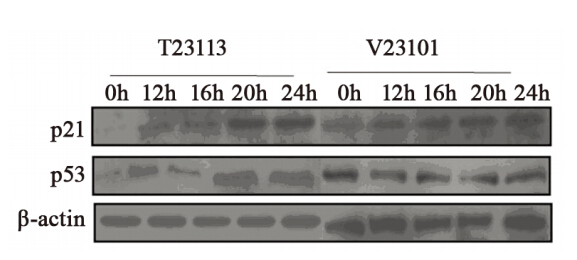 |
图5 外源性TGFBI对乳腺癌细胞P21和P53瞬时表达的影响 Figure 5 Effects of ectopic TGFBI on temporal expressions of breast cancer cells P21 and P53 |
在注射母代乳腺癌细胞后第4周,裸鼠开始出 现肿瘤包块,至第5周时,所有注射母代和空载 体的MDA-MB-231细胞的裸鼠都发现肿瘤,肿瘤 发生率100%;而注射外源性TGFBI表达T23108、 T23109和T23113细胞的裸鼠至第6周时才发现有 肿瘤包块。至注射后第12周时,TGFBI组的肿瘤 发生率为83.33%[(3+4+3)/ (4+4+4)],见表 1。说明 外源性TGFBI表达使裸鼠肿瘤发生潜伏期延长了2 周,发生率也减少了16.7%。
|
|
表 1 转染TGFBI的乳腺癌细胞对裸鼠体内肿瘤发生率的影响 Table 1 Effects of breast cancer cells transfected with ectopic TGFBI on tumor occurrence rate of nude mice in vivo |
Ki67是肿瘤组织中细胞增殖的标志蛋白,可 证明TGFBI对体内肿瘤细胞生长的影响。结果显 示,与对照组相比较,注射T23108、T23109和 T23113细胞后,肿瘤组织中Ki67表达位于细胞核 内,呈棕黄色,见图 6A,阳性细胞的百分比平均 减少了33.84%,见图 6B。说明外源性TGFBI可以 抑制肿瘤组织中细胞的增殖,这与TGFBI抑制乳 腺癌细胞体外生长的结果一致。
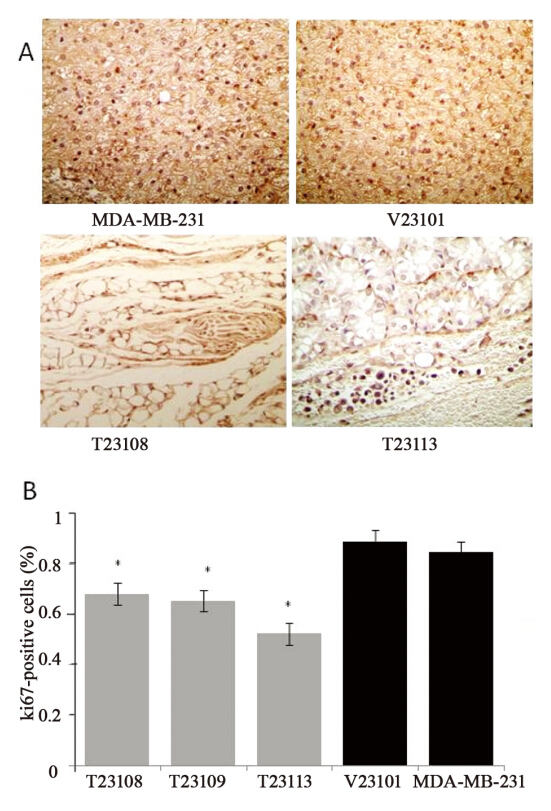 |
A: Immunohistochemical staining of Ki67 protein in nude mice
subcutaneously injected with breast cancer cells transfected with
TGFBI;B: data showed relative percentage of positive cells, *: P<0.01, compared with V23101 cells
图6 外源性TGFBI对裸鼠体内肿瘤组织中Ki67表达的影响
Figure 6 Effects of TGFBI on Ki67 expression in nude
mice tumor tissue in vivo |
TGFBI是TGF-β诱导分泌的一种细胞外分泌蛋 白(ECM),也被称为βig-H3。TGFBI参与多种 生理过程,包括细胞形态、黏附、转移、血管发 生及炎症[9]。小鼠胚胎组织的研究发现[10],胚胎 发育各阶段的许多组织间质都可以检测到TGFBI 的高表达,提示TGFBI对正常组织的发育是不可 缺少的。本研究也发现在永生化的乳腺上皮细胞 MCF-10F中,TGFBI蛋白不仅存在于培养细胞的 上清液中,也存在于细胞质和细胞核中,并且证 实了外源性TGFBI可以在乳腺癌MDA-MB-231细 胞中稳定性表达。Zhao等[4]发现在放射诱导的恶变 BEP2D细胞中TGFBI表达降低,过表达TGFBI后, 肿瘤细胞克隆形成率下降,同时裸鼠成瘤率也下 降,对130例人肺癌组织进行免疫组织化学分析发 现,有45个肺癌组织表现为TGFBI低表达。本研 究体外实验结果表明,外源性TGFBI可能抑制乳 腺癌细胞的增殖,并且显著地抑制了乳腺癌细胞 的锚着独立性生长能力;体内实验结果也发现, 外源性TGFBI可抑制乳腺癌细胞增殖,从而降低 乳腺癌发生率,这与以上研究结果相一致,提示 TGFBI对乳腺癌细胞的生长也存在抑制作用。但 是,TGFBI抑制肿瘤细胞生长的机制尚不明确。 Wen等[11]研究发现,TGFBI可以抑制肺癌和乳腺癌 细胞的体内外增殖,并且发现这种抑制作用与减 少软琼脂克隆形成能力、激活MMP2/9酶的活性, 从而提高细胞外基质穿透能力有关。
本研究结果显示,外源TGFBI能够使乳腺癌细 胞阻滞于G1期,从而减少进入S期的细胞,抑制肿 瘤细胞的增殖。有研究者发现[12],TGFBI缺陷小鼠 胚胎成纤维细胞更易发生染色体畸变,细胞增殖 活性增强,细胞复制过早进入S期,从而增加癌变 几率。这与本研究结论相符。TGFBI是否通过这 一途径调节细胞周期,还需要进一步研究。
细胞周期在G1期停留是为了检查DNA完整 性,主要是P53发挥作用。正常状态下,P53蛋白 含量低,当细胞异常时,p53基因活化,作用于 p21、DNA修复基因及Bax基因。p21基因活化后通 过抑制CDK及参与DNA复制的蛋白质,阻止细胞 进入S期,从而控制细胞增殖。本研究发现外源性 TGFBI可以使乳腺癌细胞P53和P21的瞬时表达增 高,与细胞周期停滞在G1期相一致,说明调控p53 和p21基因是TGFBI影响细胞周期的一个途径。但 精确的分子途径仍需进一步研究。
综上所述,TGFBI可以明显抑制乳腺癌细胞增 殖,作为乳腺癌治疗的肿瘤抑制基因,具有潜在 的应用价值。
| [1] | Chen WQ,Zeng HM,Zheng RS,et al.Cancer incidence and mortality in China,2007[J].Chin J Cancer Res,2012,24 (1):1-8. |
| [2] | Siegel R,Naishadham D,Jemal A.Cancer statistics 2012[J].CA Cancer J Clin,2012,62(1):10-29. |
| [3] | Nam JO,Jeong HW,Lee BH,et al.Regulation of tumor angiogenesis by fastatin,the fourth FAS1 domain of betaig-h3,via alphavbeta3 integrin[J].Cancer Res,2005,65 (10):4153-61. |
| [4] | Zhao YL,Piao CQ,Hei TK.Overexpression of Betaig-h3 gene downregulates integrin alpha5beta1 and suppresses tumorigenicity in radiation-induced tumorigenic human bronchial epithelial cells[J]. Br J Cancer,2002,86 (12): 1923-8. |
| [5] | Zhao YL,Piao CQ,Hei TK.Downregulation of Betaig-h3 gene is causally linked to tumorigenic phenotype in asbestos treated immortalized human bronchial epithelial cells[J]. Oncogene,2002,21 (49):7471-7. |
| [6] | Zhao Y,El-Gabry M,Hei TK.Loss of Betaig-h3 protein is frequent in primary lung carcinoma and related to tumorigenic phenotype in lung cancer cells[J].Mol Carcinog,2006,45(2):84-92. |
| [7] | Ahmed AA,Mills AD,Ibrahim AE,et al.The extracellular matrix protein TGFBI induces microtubule stabilization and sensitizes ovarian cancers to paclitaxel[J].Cancer Cell,2007,12(6):514-27. |
| [8] | CaoYM,Zhang HM,Gao SH,et al.Transforming growth factor-β induced gene inhibits cell proliferation of malignant mesothelioma in vitro[J].Zhong Liu Fang Zhi Yan Jiu,2013,40(12):1123-7.[曹艳 梅,张鹤美,高四海,等.转化生长因子β诱导的基因抑制恶性间皮 瘤细胞增殖的体外研究[J].肿瘤防治研究,2013,40(12):1123-7.] |
| [9] | Thapa N,Lee BH,Kim IS.TGFBIp/betaig- h3 protein: a versatile matrix molecule induced by TGF-beta[J].Int J Biochem Cell Biol,2007,39 (12), 2183-94. |
| [10] | Schorderet DF,Menasche M,Morand S,et al.Genomic characterization and embryonic expression of the mouse Bigh3 (Tgfbi) gene[J]. Biochem Biophys Res Commun,2000,274(2),267-74. |
| [11] | Wen G,Partridge MA,Li B,et al.TGFBI expression reduces in vitro and in vivo metastatic potential of lung and breast tumor cells[J]. Cancer Lett,2011,308(1): 23-32. |
| [12] | Zhang Y,Wen G,Shao G,et al. TGFBI deficiency predisposes mice to spontaneous tumor development[J]. Cancer Res, 2009, 69(1): 37-44. |
 2014, Vol.41
2014, Vol.41