原发性肝癌 (primary liver cancer,PLC )是我 国常见的恶性肿瘤之一,每年的死亡率约为5.4/106 , 是癌症导致死亡的第2位原因[1],预后较差,早期 以手术切除为主,但多数肝癌发现时已失去手术 机会。目前肝癌的局部治疗有多种手段[2, 3],但大 肝癌的治疗仍缺乏有效的治疗模式。迄今为止, 针对中晚期不能手术切除的大肝癌患者,如何选 择较合适的治疗方法,以延长患者的生存期,提 高患者的生活质量,成为临床工作者共同关注 的课题。近年来,我院采用微波消融(microwaveablation,MWA)联合立体定向放疗(stereotactic body radiation therapy,SBRT)治疗介入后原发和复发性 大肝癌,取得了较为满意的临床疗效,现将资料 分析如下。 1 资料与方法 1.1 临床资料
2008年1月至2012年1月,我院收治的106例介 入治疗后不能手术或不愿手术的原发性或复发性 大肝癌患者。57例患者经肝脏穿刺细胞病理学检 查明确诊断,其余患者根据具有肝硬化以及HBV 和(或)HCV感染(HBV和/或HCV抗原阳性)的 证据,血清AFP≥400 μg/L持续1月或≥200 μg/L 持续2月、并能排除其他原因引起的AFP升高,CT 和(或)MRI影像学检查有肝癌特征的占位性病 变确诊。肿瘤直径6~11 cm,病变1~3个。病例选 择条件:(1)诊断明确;(2)无明显肝硬化表现 及严重的肝功能损害、KPS(Karnofsky perfomance status)评分≥70分。根据Child-Pugh肝功能分级、A 级88例,B级18例;(3) 无门脉癌栓和腹水。根据 治疗方案将106例患者分为两组:OG组与CG组。 1.2 治疗方法 1.2.1 放疗技术及步骤
OG组所有病例先行立体 定向放疗(适形调强) ,放疗后采用微波消融治疗。 CG组仅行立体定向放疗(适形调强) 。放疗及微波 消融期间给予护胃、护肝等对症支持治疗。放疗 设备采用瑞典医柯达公司生产的医用电子直线加 速器 。CT定位及治疗前准备:采用真空垫或体模 固定,制作放疗体位固定装置。放疗中采用主动 呼吸控制(active breathing control,ABC)技术 。选用 64排CT扫描采图。CT扫描图像输送到治疗计划系 统 ,由医师和物理师共同勾画靶区和危及器官 。 结合CT 、MRI 、彩超等资料 ,勾画大体肿瘤体积 (gross target volume,GTV ),GTV外放后为计划靶 区(planning target volume,PTV),上下、前后、左 右分别外放2、1、l cm,避开重要器官(十二指肠、 胃、胰腺、肾脏、脊髓等)。单次处方剂量为2.5~ 3.0 Gy,5次/周,总剂量39~55 Gy ,共13~27次。通 过剂量体积直方图(dose volume histogram,DVH) 及周围敏感器官进行剂量评估。限定肝脏平均剂量 <20 Gy,肝脏V30<30%,小肠最大剂量<45 Gy,胃 最大剂量<45 Gy,30%双侧肾脏的体积接受的照射 剂量≤20 Gy,脊髓最大剂量<40 Gy。 1.2.2 微波消融治疗
患者取仰卧位,行64排CT 扫描,找到患者肝脏上最大病灶所对应的CT层 面,置定位专用线板于患者肝脏前方皮肤处,激 光灯协助定位,于专用线板与激光灯相交处画两 个标记点,常规消毒铺巾,标记点处利多卡因局部浸润麻醉,麻醉满意后,于标记点处置入微波 消融刀1~2枚,CT扫描确认微波消融刀在肝脏内病 灶位置满意,连接好微波消融系统,按计划设置 微波刀功率为55~60W,治疗时间为20~25min,按计 划给予微波消融治疗。微波治疗结束后再次行CT 扫描,见胸腔无血气胸,腹腔未见明显异常。 1.3 随访及观察指标
OG组及CG组治疗前及治疗后查血常规、肿瘤 标志物、肝肾功能电解质、CT 、MRI 、彩超等评 价疗效及不良反应,治疗期间每周查血常规1 次, 以后每隔2~3月复查AFP、肝脏CT 或 MRI 。比较 两组患者的生活质量改善情况、血清AFP变化、不 良反应情况、近期疗效及生存率。依据世界卫生 组织 (WHO)规定的实体瘤近期疗效评价标准评定 疗效。治疗后3~6月行增强CT进行近期疗效判定: 肿瘤完全消失为完全缓解 (CR) ;肿瘤最大直径乘 积缩小>50%为部分缓解 (PR);缩小<50%或增大 <25%为无变化(NC);病变增大 >25%或出现新的 病灶为进展(PD)。远期疗效判定为 6月及1年生存 率。治疗后1年内每1~2月随访1次,第二年3 月以 上随访1次,随访以CT扫描为基础,随访时间为 6~36 月。不良反应按WHO标准评价。 1.4 统计学方法
采用 SPSS 13.0 软件进行分析,计量资料采用 t检验,计数资料比较采用χ2检验。P<0.05为差异有 统计学意义。 2 结果
最后随访时间截至2013年3月,随访时间3~42 月,中位随访期12月,平均 13.1月,4例完全失访, 1例中途失访(失访按死亡计算),随访率 95.28%。 2.1 生活质量改善情况
OG组:治疗后4月内,53例有上腹部不适 症状的患者中30例有不同程度改善,有效率 56.60%;53例患者中腹水改善率为60.00%;53 例患者中黄疸改善率为64.71%。CG组:治疗后 4月内,53例有上腹部不适症状的患者中28 例症 状有不同程度改善,有效率52.83%;53例患者中 腹水改善率为51.72%;53例患者中黄疸改善率为 56.25%,见表 1。
|
|
表 1 OG组和CG组放疗前后生活质量改善和血清AFP变化 Table 1 Improvement of life quality and AFP change of OG and CG group before and after treatment |
OG组:治疗后1~3 个月复查血清 AFP,53 例 AFP 阳性患者中19例恢复正常,其余均有不 同程度降低,治疗前后分别为 (697.97±173.81) mmol/L 和 (109.75±89.29 ) mmol/L,治疗前后差 值平均为(568.72±108.37)mmol/L 。CG组:治 疗后1~3月复查血清AFP,53例AFP阳性患者中 17例恢复正常,其余均有不同程度降低,治疗前后分别为 (693.99 ±169.38 ) mmol/L 和(115.13 ± 81.72 ) mmol/L,治疗前后差值平均为(552.58 ± 101.25) mmol/L 。两组AFP下降差异无统计学意义 (P>0.05),见表 1。 2.3 两组患者治疗的不良反应情况
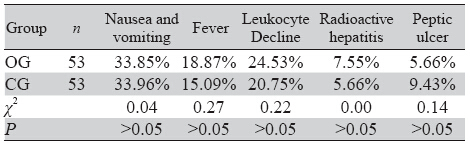
OG组及CG组治疗期间出现恶心、呕吐发生 率分别为35.85%(19/53)、33.96%(18/53);OG组及 CG组治疗期间出现发热(温度均在38℃以下)的例 数分别为10例与8例,经对症治疗后发热均可缓 解。OG组及CG组治疗期间出现1~2 级白细胞下降 的例数分别为13例与11例。治疗后1~4月,OG组4 例出现放射性肝炎、3例出现消化道溃疡,CG组3 例出现放射性肝炎、5例出现消化道溃疡,经治疗 后均得以控制,见表 2。
|
|
表 2 OG组和CG组患者治疗前后的不良反应情况 Table 2 Adverse reactions of OG and CG group during and after treatment |
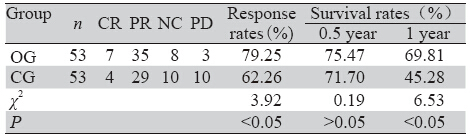
治疗后2~3月复查CT或MRI评价肿瘤局部控制情 况,OG组及CG组缓解率(CR + PR)分别为79.25%与 62.26%,差异有统计学意义,(P<0.05)。OG组6月生 存率高于CG组,差异无统计学意义;OG组1年生存率 高于CG组,差异有统计学意义(P<0.05),见表 3。
|
|
表 3 OG组和CG组近期疗效及生存率 Table 3 Short-term curative effects and survival rates of OG and CG group |
国内外文献将肝癌肿瘤直径大于5cm者定义为大肝癌,临床确诊的PLC患者约75%为大肝癌,并 且多合并有不同程度的肝硬化,对不能手术切除 的这类患者的治疗十分困难,预后极差。对于不 能手术切除或患者不愿手术切除的大肝癌患者, 肿瘤临床工作者一直在积极探索综合治疗模式, 以延长患者的生存期,提高患者的生活质量。
肝动脉栓塞化疗(hepatic artery embolism chemotherapy,TACE)是治疗中晚期原发性肝癌 的首选疗法之一,肝功能较好(Child A 和 B 级)和 门静脉主干无癌栓而不能切除肝癌病例,TACE是 标准的姑息性治疗手段[4]。由于肝脏肿瘤 80%的 血供来源于肝动脉,导致仍有一部分肿瘤细胞残 存,另外有些乏血供、碘油沉积不佳的病灶,在 TACE 后残存的肿瘤细胞易再次复发,仅第一及第 二次TACE对破坏肿瘤血供疗效较佳[5]。单纯依靠 TACE反复治疗中晚期原发性肝癌不仅达不到理想 治疗效果,而且还易对正常肝组织造成损害,进一 步导致肝功能障碍,直接影响患者生存率,因而必 需配合其他有效而不良反应较小的治疗方法。
人们曾认为肝脏组织对放射耐受性差,肝脏一 直被列为不宜放疗器官。后来人们发现:肝癌不是 放射抗拒,而是放射敏感的肿瘤,肝癌是开展三维 适形放疗(three-dimensional conformal radiotherapy, 3DCRT)的理想器官,它能更好地兼顾肿瘤控制 概率(tumor control probability,TCP) 和正常组织并 发症发生率(normal tissue complication probability, NTCP) 。近年来三维适形放疗应用于治疗肝癌的报 道逐渐增多,且取得了较好的近期疗效[6, 7] 。张耀伟 等[8]采用Meta分析方法,对国内外公开发表的有关 3-DCRT联合TACE治疗肝癌与单纯TACE治疗肝癌 的临床随机对照试验观察随访研究文献进行综合分 析,结果显示,3-DCRT联合TACE 组的1、2 年生存 率与单纯TACE 组相比有统计学差异 (P<0.01),证 明3-DCRT联合TACE治疗肝癌的远期疗效优于单 纯 TACE。立体定向放射治疗作为3DCRT 的特殊类 型,是精确的3DCRT,能达到较高的局部照射剂量 和较低的NTCP。 立体定向放射治疗能直接杀灭肿 瘤而正常组织损伤不大,其肿瘤局部控制的有效率 可达40%~90%,中位存活时间为10~25月。
肝脏全肝耐受剂量<30 Gy,而肝癌致死剂量 为40~70 Gy,且放射诱导的肝病(radiation induced liver disease,RILD)几乎是一个致死性的并发症,无 有效治疗方法。梁世雄等[9]报道在三维适形放疗肝 癌中,肝硬化Child.Pugh分级是影响RILD的主要 因素,另外,正常肝脏受照的平均剂量(mean dose to normal liver,MDTNL )和体积亦与RILD有关系。
对于不能手术切除或患者不愿手术切除的大 肝癌患者,先给予介入治疗,注入碘化油,使肿瘤缩小,减少了正常肝的照射剂量,使靶区显示 更精确,本研究采用主动呼吸控制(active breathing control,ABC) 放疗技术,GTV在脚侧方向外放 0.5~1.0 cm,在头侧方向外放1.0~2.0 cm ,其余 方向外放0.5~1.0 cm 。按照此种方式外放的 PTV 体积明显小于按照传统方式(GTV上下均匀外放 1.0~2.0 cm)的体积。基本原则保持:以共面放射 野为主,或加非共面野,共设置2~6个放射野,射 野通过肝脏的路径尽量短,并尽可能保护一部分 正常肝脏不受任何放射剂量或较低剂量的照射,避 免产生明显的放射性肝损伤。综合上述措施,大 大地降低了MDTNL,大多数病例的MDTNL<10 Gy,少数大体积的病例,MDTNL也可以控制在20 Gy以内。研究中OG组和CG组相比,RILD发生率 差异无统计学意义。
微波消融(microwave ablation,MWA)是一种 安全可靠的局部肝癌治疗方法,对直径<5.0 cm肝 癌的疗效已得到充分肯定。而文献报道单纯微波 消融治疗大肝癌肿瘤易残留和复发率较高,直径 >5 cm肝癌肿瘤完全坏死率仅为24%~41%,肿瘤局 部复发率为36.6%~47.8%,表明单纯MWA治疗大 肝癌疗效很不理想。并且目前国内外CT或B型超 声引导下开展的肝癌消融治疗大都只能提供一个 点或一个面的位置关系,不能反映消融电极的立 体消融体积与肿瘤体积一致性,较易出现毁损体 积过大或遗漏,这是引起MWA治疗效果欠佳的原 因之一。MWA、TACE和放疗的综合治疗模式可 能达到相加或协同的作用[10, 11]。
我们研究的两组患者治疗前后生活质量改善 及血清AFP差值比较差异无统计学意义,考虑可能 与观察时间较短及病例数较少有关,需延长观察 时间,扩大病例数进一步研究;两组患者治疗期 间及治疗后的恶心呕吐、发热、白细胞下降发生 率、放射性肝炎及消化道溃疡的发生率比较差异 无统计学意义,考虑可能与研究的病例数不足有 关,需扩大病例数进一步研究;两组患者的缓解 率及一年生存率比较差异有统计学意义,OG组近 期疗效和一年生存率均好于CG组。OG组与CG组 相比,未见增加不良反应,患者耐受性较好。
综上所述,虽然肝动脉栓塞化疗、立体定向 放疗(适形调强放疗)、微波消融治疗肝癌都有 一定的效果,但均有不同程度的局限性。故对于 肝动脉栓塞化疗(介入)后的患者,很有必要将 立体定向放疗(适形调强放疗)与微波消融联合 应用,微波消融对于立体定向放疗(适形调强放疗)后肿瘤残存有较强的杀伤作用。因此,我们 选取肝癌介入治疗后的患者,采用立体定向放疗 (适形调强放疗)和微波消融联合应用可极大提 高毁损肿瘤组织的效应,联合立体定向放疗(适 形调强放疗)和微波消融两种治疗方法理论上均 有可能发生各自的并发症,但由于两种治疗方式 与原理不同,并发症不会叠加发生。
| [1] | Yu ZH. Primary liver cancer[M]//Ying WB, Yu ZH,Xu GZ,et al.Radiation oncology.Beijing:China Union Medical University Press,2008:829-35. [余子豪.原发性肝癌[M]//殷蔚伯,余子豪, 徐国镇,等.肿瘤放射治疗学.北京:中国协和医科大学出版 社,2008:829-35.] |
| [2] | Livraghi T,M?kisalo H,Line PD. Treatment options in hepatocellular carcinoma today[J].Scand J Surg,2011,100(1): 22-9. |
| [3] | Leneioni R,Chen XP,Dagher L,et al.Treatment of intermediate/ advanced hepatocellular carcinoma in the clinic:how can outcomes be improved? [J].Oncologist,2010,15 Suppl 4:42-52. |
| [4] | Chinese Society of Liver Cancer, Chinese Society of Clinical Oncology,Chinese Society of Hepatology Liver Cancer Group. Expert consensus on standardization of the management of primary liver cancer[J].Zhong Liu,2009,29(4):295-304.[中国抗 癌协会肝癌专业委员会, 中国抗癌协会临床肿瘤学协作专业委 员会,中华医学会肝病学分会肝癌学组.原发性肝癌规范化诊治 的专家共识[J].肿瘤,2009,29(4):295-304.] |
| [5] | Gao F,Gu YK,Fan WJ,et al.Evaluation of transarterial chemoembolization combined with percutaneous ethanol ablation for large hepatocellular carcinoma[J].World J Gastroenterol.2011,17 (26):3145-50. |
| [6] | Feng M,Ben-Josef E.Radiation therapy for hepatocellular carcinoma [J].Semin Radiat Oncol,2011,21(4):271-7. |
| [7] | Hoffe SE,Finkelstein SE,Russell MS,et al.Nonsurgical options for hepatocellular carcinoma:evolving role of external beam radiotherapy [J].Cancer Control,2010,17(2):100-10. |
| [8] | Zhang YW, Zhang Y,Ling ZH,et al. Meta analysis of curative effect of liver cancer with three dimensional conformal radiotherapy combined with TACE and TACE Alone[J]. Nan Fang Yi Ke Da Xue Xue Bao,2009,29(12):2514-6.[张耀伟,张勇,凌 志海,等.三维适形放疗联合TACE与单纯TACE治疗肝癌疗效的 meta分析[J]. 南方医科大学学报, 2009,29 (12):2 514-6.] |
| [9] | Liang SX, Jiang GL, Zhu XD, et al. Radiation-induced liver disease: risk factors and liver irradiation tolerance[J].Ai Zheng Jin Zhan,2006,4(4):308-13.[梁世雄,蒋国梁,朱小东,等.放 射性肝病影响因素及肝脏放射耐受剂量的研究[J].癌症进 展,2006,4(4):308-13.] |
| [10] | Webb H,Lubner MG,Hinshaw JL.Thermal ablation[J].Semin Roentgenol,2011,46(2):133-41. |
| [11] | Bhardwaj N,Dormer J,Ahmad F,et al.Microwave ablation of the liver: a description of lesion evolution over time and an investigation of the heat sink effect[J].Pathology,2011,43(7):725-31. |
 2014, Vol.41
2014, Vol.41