2.海南医学院热带与检验学院
2.School of Tropical and laboratory of Hainan Medical University
0 引言
肺癌已成为当今世界上对人类健康与生命危 害最大的恶性肿瘤之一。每年全世界有超过100 万人死于肺癌[1]。肺癌发病率及死亡率随年龄增 长而上升,40岁以后发病率明显上升,到75岁达 到高峰。其中非小细胞肺癌(NSCLC)约占肺癌 的80%,2/3以上NSCLC患者确诊时属于晚期。以 含铂为主的联合化疗方案是治疗非小细胞肺癌的 重要手段,化疗后的维持治疗能进一步延长生存 期,提高生活质量[2, 3]。我们通过采用自体DC-CIK 联合厄洛替尼维持治疗老年晚期非小细胞肺癌, 疗效较好,现报告如下。 1 资料与方法 1.1 临床资料
收集我院自2012年1月至2013年2月经病理或 细胞学检查确诊的Ⅲb、Ⅳ期老年非小细胞肺癌 患者42例,其中男24例,女18例;中位年龄73岁 (65~85岁);Karnofsky评分≥60分;预计生 存期>3月;治疗前心、肝、肾功能及血常规大致 正常。所有患者治疗前均通过医院伦理委员会批 准,并签署治疗知情同意书。至少有一个客观可 测量的肿瘤病灶(如CT可测量病灶≥1.0 cm), 42例患者随机分为联合组(厄洛替尼+DC-CIK) 和单药组(厄洛替尼)各21例。所有病例均经4周期 含铂为基础的两药联合化疗,疾病达到稳定或以 上。两组性别、年龄、病理类型、临床分期等方 面差异无统计学意义。 1.2 方法 1.2.1 仪器与主要试剂
Formal205型生物安全柜 由苏净安泰公司提供;Forma311型CO2培养箱购 自Sanyo(三洋)公司;CS-3000PLUS血细胞分 离仪购自日本Sysmex公司;无血清培养液(Ⅰ、 Ⅱ、Ⅲ)由美国Gibco公司提供。注射用重组人粒细 胞巨噬细胞刺激因子(GMCSF)购自厦门特宝生物 工程股份有限公司,白细胞介素4(IL-4)购自美国 Peprotech公司,注射用重组人干扰素-γ(IFN-γ)购自 上海凯茂生物医药有限公司,重组人白介素-1注 射液(rhIL-1)、重组人白介素-2注射液(rhIL-2)、重 组人白介素-4(rhIL-4)注射液购自北京四环生物制 药有限公司,Q007培养液购自宝日医生物技术(北 京)有限公司。 1.2.2 DC-CIK细胞的制备及回输
化疗结束后14 d采集患者静脉血约60 ml,用Ficoll分离并收集 单个核细胞,经淋巴细胞分离液梯度离心(2000 r/min×20 min),取白膜层的单个核细胞,0.9%氯 化钠溶液洗涤3次,将细胞按5×106/ml用培养液接 种至T25培养瓶中,将培养瓶置于37℃、5%CO2 中培养3 h左右,将培养瓶轻摇几下,取上清于 新的50 ml离心管中,测细胞密度,1 200 r/min 离心10 min弃上清液,将细胞沉淀用培养液Ⅰ (DMEM+1%干扰素+1%CD3)重悬,按照3× 106接种至T75培养瓶中(第0天),将10 ml新的 Q007培养液加入原T25培养瓶中,按照1%的比例 加入因子Ⅳ(IL-4)和因子V(GM-CSF)(第0 天),分离出DC、CIK细胞。DC细胞培养:每 天按照0.5%的因子Ⅳ和1%的因子Ⅴ的比例添加, 第7天时,按照1%的比例添加因子Ⅳ/Ⅴ和肿瘤相 关抗原,第8天时,添加1%的因子Ⅳ和Ⅴ,第9天 时,细胞成熟,将DC细胞冲洗后装于50ml离心管 中,1 200 r/min离心10 min,弃上清液,沉淀用 培养液Ⅲ重悬,加入CIK细胞中共培养。CIK细胞 培养:24 h后加入10 ml培养液Ⅱ(DMEM+2%IL- 1+1%IL-2),添加量根据细胞密度(第1天), 24 h后加入10~20 ml培养液Ⅲ,添加量根据细胞密 度,同时按照10%的浓度添加灭活的自体血清(第 1天),此后,显微镜下观察细胞,根据密度添加 适量的培养液Ⅲ(DMEM +1%IL-2)和10%的自 体血清,分瓶或装袋培养。细胞收集:DC-CIK共 培养15天左右,如果达到标准(回输的细胞总数 每次达到1×109以上;淋巴细胞达到90%以上;活 细胞比例:培养细胞中活细胞所占比例达到95% 以上);即可收集细胞用于回输。将培养袋中的 细胞倒于50 ml离心管中,1 200 r/min离心10 min, 弃上清液,将细胞沉淀用0.9%氯化钠溶液重悬收 集平分于2个空白管中,1 200 r/min离心10 min, 重复2次,弃上清液,加入1%~2%的白蛋白,用 50 ml 0.9%氯化钠溶液重悬装袋。连续输注4次 为一个疗程,每位患者输注1~6疗程。 1.2.3 治疗方法
单药组:化疗结束后14 d开始口服厄洛替尼 150 mg/d,1月复查评估1次。联合组:化疗结束 后14 d采集患者外周血,采集后经实验室培养2周 左右,达到标准进行回输,每隔1月重复治疗1周 期。采血后第二天开始口服厄洛替尼150 mg/d治 疗,直至病情进展。 1.3 评价标准
主要终点评价指标为无肿瘤进展生存时间 (PFS),是指从随机分组之日起,诱导治疗完 成后直至疾病出现进展或任何原因导致死亡。 次要终点评价指标为近期疗效。评价指标参照 WHO实体瘤疗效评定标准进行评价,分为完全 缓解(complete remission,CR)、部分缓解(partial remission,PR)、好转(mend remission,MR)、稳 定(stable disease,SD)、进展(progress disease, PD)。短期有效率=CR+PR+MR。疾病控制率 =CR+PR+MR+SD。接受治疗后第4周、第8周评价 近期疗效。随访时间为2~13月,中位随访时间为8 月,随访截止时间为2013年3月20日,所有患者均 完成治疗,接受治疗后每月随访1次,联合组均完 成至少一周期DC/CIK生物免疫治疗。 1.4 生活质量
用Karnofsky评分评估生活质量的改善,生活 质量等级提高即认为改善 1.5 统计学方法
采用SPSS 16.0统计软件进行统计分析,均数 比较采用t检验;组间无肿瘤进展时间PFS比较采 用Kapplan-Meier分析;率的比较用χ2检验。P<0.05 为差异有统计学意义。 2 结果 2.1 两组患者无疾病进展生存期
截止最后随访时间,联合组和单药组PFS分别 为5.23月和3.57月,联合组的PFS延长了1.66月,两 组间差异有统计学意义(P=0.017),见图 1。
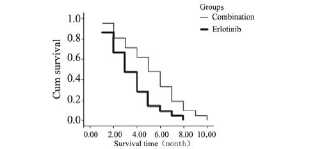 |
图 1两组老年晚期非小细胞肺癌患者短期疗效比较 Figure 1Comparison of short-term effects of combination therapy and erlotinib therapy groups |
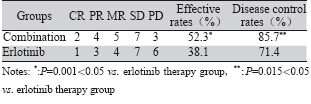
联合组及单药组有效率分别为52.3%、38.1% (χ2=10.909,P=0.001),疾病控制率分别为 85.7%、71.4%(χ2=8.75,P=0.015)差异有统计学 意义,见表 1
|
|
表 1 两组老年晚期非小细胞肺癌患者短期疗效比较 Table 1Comparison of short-term effects of combination therapy and erlotinib therapy groups |
两组治疗后Karnofsky评分较治疗前提高0~20 分,与治疗前相比差异有统计学意义(P=0.001, P=0.008)。两组间治疗前Karnofsky评分相比差异 无统计学意义(t=1.045,P=0.302),两组治疗后 Karnofsky评分相比差异有统计学意义(t=2.209, P=0.033),见表 2,联合组生活质量的改善更为显 著。
|
|
表 2 两组老年晚期非小细胞肺癌治疗前后KPS评分变化(x±s) Table 2KPS comparison of elderly patients with advanced non-small cell lung cancer combination therapy and erlotinib therapy groups pre- and post-therapy(x±s) |
联合组与单药组主要不良反应是皮疹及腹 泻,均能耐受,联合组发生率分别为67%、24%。 单药组发生率分别为71%和33%。联合组2例患 者在DC/CIK输注后出现一过性发热,2例出现乏 力,未行特殊处理自行缓解。绝大多数患者耐受 较好,无其他严重不良反应。治疗前后血常规、 肝肾功能检测均无明显改变。 3 讨论
2009年的ASCO会议公布了力比泰(注射用培 美曲塞二钠)在663例受试者应用的临床试验结果, 该试验证实力比泰作为维持治疗时,可使患者的 总生存期延长,在非鳞癌受试者中,力比泰受试 组平均生存期可达l5.5月,而安慰剂对照组为10.3 月。老年患者的骨髓储备功能降低,整体化疗耐 受性差,因此选择对骨髓影响较小的生物免疫或 靶向药物维持治疗值得进一步探讨。
CIK细胞是将患者外周血单个核细胞分离后, 在体外经γ-干扰素、CD3单抗和白介素-2等细胞 因子刺激后获得的一群异质性细胞,具有增殖速度 快、杀瘤谱广、杀瘤活性高、非MHC限制、对骨 髓造血功能影响轻微等优势[4]。在临床疾病缓解期 应用可以达到消除微小残留病灶、减少或防止复 发的目的[5]。有研究表明DC与CIK具有协同作用, 共同孵育后DC细胞共刺激分子的表达及抗原递呈 能力均可提高,且CIK的杀伤活性也进一步增强[6]。
厄洛替尼是一种表皮生长因子受体酪氨酸激 酶拮抗剂,其通过阻断非小细胞肺癌细胞生存及 增殖中的某些信号转导通路而发挥抗肿瘤作用。 时圣彬等[7]将56例经含铂方案化疗4个周期后, 达到稳定或以上的患者随机分为厄洛替尼组和安 慰剂组,结果显示厄洛替尼组的PFS较安慰剂组 显著延长,分别为5.30月和4.42月(P<0.05)。 Cappuzzo等[8]研究结果亦得到了相似的结论。本 研究显示两组的PFS分别为:单药组3.57月,联合 组5.23月,较单药组延长了1.66月(P=0.017)。 与之前研究结果一致。联合组及单药组有效 率分别为52.3%、38.1%,差异有统计学意义 (χ2=10.909,P=0.001),两组疾病控制率分别 为85.7%、71.4%,差异有统计学意义(χ2=8.75, P=0.015),见表 1。联合组较单药组显示了更好 的疗效。可能的机制是DC/CIK生物免疫治疗在厄 洛替尼维持治疗的基础上可进一步延长患者的PFS (P<0.05)及近期有效率。DC/CIK可释放炎性细 胞因子,如IL-2、TNF、IFN-γ、GM-CSF等,不仅 对肿瘤细胞有直接抑制作用,还可通过调节免疫 系统间接杀伤肿瘤细胞,降低肿瘤的复发和转移 [9]。国内外的临床研究表明,一般在放疗、化疗后 间隔2~4周,在机体免疫力有所恢复时,输入CIK 细胞,可提高肿瘤患者的缓解率,并在清除微小 残留病灶方面发挥重要作用[10]。
本研究中两组KPS均有不同程度提高,与治 疗前相比差异有统计学意义(P值分别为0.001、 0.008)。两组间治疗前Karnofsky评分差异无统计 学意义(t=1.045,P=0.302),但治疗后Karnofsky 评分差异有统计学意义(t=2.209,P=0.033),这 说明联合组的KPS升高更为显著,也就是说治疗后 联合组生活质量优于单药组。可能的机制是生物 免疫治疗直接或间接调控着宿主和肿瘤之间的相 互作用,对延长肿瘤患者生存和提高生活质量是 一种很好的选择[11]。
因此,自体DC/CIK联合厄洛替尼维持治疗老 年晚期非小细胞肺癌,能提高患者短期疗效及延 长无肿瘤进展时间,改善患者生存质量,具有潜 在的临床应用价值。但本研究病例数较少,随访 时间短,安全性等更多的证据还需扩大病例进一 步证实。
| [1] | Pao W, Girard N. New driver mutations in non-small-cell lung cancer[J]. Lancet Oncol,2011,12(2):175-80. |
| [2] | Paz-Ares LG,de Marinis F, Dediu M,et al.PARAMOUNT: Final overall survival results of the phase III study of maintenance pemetrexed versus placebo immediately after induction treatment with pemetrexed plus cisplatin for advanced nonsquamous nonsmall- cell lung cancer[J]. J Clin Oncol,2013,31(23);2895-902. |
| [3] | Han BL.Review 2009:Advances in medical treatment of lung cancer[J].Zhongguo Chu Fang Yao,2010,96(3):40-2.[ 韩 宝惠.回顾2009年: 肺癌内科治疗进展[ J ] .中国处方药, 2010,96(3):40-2.] |
| [4] | Introna M, Borleri G, Conti E,et al. Repeated infusions of donorderived cytokine-induced killer cells in patients relapsing after allogeneic stem cell transplantation: a phase I study[J]. Haematologica,2007, 92(7):952-9. |
| [5] | Li H, Wang C, Yu J, et al. Dendritic cell-activated cytokine-induced killer cells enhance the anti-tumor effect of chemotherapy on nonsmall cell lung cancer in patients after surgery[J].Cytotherapy,200 9,11(8):1076-83. |
| [6] | Sumpter K, Harper-Wynne C, Cunningham D, et al. Report of two protocol planned interim analyses in a randomised multicentre phase III study comparing capecitabine with fluorouracil and oxaliplatin with cisplatin in patients with advanced oesophagogastric cancer receiving ECF[J]. Br J Cancer,2005, 92 (11):1976-83. |
| [7] | Shi SB, Li CH, Tang XY, et al. The effects of maintenance therapy combining DC/CIK and erlotinib on patients with advanced non-small cell lung cancer[J]. Zhongguo Zhong Liu Lin Chuang,2012,39(3):160-2.[时圣彬,李春华,唐晓勇,等.厄洛替 尼联合DC/CIK在晚期非小细胞肺癌维持治疗中的作用[J].中国 肿瘤临床,2012,39(3):160-2.] |
| [8] | Cappuzzo F, Ciuleanu T, Stelmakh L, et al. Erlotinib as maintenance treatment in advanced non-small-cell lung cancer: a multicentre, randomised,placebo- controlled phase 3 study[J]. Lancet Oncol, 2010,11(6):521-9. |
| [9] | Chen FX, Liu JQ, Zhang NZ, et a1.Clinical observation on adoptive immunotherapy with autologous cytokine induced killer cells for advanced malignant tumor[J]. Ai Zheng,2002,21(7):797-801.[陈复兴,刘军权,张南征,等.自身细 胞因子诱导的杀伤细胞过继性免疫治疗恶性肿瘤的临床观察[J].癌症,2002,21(7):797-801.] |
| [10] | Sangiolo D, Martinuzzi E, Todorovic M, et al. Alloreactivity and anti-tumor activity segregate within two distinct subsets of cytokine-induced killer(CIK) cells: implications for their infusion across major HLA barriers[J]. Int Immunol,2008, 20(7):841-8. |
| [11] | Oosterwijk E, Divgi C, Bander NH. Active and passive immunotherapy:vaccines and antibodies[J].BJU Int,2007,99 (5 Pt B):1301-4. |
 2014, Vol.41
2014, Vol.41