肺癌是许多国家发病率最高的恶性肿瘤之一, 非小细胞肺癌(NSCLC)占肺癌的80%,大多数就 诊时已属晚期(ⅢB~Ⅳ期),且50%确诊时年龄超 过65岁,是一种病死率很高的恶性肿瘤[1]。如何适 当而有效地治疗老年晚期非小细胞肺癌是目前临床 医生所面临的比较棘手的问题。本文对我科近3年 多收治的89例老年晚期肺腺癌患者进行回顾性分 析,观察比较多西他赛与培美曲塞单药一线治疗老 年晚期肺腺癌的疗效及不良反应,现报告如下。 1 资料与方法 1.1 临床资料
回顾性分析广州军区广州总医院肿瘤科从2008 年9月至2012年3月收治的年龄≥65岁的89例老年 肺腺癌患者(ⅢB~Ⅳ期),所有患者均有完整的临 床和随访资料。入组病例均有病理或细胞学检查 确诊为肺腺癌,体力状况评分 (ECOG performance status) 均≤2分,治疗前血常规、心肝肾功能无化疗 禁忌,有可测量的临床观察病灶。具体资料见表 1。 目前>60岁以上的患者一般建议单放或单化。31例 ⅢB期肺腺癌患者中,有7例接受了三维适形放疗; 4例因肺不张接受了姑息放疗以缓解症状,因例数 较少,且放疗剂量不同,后续二线三线治疗方案也 相对不统一,未进一步分层比较。
|
|
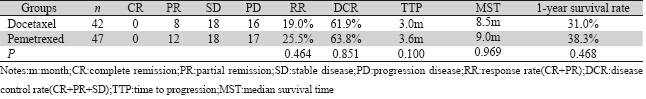
表 1 两组肺腺癌患者疗效比较 Table 1 Comparison of the clinical effi cacy between the two groups of lung adenocarcinoma patients |
多西他赛单药化疗方案:多西他赛(江苏恒瑞制 药股份有限公司生产)单药75 mg/ m2,第1天,21天 1周期;多西他赛用药前1天开始口服地塞米松7.5 mg,2次/日,口服3天。培美曲塞单药化疗方案:培 美曲塞(江苏豪森药业股份有限公司生产)单药500 mg/m2,第1天,21天1周期;培美曲塞用药前7天开 始口服叶酸片400 μg,1次/日,至少5天,一直服用 整个治疗周期,在最后1次给药后21天可停服;维生 素B12 1 000 μg在培美曲塞给药前7天内肌肉注射一 次,以后每3周期肌肉注射一次。 分析的89例患者, 其中多西他赛单药组42例,平均每例接受3.3周期化 疗;培美曲塞单药组47例,平均每例接受3.6周期化 疗,两组比较差异无统计学意义(P>0.05)。 1.3 标准评价
患者至少完成2周期化疗,方可评价临床疗效和 不良反应。疗效评价根据RECIST1.1实体瘤疗效评 价标准,分为完全缓解(complete remission,CR)、 部分缓解(partial remission,PR)、稳定(stable disease,SD)和进展(progression disease,PD)。 CR+PR为有效率(RR),以CR+PR+SD为疾病控制 率(DCR)。疾病进展时间(TTP)为患者从治疗之 日起至疾病进展时间。不良反应按美国国立癌症研 究所常见毒性分级标准评价(NCI CTC3.0),Ⅲ~Ⅳ 级毒性反应为重度反应。 1.4 统计学方法
所有患者随访日期截至 2013年3月1日。使用 SPSS 13.0统计软件包进行数据分析与处理,组间计 数资料比较采用卡方检验,组间计量资料比较采用t 检验,生存分析采用Kaplan-meier法,死亡相对风险 的比较采用Cox比例风险模型进行计算,所有的统 计学分析均以P<0.05为差异具有统计学意义。 2 结果 2.1 化疗近期疗效
多西他赛单药组有效率(RR)为19.0%,疾病 控制率(DCR)为61.9%;培美曲塞单药组RR为 25.5%,DCR为63.8%;两组的RR、DCR差异均无统 计学意义(P>0.05),见表 2。
|
|
表 2 两组肺腺癌患者疗效比较 Table 2 Comparison of the clinical effi cacy between the two groups of lung adenocarcinoma patients |
全组患者的随访时间为5~25月,中位随访时 间为9月。其中多西他赛组TTP为3.0月,中位生存 时间(MST)为8.5月,1年生存率为31.0%;而培 美曲塞组TTP为3.6月,MST为9.0月,1年生存率为 38.3%,两组TTP、MST、1年生存率差异无统计 学意义(P >0.05),见表 2、图 1。 2.3 不良反应
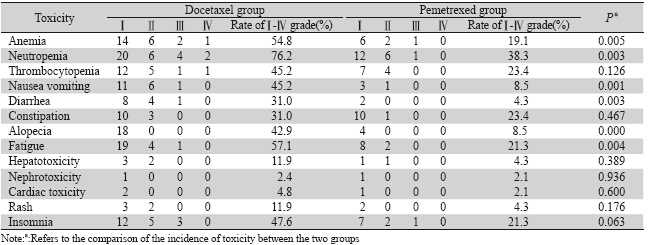
两组患者主要不良反应为:骨髓抑制、恶心呕 吐、腹泻、便秘、脱发、疲劳乏力、肝肾功能损害、 皮疹、失眠等。两组间不良反应比较见表 3。培美曲 塞单药组的贫血、粒细胞下降、恶心呕吐、腹泻、脱 发、疲劳乏力不良反应低于多西他赛组,差异有统 计学意义(P<0.05);其他不良反应间差异无统计学 意义(P>0.05)。多西他赛单药组有2位患者因出现 Ⅲ~Ⅳ级骨髓抑制,未继续接受化疗;而培美曲塞单 药组的患者均能耐受化疗不良反应。
|
|
表 3 两组肺腺癌患者不良反应比较 Table 3Comparison of the toxicity between the two groups of lung adenocarcinoma patients |
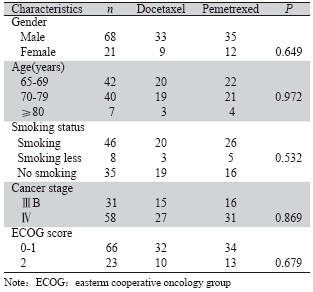 |
图 1两组肺腺癌患者生存曲线分析 Figure 1Survival curve analysis of the two groups of lung adenocarcinoma patients |
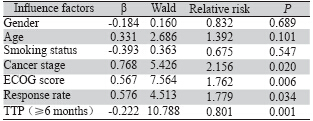
Cox比例风险模型进行两组患者预后的多因 素分析结果显示,患者的TTP、ECOG评分、分期 和有效率是影响老年患者生存的独立预后因素 (P<0.05),而性别、年龄、吸烟状态均与患者的预 后无关(P>0.05),见表 4。
|
|
表 4 肺癌患者预后的多因素分析 Table 4Multivariate analysis of prognostic factors for lung cancer patients |
铂类与第三代化疗药物联合化疗是晚期NSCLC 的一线标准治疗。老年患者各项生理功能减退, 基础疾病多,并发症发生率高,化疗耐受性较 差,因此老年晚期NSCLC是否应该化疗一直存在 争议。Earle等[2]开展的一项针对6 232例Ⅳ期老年 (≥65岁)NSCLC患者的回顾性分析显示:姑息性 化疗可延长老年患者MST 1月,且1年生存率增加 9%。ELVIS Ⅲ期临床研究[3]进一步明确了老年晚期 NSCLC行化疗优于最佳支持治疗的。对于老年患 者究竟采取单药还是两药联合化疗,意大利学者 Gridelli等[4]进行了一项针对老年晚期NSCLC Ⅲ期临 床试验(Miles试验),707例老年晚期肺癌患者随机 分为单药长春瑞滨、单药吉西他滨及两药联合化疗 三组,结果显示三组患者RR、TTP、MST及生活质 量方面均无明显差异,而联合用药组不良反应高于 两单药治疗组。ASCO指南推荐老年晚期NSCLC以 单药化疗为宜。
多西他赛是细胞周期特异性抗肿瘤药物,通 过抑制微管网的正常重组,将细胞阻断于M期,从 而抑制肿瘤细胞的有丝分裂和增殖,最终达到抗肿 瘤的目的。Hainsworth等[5]开展多西他赛单药一线 治疗老年(≥65岁)晚期NSCLC患者的Ⅱ期临床研 究,其RR为18%,DCR为62%,MST为5月,1年生 存率27%,而且Ⅲ~Ⅳ级非血液学毒性少见。本研 究显示,多西他赛单药一线治疗老年晚期肺腺癌的 RR为19.0%,DCR为61.9%,MST为8.5月,1年生存 率为31.0%,Ⅲ~Ⅳ级非血液学毒性反应发生率小于 15%。MST好于上述研究考虑所选患者为肺腺癌所 致,其他结果与Ⅱ期临床研究基本一致。
培美曲塞是人工合成的多靶点抗代谢药物,是 叶酸的类似物,它是二氢叶酸还原酶、核苷酸合酶 双重抑制剂,可同时阻断3种对癌细胞的生存至关 重要的酶靶标,同时对多个叶酸依赖酶有很强的抑 制作用,可以从多个途径抑制嘧啶和嘌呤的合成, 从而起到抗肿瘤作用。加拿大学者 Rusthoven等[6] 采用培美曲塞单药一线治疗33例Ⅲb/Ⅳ期NSCLC患 者,结果RR为23.3%,MST为9.2月。而澳大利亚学 者Clarke等[7]进行另一项研究,发现培美曲塞单药 一线治疗59例晚期 NSCLC,RR为15.8%,MST为 7.2月。意大利学者Gridelli 等[8]开展了培美曲塞一线 治疗老年晚期肺癌(≥70岁)的Ⅱ期临床试验结果 显示,44例患者中,TTP为4.5月,RR为4.5%,MST 为4.7月,一年生存率为28.5%,Ⅲ~Ⅳ级血液毒性为 4.5%。本研究回顾性分析显示,培美曲赛单药一线 治疗老年晚期肺腺癌的RR为25.5%,DCR为63.8%, MST为3.6月,1年生存率为38.3%,Ⅲ~Ⅳ级毒性反应 发生率为6%。此结果与Rusthoven[6]、Clarke[7]等的报 道相似,从侧面说明了年龄因素并不是影响化疗疗 效的主要因素,好于Gridelli等[8]开展的Ⅱ期临床试 验,主要还是考虑与选择病例的病理分型有关。
在研究中,我们对比了多西他赛与培美曲塞 一线治疗老年晚期肺腺癌的疗效,发现两组RR、 DCR、TTP、MST、1年生存率差异均无统计学意 义,但培美曲塞组贫血、粒细胞下降、恶心呕吐、 腹泻、脱发、疲劳乏力不良反应低于多西他赛组。 美国印第安纳大学Hanna等[9]的一项大型随机Ⅲ期 临床研究,共有571例患者入组,对比了单药培美曲 塞与多西他赛二线治疗晚期NSCLC,结果发现两组 RR(9.1% 与8.8%)、MST(8.3 月与7.9月)、1年生存率 ( 均为29.7%)的差异均无统计学意义,但是骨髓抑 制、粒细胞减少伴发热及脱发等药物性不良反应, 培美曲塞组显著降低。
研究中我们还发现患者的TTP、ECOG评分、 分期情况和有效率是影响老年患者生存的独立预后 因素,而性别、年龄、吸烟状态均与患者的预后无 关。国内学者张茹霞等[10]回顾性分析了多西他赛、 培美曲塞、EGFR-TKIs二线治疗170例肺癌晚期患 者,结果发现ECOG评分、治疗反应率是三组患者 预后的独立因素。Lilenbaum等[11]进行的随机对照 Ⅲ期临床研究发现,70岁以上晚期肺癌患者化疗后 生存率、生存质量与70岁以下的患者无明显差异。 因此,对于晚期肺癌患者,应尽早、尽可能选择有 效的化疗方案,在患者能够耐受的情况下,给予化 疗,将有望延长患者的生存期。
本研究中之所以选择肺腺癌,是因为肺腺癌 已成为最常见的NSCLC病理类型,且Scagliotti等[12] 进行了前瞻性、随机、多中心临床试验亚组分析发 现,培美曲塞在腺癌和大细胞癌中生存期显著延 长,而在鳞癌中结果相反。专家考虑这与鳞癌患者 的胸腺嘧啶核苷酸合酶基因和蛋白表达水平显著提 高有关,而胸腺嘧啶核苷酸合酶的过分表达会导致 培美曲塞耐药。
综上所述,多西他赛与培美曲塞单药一线化疗 老年晚期肺腺癌的疗效相近,但培美曲塞单药组的 不良反应明显低于多西他赛组。故对于体力状况差 或者畏惧化疗不良反应的老年患者,可考虑选择培 美曲塞单药一线治疗。因本文回顾的是2008年9月 至2012年3月病例,当时单药治疗病例占多数,双药 方案病例较少,主要目的是对比两种单药化疗方案 的近期有效率及不良反应,故入组病例未选择两药 方案,待积累两药联合病例后作进一步研究。
本研究的不足在于回顾性分析,未通过病理组 织EGFR突变检测来预测患者的预后,且只选择肺 腺癌,未选择大细胞癌等,病例范围较局限。
| [1] | Gridelli C, Perrone F, Monfardini S. Lung cancer in the elderly[J]. Eur J Cancer,1997,33(14):2313-4. |
| [2] | Earle CC, Tsai JS, Gelber RD, et al. Effectiveness of chemotherapy for advanced lung cancer in the elderly: instrumental variable and propensity analysis[J]. J Clin Oncol,2001,19(4):1064-70. |
| [3] | Fossella FV, Lee JS, Shin DM, et al. Phase II study of docetaxel for advanced or metastatic platinum-refractory non-small-cell lung cancer[J]. J Clin Oncol,1995,13(3):645-51. |
| [4] | Gridelli C, Perrone F, Gallo C, et al. Chemotherapy for elderly patients with advanced non-small-cell lung cancer: the Multicenter Italian Lung Cancer in the Elderly Study (MILES) phase III randomized trial[J]. J Natl Cancer Inst,2003,95(5):362-72. |
| [5] | Hainsworth JD, Burris HA 3rd, Litchy S, et al. Weekly docetaxel in the treatment of elderly patients with advanced nonsmall cell lung carcinoma. A minnie pearl cancer research network phase II trial[J]. Cancer,2000,89(2):328-33. |
| [6] | Rusthoven JJ, Eisenhauer E, Butts C, et al. Multitargeted antifolate LY231514 as fi rst-line chemotherapy for patients with advanced nonsmall- cell lung cancer: A phase II study. National Cancer Institute of Canada Clinical Trials Group[J]. J Clin Oncol,1999,17(4):1194. |
| [7] | Clarke S J, Abratt R, Goedhals L, et al. PhaseⅡtrial of pemetrexed disodium (ALIMTA, LY231514) in chemotherapy-naive patients with advanced non-small-cell lung cancer[J]. Ann Oncol,2002,13(5):737-41. |
| [8] | Gridelli C, Kaukel E, Gregorc V, et al.Single-agent pemetrexed or sequential pemetrexed/gemcitabine as front-line treatment of advanced non-small cell lung cancer in elderly patients or patients ineligible for platinum-based chemotherapy: a multicenter, randomized, phase II trial[J]. J Thorac Oncol,2007,2(3):221-9. |
| [9] | Hanna N, Shepherd FA, Fossella FV, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-smallcell lung cancer previously treated with chemotherapy[J]. J Clin Oncol,2004,22(9):1589-97. |
| [10] | Zhang RX, Cai DY, Wu XH, et al. Effi cacy and safety of docetaxol, pemetrexed and EGFR-TKIs as second-line treatment for patients with advanced non-small-cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi,2012,34(11):869-72.[ 张茹霞,蔡东焱,吴小红,等. 多 西他赛培美曲塞和表皮生长因子受体酪氨酸激酶抑制剂二线 治疗晚期非小细胞肺癌的近期疗效与安全性[J]. 中华肿瘤杂 志,2012,34(11):869-72.] |
| [11] | Lilenbaum RC, Herndon JE 2nd, List MA, et al. Single-agent versus combination chemotherapy in advanced non-small-cell lung cancer: the cancer and leukemia group B (study 9730)[J]. J Clin Oncol,2005,23(1):190-6. |
| [12] | Scagliotti GV, Parikh P, von Pawel J, et al. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer[J]. J Clin Oncol,2008,26(21):3543-51. |
 2014, Vol.41
2014, Vol.41