胃癌是我国常见的恶性肿瘤之一,大部分胃 癌患者就诊时疾病已进展至晚期,失去手术的最 佳时机,还有部分患者即使进行根治性手术,也 面临复发和转移的风险。那么,对于局部进展或 复发转移的晚期胃癌患者,化疗就成为了重要的 治疗手段,但目前尚无统一的标准化疗方案[1]。奥 沙利铂和多西他赛是胃癌化疗中的重要药物,目 前晚期胃癌患者的一线化疗以多西他赛为主的化 疗方案既有三药联合,也有两药联合,而以奥沙 利铂为主的化疗方案都是两药联合,根据V325等 相关临床试验可知,在晚期胃癌一线化疗中,三 药联合方案优于两药联合方案。目前胃癌化疗主 要根据病理的WHO分型进行,尚没有根据其他病 理分型进行一线化疗,故笔者回顾性分析中国人 民解放军总医院199例晚期胃癌患者,一线化疗分 别以多西他赛为主和以奥沙利铂为主的方案在肠 型和弥漫型中的近期疗效、无疾病进展时间、中 位生存期等情况,报告如下。 1 资料和方法 1.1 一般资料
2003年10月—2011年10月,中国人民解放军 总医院共收治一线应用以多西他赛为主方案的患 者109例(54.8%),以奥沙利铂为主方案的患者 54例(27.1%)和其他化疗方案36例(18.1%), 均经病理学证实且有随访结果的199例进展期胃癌 患者,男145例(72.9%),女54例(27.1%), 发病年龄21~79岁,中位年龄61岁,年龄小于61 岁的103例(51.8%),年龄大于等于61岁的96例 (48.2%)。
经过两名高年资病理科主治医师进行Lauren 分型[2, 3],肠型88例(44.2%),弥漫型105例 (52.8%),混合型6例(3.0%)。所有病例均有 远处转移,卡氏评分均大于70分,预计可生存3月 以上。肠型组和弥漫型组中,两种方案化疗的患 者一般特征具有可比性(P>0.05)。 1.2 治疗方法
首先对全部纳入本研究患者的病理资料进行 Lauren分型,将全部病例分为肠型组和弥漫型组, 分别对两组中以多西他赛为主化疗方案和以奥沙 利铂为主化疗方案的病例在OS、DFS、ORR和 DCR方面进行统计学分析。
以多西他赛为主的化疗方案包括:DCFf方 案: 多西他赛(DXT) 75 mg/m2,静脉滴注, 第1天,3周一次,顺铂(DDP) 75 mg/m2,静脉 滴注,第1天,3周一次,氟尿嘧啶(5-Fu) 750 mg/(m2·d),泵入24 h,第1~5天,3周一次; 3周一次,DDP 75 mg/m2,静脉滴注,第1天,3 周一次,希罗达(Xeloda)1 000 mg/m2,口服一 日2次,第1~14天,3周一次;DOF方案: DXT 75 mg/m2,静脉滴注,第1天,3周一次,奥沙利 铂(OXA) 130 mg/m2,静脉滴注,第1天,3周 一次,5-Fu 750 mg/(m2·d),泵入24 h,第1~5 天,3周一次;DF方案: DXT 75 mg/m2,静脉滴 注,第1天,3周一次,5-Fu 750 mg/(m2·d), 泵入24 h,第1~5天,3周一次;DX方案 DXT 75 mg/m2,静脉滴注,第1天,3周一次,Xeloda 1000 mg/m2,口服一日2次,第1~14天,3周一次;DS 方案: DXT 75 mg/m2,静脉滴注,第1天,3周 一次,替吉奥(S-1) 60 mg/(m2·d),口服,第 1~14天,3周一次等。
以奥沙利铂为主的化疗方案包括:FOLFOX方 案: OXA 85 mg/m2,静滴2h,第1天,2周一次, 5-Fu 400 mg/m2,静脉滴注,第1、2天,2周一 次,5-Fu 600 mg/m2,泵入22 h,亚叶酸钙(LV) 200 mg/m2,静脉滴注,第1、2天,2周一次; SOX 方案 :S-1 60 mg/(m2·d),口服,第1~14天,3 周一次,OXA 130 mg/m2,静脉滴注,第1天,3 周一次;XELOX方案: OXA 130 mg/m2,静脉滴 注,第1天,3周一次,Xeloda) 1 000 mg/m2,口 服一日2次,第1~14天,3周一次等。
其他化疗方案包括:单药Xeloda: 1000 mg/m2, 口服一日2次,第1~14天,3周一次);单药S-1: 60 mg/(m2·d),口服,第1~14天,3周一次;单 药5-Fu 1 000 mg/m2,泵入,第1~5天,3周一次; DDP+5-Fu:DDP 80 mg/m2,静脉滴注,第1天,3 周一次,5-Fu 800 mg/(m2·d),泵入,第1~5天, 3周一次;DDP+Xeloda:DDP 80 mg/m2,静脉滴 注,第 1天,3周一次,Xeloda 1 000 mg/m2,口服 一日2次,第1~14天,3周一次;紫杉醇+Xeloda: 紫杉醇 175 mg/m2,静脉滴注,第1天,3周一次, Xeloda 825 mg/m2,口服一日2次,第1~14天,3周 一次等。
所有化疗方案均按临床常规化疗进行,包 括预处理,化疗前常规使用5-HT3受体阻断剂止 吐,化疗期间每周复查血常规,化疗前后复查 肝肾功能,酌情给予G-CSF升高粒细胞[5~7 μg/ (kg·d),皮下注射]、IL-11升高血小板[25~50 μg/(kg·d),皮下注射]及输血纠正贫血等对症处 理。定期对患者肿瘤情况进行评价,中位可评价 周期数为4周期,且疗效可评价。肠型组与弥漫型 组两种化疗方案均包括以上的方案。 1.3 评价标准
对于近期客观疗效按照RECIST标准观察 评价。客观有效率(ORR)为CR(complete remission)+PR(partial remission)。疾病控制率 (DCR)为CR+PR+SD(stable disease)。 1.4 统计学方法
采用SPSS 19.0软件,生存分析采用Kaplan- Meier法,计数资料采用卡方检验。以P<0.05为差 异有统计学意义。 2 结果 2.1 近期疗效
近期疗效包括客观有效率和疾病控制率, 肠型组中多西他赛三药联合化疗方案22例,无 CR患者,6例PR患者,15例SD患者,故多西他 赛三药联合化疗方案的ORR和DCR分别为27.3% 和95.5%;而以多西他赛为主的化疗方案48例, 无CR患者,11例患者PR,30例患者SD,ORR和 DCR分别为22.9%和85.4%;以奥沙利铂为主的 化疗方案21例,无CR患者,5例患者PR,13例 患者SD,其ORR和DCR分别为23.8%和85.7%。 弥漫型组中多西他赛三药联合化疗方案29例,无 CR患者,6例PR患者,14例SD患者,故多西他 赛三药联合化疗方案的ORR和DCR分别为20.7% 和69.0%,而以多西他赛为主的化疗方案60例, 无CR患者,10例患者PR,28例患者SD,ORR和 DCR分别为16.7%和63.3%,以奥沙利铂为主的化 疗方案23例,无CR患者,4例患者PR,11例患者 SD,其ORR和DCR分别为17.4%和65.2%。经统计 学分析,表明三药联合的化疗方案并没有直接影 响客观有效率和疾病控制率。故对于其后的统计 学分析是有效的,见表 1。
在肠型组中,以多西他赛为主的化疗方案48 例,无CR患者,11例患者PR,ORR为22.9%,以 奥沙利铂为主的化疗方案21例,无CR患者,5例患 者PR,ORR为23.8%,两组比较差异无统计学意义 (χ2=0.053,P=0.819),以多西他赛为主的化疗 方案DCR为85.4%(41/48),以奥沙利铂为主的 化疗方案DCR为85.7%(18/21),两组比较差异 无统计学意义(χ2=0.115,P=0.734),因此2组客 观近期疗效比较差异无统计学意义(P>0.05)。 在弥漫型组中,以多西他赛为主的化疗方案60 例,无CR患者,10例患者PR,ORR为16.7%,以 奥沙利铂为主的化疗方案23例,无CR患者,4例 患者PR,ORR为17.4%,两组比较差异无统计学 意义(χ2=0.062,P=0.804),以多西他赛为主的 化疗方案DCR为63.3%(38/60),以奥沙利铂为 主的化疗方案DCR为65.2%(15/23),两组比较 差异无统计学意义(χ2=0.026,P=0.873),因此 两组客观近期疗效比较差异无统计学意义(P> 0.05),见表 2。
|
|
表 1 三药联合化疗对比其他化疗方案在客观有效率和疾病控制率方面的影响 Table 1 Comparison of ORR and DCR between three drugs and other chemotherapy |
|
|
表 2 以多西他赛为主和以奥沙利铂为主的化疗方案在客观有效率和疾病控制率的对比因素 Table 2 Comparation of ORR and DCR between Docetaxel-based and Oxaliplatin-based chemotherapy |
随访结束时间为2012年10月31日,191例 患者中,21例患者仍存活。肠型组中,以多西 他赛为主的化疗方案的中位疾病无进展时间 (mPFS)为5.00月(95%CI 4.054~5.946),以奥 沙利铂为主的化疗方案的mPFS为6.20月(95%CI 2.925~9.475),两组中位PFS比较差异无统计学意 义(P=0.167),见图 1。以多西他赛为主的化疗 方案的中位生存时间(mOS)为16.73月(95%CI 12.653~20.807),以奥沙利铂为主的化疗方案的 mOS为15.43月(95%CI 13.341~17.519),两组中 位生存期比较差异无统计学意义(P=0.256)见图 2、表 3。
弥漫型组中,以多西他赛为主的化疗方案的 中位疾病无进展时间(mPFS)为2.70月(95%CI 0.483~4.917),以奥沙利铂为主的化疗方案的 mPFS为3.33月(95%CI 1.912~4.748月),2组中 位PFS比较差异无统计学意义(P=0.559),见图 3。以多西他赛为主的化疗方案的中位生存时间 (mOS)为8.33月(95%CI 6.217~10.443),以奥 沙利铂为主的化疗方案的mOS为7.10月(95%CI 5.910~8.290),两组中位生存期比较差异无统计 学意义(P=0.470),见图 4、表 4。
|
|
表 3 晚期胃癌肠型组两种化疗方案的生存分析 Table 3 Survival analysis of Docetaxel- and Oxaliplatin-based chemotherapy for patients with intestinal-type AGC |
|
|
表 4 晚期胃癌弥漫型组两种化疗方案的生存分析 Table 4Survival analysis of Docetaxel- and Oxaliplatin-based chemotherapy for patients with diffuse-type AGC |
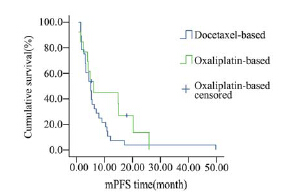 |
图 1肠型组中两种化疗方案在中位疾病无进展期的累计生 存率曲线 Figure 1Cumulative survival curves of Docetaxeland Oxaliplatin-based chemotherapy for patients with intestinal-type AGC in median progression-free survival |
 |
图 2晚期胃癌肠型组中两种化疗方案在中位总生存期的累 计生存率曲线 Figure 2Cumulative survival curves of Docetaxeland Oxaliplatin-based chemotherapy for patients with intestinal-type AGC in median overall survival |
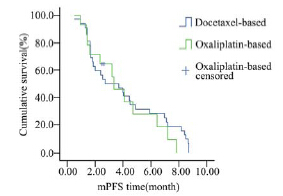 |
图 3晚期胃癌弥漫型组中两种化疗方案在中位疾病无进展 期的累计生存率曲线 Figure 3Cumulative survival curves of Docetaxel- and Oxaliplatin-based chemotherapy for patients with diffusetype AGC in median progression-free survival |
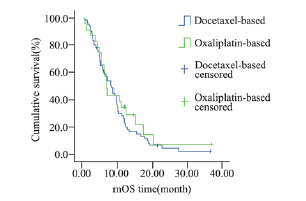 |
图 4弥漫型组中两种化疗方案在中位总生存期的累计生存 率曲线 Figure 4Cumulative survival curves of Docetaxel- and Oxaliplatin-based chemotherapy for patients with diffusetype AGC in median overall survival |
胃癌的死亡率在全球恶性肿瘤中居于前列, 在亚洲和欧洲国家高发[4]。在发现胃癌的时候,大 部分患者已处于晚期,即使能够接受手术治疗, 60%以上的进展期胃癌患者仍然会出现局部复发或 者远处转移,这部分患者预后很差[5]。另有研究表 明,肠型与弥漫型在PFS和OS的对比中,肠型胃 癌较弥漫型和混合型胃癌的PFS和OS都是相对延 长的,本组的统计结果完全符合以上结果(PFS: 5.07月vs.3.33月vs.3.37月,P=0.001,OS:16.07 月vs.8.43月vs.5.87月,P=0.000)。目前,铂类联 合氟尿嘧啶类药物是晚期胃癌联合化疗方案的基 础,近年来多种新药的开发和应用以及各种不同 的组合,使胃癌的化疗疗效有了一定的提高[6]。
本研究所有患者的不良反应包括:白细胞减 少,贫血,血小板减少,恶心呕吐,口腔炎,便 秘,腹泻,脱发,外周神经毒性,肝功能,肾功 能,心脏毒性,液体滁溜,肌痛等,以上不良反 应均在可控范围内,经过对症处理,均得到明显 好转。本研究所有患者的化疗均按计划进行,直 至病情进展为止。故本研究的结果在可控范围 内。
由V325等相关临床试验可知,三药联合化疗 方案优于两药联合化疗方案,故本研究首先对其 中可能存在的影响客观有效率和疾病控制率的因 素进行统计学分析,主要分析肠型组和弥漫型组 中以下三个方面在客观有效率和疾病控制率的差 异:(1)含多西他赛两药联合和三药联合的化疗 方案与含多西他赛三药联合的化疗方案;(2)含 多西他赛两药联合和三药联合的化疗方案和含奥 沙利铂两药联合的化疗方案与含多西他赛的三药 联合的化疗方案;(3)含奥沙利铂的两药联合的 化疗方案与含多西他赛三药联合的化疗方案。经 分析,本研究中三药联合化疗方案没有直接影响 近期疗效。
以奥沙利铂为主的化疗方案在临床上广泛应 用,国内的一项患Ⅱ期临床试验[7]表明奥沙利铂联 合卡培他滨方案治疗进展期胃癌显示,其治疗有 效率48.9%(95%CI 34~64),疾病控制率82.2%, mPFS在6.0月,mOS在10.0月;国内另一项同一化 疗方案治疗进展期胃癌的Ⅱ期临床试验[8]同样显 示了较好的反应率,有效率、mPFS和mOS分别为 62.2%(95% CI 51.2~73.2)、5.9月和10.8月;对于 同一个化疗方案韩国的一项Ⅱ期临床试验[9]取得的 结果显示其有效率44%,mPFS和mOS分别为7.2月 和13.3月。另外,韩国的一项奥沙利铂联合替吉奥 的化疗方案治疗进展期胃癌的Ⅱ期临床试验[9]的有 效率40%,mPFS和mOS分别为6.2月和12.4月;韩 国的另一项同样化疗方案的Ⅱ期临床试验[10]治疗 进展期胃癌的结果显示,其有效率53.7%(95%CI 38~70),疾病控制率90.2%,mPFS和mOS分别为 4.6月和7.8月。本组肠型组中以奥沙利铂为主的化 疗方案患者21例,ORR为23.8%,低于上述临床试 验,可能原因为SD所占比例较高,故DCR在上述 临床试验范围内(85.7%),mPFS为6.20月,mOS 为15.43月,可能与肠型预后较好有关;弥漫型 组中以奥沙利铂为主的化疗方案患者23例,ORR 17.40%,DCR 65.2%,mPFS 3.33月,mOS 7.10 月,考虑肠型组的mPFS和mOS明显高于临床试 验,而弥漫型组中两者明显低于临床试验,综合 以上因素,本研究与临床试验研究结果相符。
以多西他赛为主的化疗方案较多,其中日本 的一项多西他赛联合替吉奥方案治疗进展期胃癌 的Ⅱ期临床试验研究[11],其有效率57.8%,mPFS 为6.9月,mOS为15.3月,另外韩国的一项同样 方案治疗进展期胃癌的Ⅱ期临床试验研究[12]也显 示,有效率46%(95%CI 30~62),mPFS为7.3 月,mOS为16.0月。另一项韩国的Ⅱ期临床试验 研究[12],其针对的化疗方案为多西他赛联合顺铂 治疗进展期胃癌,其有效率、mPFS、mOS分别 为24%(95%CI 11~38)、4.9月、8.3月。另一项 法国的Ⅱ期临床试验研究[13]对比了多西他赛联合 伊立替康或氟尿嘧啶方案在治疗进展期胃癌中的 差别,仅显示了有效率,两种方案分别为37.5% 和33.3%。在韩国的一项对于多西他赛联合卡培 他滨和顺铂的化疗方案的Ⅱ期临床试验研究[14], 其有效率、mPFS、mOS分别为68%、7.6月、14.4 月;国内一项同样化疗方案的Ⅱ期临床研究[15], 仅有14例患者,有效率达到了78.6%,疾病控制 率达到了92.9%,mOS为13.5月。本研究肠型组 中以多西他赛为主的化疗方案患者48例,ORR为 22.9%,DCR为85.4%,mPFS为5.00月,mOS为 16.73月;弥漫型组中以多西他赛为主的化疗方 案患者60例,ORR、DCR、mPFS和mOS分别为 16.7%、63.3%、2.70月、8.33月。还有两个临床 试验研究是多西他赛联合奥沙利铂方案,一个是 台湾的Ⅱ期临床试验研究[16],另一个是欧洲的Ⅱ 期临床试验研究[17],分别显示ORR 32.6(95%CI 19.1~48.5)、59%,4.2月、10月,8.3月、18月, 显示有一定的差别,可能是由于入组病例的不 同。由此可见,以多西他赛为主的化疗方案和以 奥沙利铂为主的化疗方案治疗晚期胃癌都取得了 较好的疗效,两者都可以作为进展期胃癌化疗的 有效选择之一。本研究仍有一些不足之处,因为 采取了回顾性分析,故在分组中患者例数存在一 定的差异,并没有做到患者例数尽可能的相等, 且以奥沙利铂为主的化疗方案病例数较少,这样 就使得在统计分析时可能会存在一定的差异,对 统计结果有一定的影响,但仍然给后续的大规模 前瞻性临床试验提供了一定的参考价值,并期待 大规模前瞻性临床试验来进一步验证本研究的结 论。
| [1] | Glimelius B,Ekstr?m K, Hoffman K,et al.Randomized comparison between chemotherapy plus best supportive care with best supportive care in advanced gastric cancer[J]. Ann Oncol,1997,8(2):163-8. |
| [2] | Yu YY.The Pathological classification of gastric cancer and its relationship with outcome of patients[J].Wai Ke Li Lun Yu Shi Jian, 2011,16(3):240-3.[于颖彦.胃癌的病理分型与预后[J].外科 理论与实践 ,2011,16(3):240-3.] |
| [3] | Li YC, Wu XT. Relationship Between Pathologic Feature and Biological Behavior of Gastric Cancer[J]. Zhongguo Pu Wai Ke Ji Chu Yu Lin Chuang Za Zhi, 2006,13(1):120-2.[李月春,伍晓 汀.胃癌病理学与生物学特征的关系[J]. 中国普外科基础与临 床杂志, 2006,13(1):120-2.] |
| [4] | Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics, 2002[J].CA Cancer J Clin,2005,55(2):74-108. |
| [5] | Van Cutsem E.The treatment of advanced gastric cancer:new fi ndings on the activity of the taxanes[J]Oncologist,2004,9 Suppl 2:9-15. |
| [6] | Rivera F,Vega-Villegas ME,López-Brea MF.Chemotherapy of advanced gastric cancer[J].Cancer Treat Rev,2007,33(4):315-24. |
| [7] | Xiao JX,Zhang L,Qiu F,et al. A Phase II study of capecitabine plus oxaliplatin as first-Line chemotherapy in elderly patients with advanced gastric cancer[J]. Chemotherapy, 2012,58(1):1-7. |
| [8] | Yang T,Shen X,Tang X,et al.Phase II trial of oxaliplatin plus oral capecitabine as fi rst-line chemotherapy for patients with advanced gastric cancer[J]. Tumori, 2011,97(4):466-72. |
| [9] | Kim GM, Jeung HC, Rha SY,et al. A randomized phase II trial of S-1-oxaliplatin versus capecitabine–oxaliplatin in advanced gastric cancer[J]. Eur J Cancer,2012,48(4):518-26. |
| [10] | Oh SY, Kwon HC, Jeong SH,et al. A phase II study of S-1 and oxaliplatin (SOx) combination chemotherapy as a first-line therapy for patients with advanced gastric cancer[J]. Invest New Drugs,2012,30(1):350-6. |
| [11] | Kunisaki C, Takahashi M, Makino H,et al. Phase II study of biweekly docetaxel and S-1 combination chemotherapy as fi rstline treatment for advanced gastric cancer[J]. Cancer Chemother Pharmacol,2011,67(6):1363-8. |
| [12] | Jeung HC, Rha SY, Im CK,et al. A randomized phase 2 study of docetaxel and S-1 versus docetaxel and cisplatin in advanced gastric cancer with an evaluation of SPARC expression for personalized therapy[J]. Cancer, 2011,117(10):2050-7. |
| [13] | Roy A, Cunningham D, Hawkins R,et al. Docetaxel combined with irinotecan or 5-fluorouracil in patients with advanced oesophago-gastric cancer: a randomised phase II study[J]. Br J Cancer,2012,107(3):435-41. |
| [14] | Kang YK, Ryu MH, Yoo C,et al. Phase I/II study of a combination of docetaxel, capecitabine,and cisplatin (DXP) as first-line chemotherapy in patients with advanced gastric cancer[J]. Cancer Chemother Pharmacol,2011,67(6):1435-43. |
| [15] | Chi Y, Ren JH, Yang L,et al. Phase II clinical study on the modifi ed DCF regimen for treatment of advanced gastric carcinoma[J]. Chin Med J(Engl),2011,124(19):2997-3002. |
| [16] | Amarantidis K, Xenidis N, Chelis L,et al. Docetaxel plus oxaliplatin in combination with capecitabine as fi rst-line treatment for advanced gastric cancer[J]. Oncology,2011,80(5-6):359-65. |
| [17] | Chen JS, Chen YY, Huang JS,et al. A multiple-center phase II study of weekly docetaxel and oxaliplatin as first-line treatment in patients with advanced gastric cancer[J]. Gastric Cancer,2012,15(1):49-55. |
 2014, Vol.41
2014, Vol.41