2.甘肃省嘉峪关市酒钢医院骨科
2.Department of Orthopedics, Jiugang Hospital of Jiayuguan
骨上皮样血管内皮瘤 (epithelioid haemangioendothelioma, EHE)发病率不足恶性骨肿瘤的 1%。部分病例术后可复发,个别可出现远处转移。 2002版WHO分类在骨的血管肉瘤项下表述[1],而之 前将EHE归入中间型或交界性血管源性肿瘤。2013 版《WHO软组织与骨肿瘤分类》[2]中延续了2002版 WHO的分类思路,将骨的EHE从骨血管肉瘤项下 独立出来,成为新的病种,定义为一种由上皮样 内皮细胞 (内皮表型)及玻璃样、软骨样或嗜酸性 间质构成的中-低度恶性肿瘤。由于缺乏特异性临 床表现,形态及免疫表型呈上皮样,临床及病理均易误诊。本文观察了3例发生于骨的EHE,结合 临床及影像学所见并复习相关文献,重点探讨其 形态学特征、诊断及鉴别诊断。 1 资料与方法 1.1 资料
收集第三军医大学大坪医院野战外科研究所 及甘肃省嘉峪关市酒钢医院2002—2012年间明确 诊断的3例骨上皮样血管内皮瘤,查询临床病史并 调阅影像学资料。 1.2 方法
标本经4%中性甲醛固定,骨组织经脱钙液 处理,常规脱水,石蜡包埋。4 μm厚切片,HE 染色、光学显微镜观察。免疫组织化学标记采用 En Vision法。操作步骤按照试剂盒说明书进行。 用PBS代替一抗作阴性对照。所选一抗Vimentin、 CK、CD31、CD34、FⅧRAg、SMA、desmin、TTF– 1、SP-B、PSA及Ki67和二抗购自福州迈新公司。 TTF-1及Ki67着色定位于胞核,其余抗体定位于胞 质或胞膜。所有患者进行电话及电子邮件随访。 2 结果 2.1 临床资料
病例1,女,14 岁。以“活动后左外踝疼痛半 年,加重1月”入院。查体:左小腿下1/3外侧压 痛,可扪及4.0 cm×3.0 cm×1.5 cm大小的肿块,梭 形、质硬、不活动。X线示左胫骨下端骨干增粗、 变形,其间有多个大小不等的囊性破坏区,外侧 呈偏心性生长,边界清楚,有锐利的硬化边,骨 皮质受压变薄,无骨膜反应及周围软组织块影。 左腓骨小头上3 cm处亦见一类圆形密度减低区, 中间可见残存的骨小梁,边缘清晰,有硬化带。X 线诊断:考虑(1)多发性骨囊肿;(2)甲状旁 腺功能亢进性骨病。骨科行“骨囊肿”刮除后植骨 术。病理报告:血管内皮瘤。考虑到病变呈多发 性,患者家属携切片及腊块到上级医院会诊,经 标记CK及CD31均呈阳性。修正诊断为:(左胫腓 骨)上皮样血管内皮瘤。
病例2,男,36岁。主诉“右膝、右踝关节疼 痛半年”。患者半年来无明显诱因出现右下肢疼 痛,下楼梯时明显,而上楼梯及平路行走无特 殊。4月前发现右小腿后侧豌豆大小包块,压痛, 可移动。在当地医院行皮下肿物切除术,术后病 理诊断为上皮样血管内皮瘤。术后切口预后良 好。1月前下肢疼痛加重。又到前述医院行影像学检查,提示右股骨下段及右胫骨下段多处溶骨 性破坏,见图 1A~1D。住院治疗术中见右股骨下 段及右胫骨上段大小分别为3.5 cm×2.0 cm×1.5 cm 及2.0 cm×1.5 cm×1.0 cm大小的骨质破坏区,遂行 彻底病灶清除并植骨。术后会诊并免疫组织化学 标记,病理诊断:(右股骨下段)及(右胫骨上 段)上皮样血管内皮瘤。
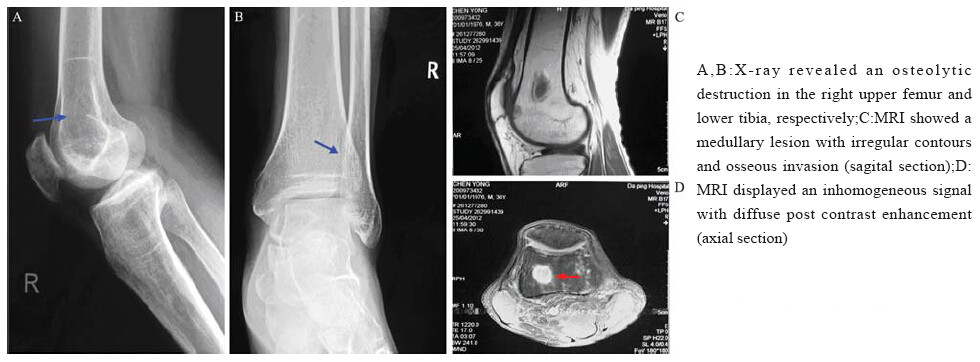 |
图 1 骨上皮样血管内皮瘤的影像 学所见 Figure 1 Imaging findings of osseous EHE |
病例3,女,35岁。外伤后X线检查显示右 腓骨中上1/3多灶性不规则溶骨性破坏,呈小囊 状或蜂窝状透光区,围绕不规则硬化边,无骨膜 反应。术中见皮质变薄,髓腔充满暗红色海绵状 肿瘤组织,富含血液。行病骨瘤段切除。病理诊 断:(右腓骨中上段)多发性上皮样血管内皮瘤。 2.2 病理检查 2.2.1 巨检
刮除组织呈灰褐或暗红色不规则碎块状,其 中夹杂小灶灰白区。瘤段切除标本病变可见反应 性硬化边,但无明显包膜,肿瘤切面呈蜂窝状, 质软,富含血液。 2.2.2 镜检
肿瘤由大的多边形上皮样细胞及梭形细胞构 成,替代松质骨内的正常骨髓造血组织,并累及 髓腔及毗邻骨皮质,使局部骨质吸收及反应性硬 化。分化好的区域肿瘤组织呈巢状、条索状排 列,见图 2A,形成不规则相互交汇、狭窄的管腔 或裂隙状结构,见图 2B。上皮样细胞胞质丰富, 嗜酸性 ,见图 2C,部分管腔化或空泡状,呈印戒 细胞样,其内偶见红细胞,见图 2D。核圆形或卵 圆形,核仁明显。许多内皮细胞像钉突样凸向腔 内,形成乳头。肿瘤间质呈黏液样或嗜酸性玻璃 样,见图 2E。分化差的区域肿瘤组织呈片层状弥 漫排列,其中可见不明显的腔隙,富含红细胞, 见图 2F。少数区域瘤细胞有轻度异型性,偶见核 分裂相。肿瘤不同区域可有变性及新旧不等的出 血,但缺乏肿瘤性凝固性坏死。
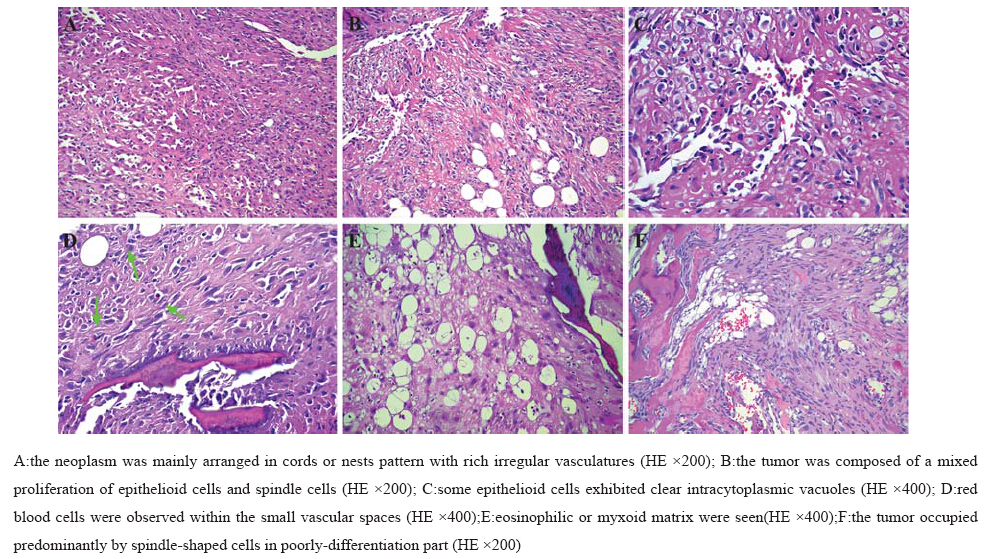 |
图 2 骨上皮样血管内皮瘤的形态学特征 Figure 2 Morphological features of osseous EHE |
所有病例的肿瘤细胞除了表达CD31、CD34 和(或)FⅧRag外,见图3A、3B,还表达CK及 vimentin,见图3C、3D。Ki67增殖指数约2%,见 图3E。
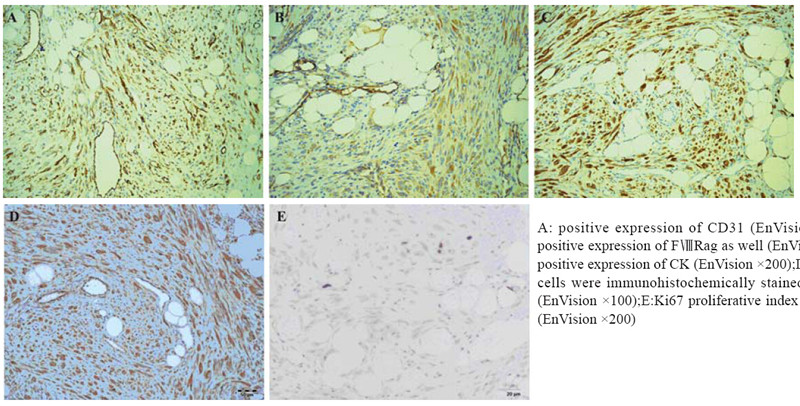 |
图 3 骨上皮样血管内皮瘤的免疫组织化学染色 Figure 3 Immunohistochmecal stainings in osseous EHE |
血管内皮瘤 (haemangioendothelioma,HE)最 早由Stout[3]于1943年描述。到了1982年Weiss等[4]观察到一种上皮样的HE,首次命名为EHE。骨外 EHE发病部位以肝、肺及软组织为多。骨的EHE 由Tsuneyoshi等[5]于1986年首次报道,最常见于下 肢长管状骨,其次是骨盆、肋骨及脊柱[6]。可单发 也可多发,累及单骨的EHE中50%~64%出现多灶 性聚集现象[7, 8],如Boutin等[9]报道的1例全身骨破 坏多达45处。故多骨发病及单骨多发灶成为EHE 的临床病理特点之一。 3.2 临床表现
骨的EHE可发病于任何年龄,但患者以10~30 岁多见,男性略多。临床上很少出现明显的骨性 包块,缺乏特异性症状和体征。一般表现为局部 疼痛及肿胀,进而由影像学检查发现。 3.3 影像学特征
X线通常表现为溶骨性病变,可局限于松质 骨或髓腔,也可累及骨皮质。破坏区可见单个或 多个斑片状、泡沫状透亮区,密度不均,边界不 清,可伴有硬化边,但缺乏骨膜反应。由于膨胀 性改变不明显,有时X线平片显示不清,可能导致 漏诊,故进一步的CT、PET[10]或MRI检查很有必 要。有时病灶内有粗大的骨嵴,形成分隔,呈“肥 皂泡样”观,骨皮质轻度膨胀,甚至破坏而侵及周 围软组织,严重者可伴有病理性骨折,但很少形 成软组织肿块,也无成骨及钙化。大约55%病例表 现为多中心性[11],这种单一解剖部位聚集多灶性 病变可能是肿瘤多中心源发生的结果。 3.4 形态学特征
富于血管或血管拟态的肿瘤很常见,而排列 成血管外皮瘤样结构者多见。形态学需要仔细观 察并证实EHE实性区域的梭形细胞为血管源性而 非肌源性或腺性。上皮样细胞胞质丰富而嗜酸, 核大、空泡状,可见小核仁,有时可见明显的核 沟。肿瘤间质亦嗜酸,HE染色呈深红色,显得很 特别[12]。作为血管源性肿瘤,EHE既可像树枝样 以血管为中心向周围软组织发展,也可看不到血 管,而呈弥漫实性或片层状排列,但或多或少能 发现不规则血管样裂隙,这种单层假腺管状结构 缺乏基底膜,内衬钉突状内皮细胞,有的凸向腔 内,形成微乳头。部分肿瘤细胞的胞质管腔化或 形成空泡,内含红细胞及其碎片,表明它是一种 特化的、处于细胞水平的、向内皮方向分化的微 血管,成为EHE的诊断依据之一。 3.5 诊断
除了影像学所见,以下临床病理特点有助于 EHE的诊断:(1)发于骨组织;(2)具有血管源性肿瘤的大体表现:由于富含血管及裂隙,新 鲜标本切开后血液外溢,张力下降,体积往往缩 小;(3)镜下特点:肿瘤组织细胞呈巢状、索状 或不规则分支状排列,部分细胞呈上皮样,胞质 粉染,内含偶见红细胞的空泡,其本质为单个细 胞原始而幼稚的微血管。基质常呈玻璃样变,HE 染色呈深红色。细胞异型性不明显,核分裂相偶 见,坏死无或少见。如果出现显著核分裂及肿瘤 性凝固性坏死,宁可诊断为上皮样血管肉瘤而非 EHE;(4)免疫组织化学染色:EHE双重表达血 管内皮细胞[CD31、CD34和(或)FⅧRag]及上皮 标志物 (CK或EMA)。由于CD34在许多梭形细胞肿 瘤中呈阳性,故抗体选择CD31更好,必要时多个 抗体联合标记;(5)微观结构:电子显微镜下瘤 细胞可见Weibel–Palade小体;(6)遗传学:具有 特征性的t (1; 3) (p36; q25)基因,即导致WWTR1的 3 q25与CAMTA1的1p36发生融合,形成WWTR1– CAMTA1融合基因[2]。本文3例均发生于下肢,存在 多骨发病或单骨多发病灶,与文献报道一致[2, 7, 8, 9], 诊断明确。 3.6 鉴别诊断
EHE应注意与下列肿瘤相互区别: 3.6.1 骨上皮样血管瘤 (EH)
也具有多角形上皮 样内皮细胞、泡状核及嗜酸性胞质,但成簇的小 血管形正腔圆,间质中可见多少不等的嗜酸性粒 细胞及淋巴细胞浸润。而EHE的血管更原始,管 腔化不明显,基质呈致密软骨样或玻璃样。 3.6.2 骨血管肉瘤 (EA)
肿瘤体积更大,出血、 坏死更明显。细胞异型性及多形性显著,核分裂 相多,血管分化更原始,常形成相互吻合的窦隙 样,瘤细胞沿管腔多层排列,部分呈弥漫实性或 列兵样。而EHE的细胞异型性不明显,核分裂相 罕见,出血、坏死较少或无[13]。 3.6.3 血管周细胞瘤 (HPC)
由于细胞围绕血窦样 血管排列,常伴内皮细胞增生、肥大,易与EHE 混淆,但HPC的血管形态较独特,呈树枝状或鹿 角状。特殊染色显示HPC的细胞由丰富的网状纤 维包绕,自血管壁向外呈放射状排列,而EHE的 肿瘤细胞分布于巢状分隔的血管网状纤维膜内, 细胞之间无网状纤维。免疫表型差别更大,HPC 可表达CD34,但不表达CD31及FⅧ。 3.6.4 骨转移性癌
患者多为中老年人,而EHE 以年轻人居多。对怀疑骨转移的年轻患者要注意 排查EHE。转移性癌常有原发病灶,癌性腺体较 圆润,可见筛孔样结构,细胞有极向,往往存在刷状缘及基膜。但转移性癌既无原始血管腔结 构,也不表达血管源性标志物。 3.6.5 上皮样肉瘤 (ES)
由于细胞呈上皮样,约 10%~20%的ES患者出现营养不良性钙化及骨化, 易与EHE混淆。但ES主要见于年轻人四肢远端 的软组织而不是骨骼,多边形上皮样细胞呈栅栏 状排列形成类似肉芽肿结构,中央可见地图状坏 死,周围淋巴细胞浸润。可表达CK,但不表达血 管标志物。 3.6.6 软骨肉瘤(CS)黏液样变及骨外黏液样软骨 肉瘤(EMC)
当EHE含有黏液样或软骨样基质时, 容易与之混淆。但软骨肉瘤细胞较圆较大,可形 成陷窝,软骨基质嗜碱性,黏液变背景中可见钙 化,血管稀疏。EMC正如名称表述的那样,位于 软组织而非骨骼。其卵圆形或短梭形细胞排列成 条索状,由纤细的纤维组织分隔,呈分叶状,富 于黏液性基质,细胞较小,富含糖原但不会形成 代表原始血管腔的胞质内空泡。 3.6.7 滑膜肉瘤 (SS)
富于血管,上皮样或梭形 细胞可围绕血管排列,极易与上皮样血管内皮瘤 混淆,但SS常位于大关节附近的软组织,骨骼罕 见,形态学上具有双相分化特点。免疫标记虽可 表达CK,但不表达CD31及CD34。遗传学检查显示 染色体异位产生特征性的SS18–SSX融合蛋白[14], 可予鉴别。 3.6.8 淋巴管内乳头状血管内皮瘤 (Dabska瘤)
呈 蜂窝状或多腔,互相交通,缺乏EHE那样的弥漫 实性区域,其肌性管壁及外膜正常,仅内皮细胞 呈乳头状增生,且分化良好。 3.7 治疗及预后
正如WHO定义所表述的那样,骨的EHE为恶 性,故不再推荐使用传统单纯病灶刮除术,而是 充分考虑安全切缘的扩大清除术或瘤段切除术, 加病灶植骨或骨水泥填充,对多灶性或复发病变 可适当加放疗或化疗[15]。即使这样,部分患者仍 有可能复发,甚至转移[2, 15],因此建议患者定期复 查。本文病例1行病灶切除术,术后18月出现原发 部位复发,但未见转移。其余2例经随访均无转移 及复发。
| [1] | Fletcher CDM, Unni KK, Mertens F. Pathology and genetics tumours of soft tissue and bone[M]. Lyon: IARC Press, 2002:225-367. |
| [2] | Fletcher CDM, Bridge JA, Hogendoorn P, et al. WHO classifi cation of tumours of soft tissue and bone[M]. Lyon: IARC Press,2013:2013:335-6. |
| [3] | Stout AP. Hemangio-endothelioma: a tumor of blood vessels featuring vascular endothelial cells[J]. Ann Surg,1943,118(3):445-64. |
| [4] | Weiss SW, Enzinger FM. Epithelial hemangioendothelioma: a vascular tumor often mistaken for a carcinoma[J]. Cancer,1982,50 (5):970-81. |
| [5] | Tsuneyoshi M, Dorman HD, Bauer TW. Epi thel ioid hemangioendothelioma of a bone: a clinicopathologic, ultrastructural, and immunohistochemical study[J]. Am J Surg Pathol,1986,10(11): 754-64. |
| [6] | Yim KL, Sumathi VP, Spooner D. Radiotherapy as an effective primary treatment for epithelioid haemangioendothelioma of the cervical spine[J]. Anticancer Res,2012,32(10):4597-600. |
| [7] | Liu Q, Miao J, Lian K, et al. Multicentric epithelioid hemangioendothelioma involving the same lower extremity: a case report and review of literature[J]. Int J Med Sci,2011,8(7):558-63. |
| [8] | Gómez-Arellano LI, Ferrari-Carballo T, Domínguez-Malagón HR. Multicentric epithelioid hemangioendothelioma of bone. Report of a case with radiologic-pathologic correlation[J]. Ann Diagn Pathol,2012,16(1):43-7. |
| [9] | Bout in RD,Spaeth HJ,Mangal ik A,et al.E pi t hel ioid hemangioendothelioma of bone[J].Skeletal Radiol,1996, 25(4): 391-5. |
| [10] | Makis W, Ciarallo A, Nahal A, et al. Malignant epithelioid hemangioendothelioma of the lower extremity: staging with F-18 FDG PET/CT[J]. Clin Nucl Med,2011,36(7):590-2. |
| [11] | Kleer CG, Unni KK, Mcleod RA. pithelioid hemangioendothelioma of bone[J]. Am J Surg Pathol,1996,20(11):1301-11. |
| [12] | Errani C, Vanel D, Gambarotti M, et al. Vascular bone tumors: a proposal of a classification based on clinicopathological, radiographic and genetic features[J]. Skeletal Radiol,2012,41(12): 1495-507. |
| [13] | Verbeke SL, Bovée JV. Primary vascular tumors of bone: a spectrum of entities?[J]. Int J Clin Exp Pathol,2011,4(6):541-51. |
| [14] | Svejstrup JQ. Synovial sarcoma mechanisms: a series of unfortunate events[J]. Cell,2013,153(1):11-2. |
| [15] | Lau K, Massad M, Pollak C, et al. Clinical patterns and outcome in epithelioid hemangioendothelioma with or without pulmonary involvement: insights from an internet registry in the study of a rare cancer[J]. Chest,2011,140(5):1312-8. |
 2014, Vol.41
2014, Vol.41
