2.青海省人民医院检验科;
3.天津市泌尿外科研究 所
2. Department of Clinical Laboratory, The People’s Hospital of Qinghai;3. Tianjin Institute of Urinary Surgery
现阶段用于microRNA(miRNA)的基因检测多 源于新鲜组织,由于新鲜组织的获得和长期无破 坏保存都不易,因此不能满足相关研究的需要。 本课题前期研究发现在新鲜膀胱尿路上皮细胞癌 (膀胱癌)组织中miR-20a明显高表达[ 1, 2 ]。本研究期 望通过研究膀胱癌石蜡包埋组织中miR-20a的表 达,探索石蜡包埋组织中提取miRNA的可行性, 并回顾性分析miR-20a表达与膀胱癌术后复发之间 是否存在相关性。 1 资料与方法 1.1 资料
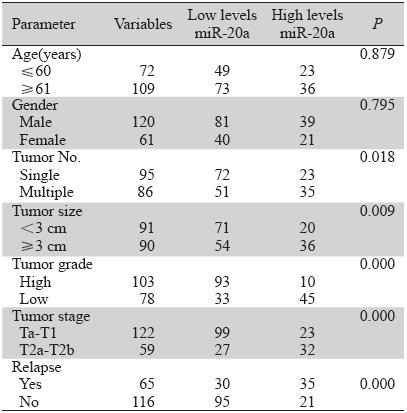
调取2010年50例膀胱癌的新鲜冷冻(-80℃) 保存样品,同时将这50例组织进行石腊包埋处 理,另取5例经输尿管镜取石患者的正常膀胱黏 膜石蜡组织作为对照,其中男3例、女2例,年龄 25~75岁。比较石蜡包埋与新鲜冷冻组织miRNA表 达的相关性。调取2001年2月~2005年2月间临床随 访资料完整的181例膀胱尿路上皮癌的石蜡包埋组 织,另取这5年间20例经输尿管镜取石患者的正常 膀胱黏膜石蜡包埋组织作为对照,其中男15例、 女5例,年龄25~75岁。患者术前均未行放疗、化 疗与免疫治疗,均行膀胱部分切除术或经尿道膀 胱肿瘤电切术、术后均行膀胱灌注吡柔比星或羟 基喜树碱治疗,无全身放化疗患者。181例膀胱尿 路上皮癌石蜡包埋组织中男120例、女61例,年龄 22~85岁、平均65.2岁。组织病理分级按照WHO (2004年)分级标准,其中高分化103例、低分化 78例,见表 1。
石蜡标本总RNA提取试剂盒购自美国ABI公 司;miR-20a和内参U6反转录引物,miR-20a和 U6的引物和荧光探针混合体系,2×PCR TaqMan® Universal PCR,TaqMan®MicroRNA反转录试剂盒 均购自ABI公司。 1.2 方法 1.2.1 基因表达的检测
每份石蜡包埋组织切取 20 μm厚度5片,二甲苯和乙醇脱蜡后,蛋白酶 50℃消化3 h,按试剂盒说明书提取总RNA。核 酸定量仪检测并调整RNA浓度。新鲜组织总RNA 的提取按常规方法进行[ 1 ]。按microRNA反转录试 剂盒说明书,以提取的总RNA为模板,用miR- 20a和U6反转录引物(5×TaqMan®Gene Expression Assay Mix)反转录合成miR-20a和U6第一链,反 应条件:16℃ 30 min,42℃ 30 min,85℃延长5 min;然后按2×PCR TaqMan®Universal PCR试剂 盒说明,以miR-20a和U6第一链为模板,用miR- 20a和U6荧光探针(10×TaqMan®Gene Expression Assay Mix)为引物扩增;反应条件:95℃预变性 10 min,95℃变性15 s,60℃延长60 s,共计40个 循环。以上荧光PCR检测均在7900HT型荧光定量 PCR仪(ABI公司)操作完成,检测方法为相对定 量分析2-ΔΔCt法,每次实验每个样品至少设立3个重 复,重复3次实验。 1.2.2 随访
术后前两年每3月随访一次,第三年 开始每6月随访一次,随访内容包括尿常规、尿脱 落细胞、泌尿系B型超声、膀胱镜检查等。随访时 间截止2010年12月31日。 1.3 统计学方法
采用SPSS11.5软件对数据进行统计处理。 新鲜组织与石蜡包埋组织中miR-20a分析比较用 Wilcoxon秩和检验;不同年度间组织miR的表达用 Kruskal-Wailis H检验; miR-20a表达与临床病理特 征的分析采用χ2检验;分析复发率由Kaplan-Meier 法评估,用Cox回归进行多因素分析,Log rank法 检验单因素对复发率影响的差异,以P<0.05为差 异有统计学意义。 2 结果 2.1 miR-20a在膀胱肿瘤中的表达
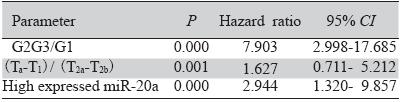
新鲜组织和石蜡组织中miR-20a的表达都明显 升高,石蜡组织和新鲜组织之间的表达存在明显 相关性(r=0.792,P=0.000),见图 1;不同年度 间石蜡组织的miR-20a表达稳定,相对表达量中 位数均在1.4附近,差异无统计学意义(H=22.636, P=0.533),见图 2,可见miR-20a的2-ΔΔCt值的中位 数均在1.4附近。为定量分析miR-20a表达量对临床 病理特征的影响,我们将miR-20a的2-ΔΔCt值≥1.5 定为高表达,<1.5为低表达;石蜡组织中miR-20a 表达与临床病理的相关分析,见表 1;将表 1用Cox 多因素回归分析,结果显示:肿瘤分期、肿瘤分 化、miR-20a高表达3个因素是术后复发的独立因 素,见表 2。
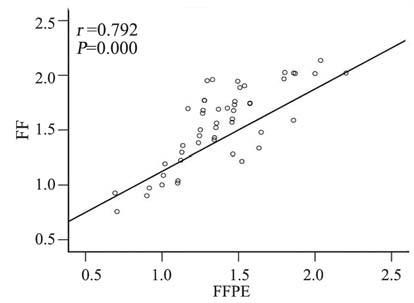 |
miR-20a was significantly associated between the FF and their corresponding FFPE tissues.(FF:freshly frozen,FFPE:formalin-fixed paraffi n-embedded) 图 1 miR-20a在石蜡组织和新鲜组织之间表达的相关性 分析 Figure 1 Correlation analysis of miR-20a expression between fresh frozen and FFPE tissue samples |
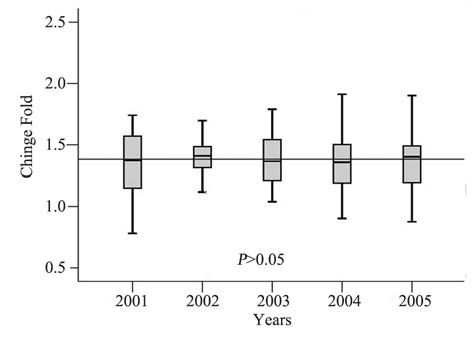 |
图 2 miR-20a在不同年度石蜡组织之间表达的一致性分析 Figure 2 The consistency analysis of expression levels of miR-20a in different years in FFPE tissues |
|
|
表 1 石腊包埋组织中miR-20a表达与临床病理的分析 Table 1 Clinicopathological parameters for patients with bladder transitional cell carcinoma and their associations with the levels of miR-20a (P-value was calculated by χ2 test) |
|
|
表 2 影响术后复发因素的Cox回归分析结果 Table 2 Multivariate Cox regression analysis of overall relapse factors |
随访时间6~60月,平均随访35.7月,181例患 者中共有65例复发,复发率为35.91%。其中高表 达miR-20a的56例患者中有35例复发,复发率为 62.50%,平均复发时间为13.11月;Log rank法检 验miR-20a低表达和高表达之间差异有统计学意义 (P=0.000),见图 3。
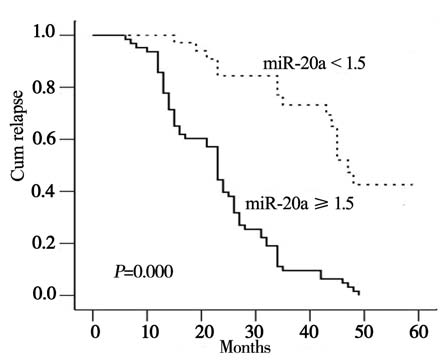 |
图 3 miR-20a表达与复发的相关分析 Figure 3 The correlation analysis of miR-20a expression and relapse |
miRNA是由DNA转录产生的非编码小RNA 序列,由约18~25个核苷酸组成,不翻译生成蛋 白质,通过碱基互补的方式结合到靶信使RNA (mRNA)的3′非翻译区,从而抑制其翻译,但不影 响其转录[ 3 ]。通过转录后基因沉默效应调控多种 抑癌基因或癌基因的表达,起促癌和抑癌的双向 作用。微阵列研究证实,每个miRNA可以调控上 百个基因的表达,即一个miRNA能靶向作用于上 百个mRNA,而且多个miRNA也能作用于同一个 mRNA[ 4 ],传统上新鲜组织一直是miRNA检测来源 的“金标准”,但在研究实践中,新鲜组织大量获 取和无破坏的长期保存相对困难,且新鲜组织的 临床资料相对不完整。临床资料比较完整的病例 其病理材料大部分都是石蜡包埋组织,而且获取 和保存相对容易,因此研究人员开始探索在石蜡 组织中提取miRNA,国内外已有研究认为石蜡包 埋组织处理过程对miRNA自溶、交联、断裂的影 响较小[ 5, 6 ]。本研究也认为石蜡包埋组织中miRNA 可被提取并通过荧光PCR法精确定量,miRNA在 新鲜组织与石蜡组织间具有良好的相关性,不同 年度间石蜡组织的miRNA表达也基本稳定,具有 可比性。本研究证实经石蜡包埋组织提取miRNA 是可行的,石蜡包埋处理及长期存放对组织中 miRNA的研究无明显影响。通过临床资料完整 的、数量丰富的石蜡包埋组织对miRNA进行研 究,将进一步揭示miRNA的生物学作用。
miRNA通过转录后基因沉默效应不仅决定靶 蛋白的转录与否,而且可以精细调节靶蛋白的产 量[ 7 ],同时靶蛋白也对miRNA具有调节作用[ 8 ],二 者相互作用、精细调节细胞的生命活动,以防止 如肿瘤等过度增殖性疾病的发生。miRNA在基因 组上的分布是成簇的,通过一个共同的启动子被 转录[ 9 ]。miR-20a是mir-17-92基因簇的成员,研究 发现miR-20a在许多肿瘤组织中有明显变化[ 10 ]。细 胞实验证实抑制miRNA-20后,细胞凋亡增加,推 测miRNA-20可能有促癌作用[ 11, 12 ]。本研究发现: 相对正常组织,miR-20a在膀胱移行细胞癌中的表 达升高,这种升高与肿瘤的病理分期、临床分期 以及肿瘤大小和直径都密切相关,在Cox多因素 分析中,如miR-20a在肿瘤中表达升高超过正常值 1.5倍,则患者可能处于一种疾病进展的状态,即 容易复发。如表达不到1.5倍,患者可能处于一种 疾病静止的状态;因此miR-20a可能在膀胱癌中 有双向作用,其抑癌或是促癌效应取决于表达量 的多少。已有一项引入数理推论的研究[ 13 ]显示: miRNA的活性调控可能与其各自表达量有重要关 系,各自有相应的阈浓度,各调节因子数量的失 衡很可能是调节失控的始动因素,并试图建立数 学预测模型,本研究也支持了这种可能性。
本研究认为一种miRNA对癌变细胞起抑制或 促进作用不但取决于表达的组织,也取决于其表 达量的多少。再次证明了miRNA对细胞生命活 动的调节是非常精细的。对miRNA的研究不但 要定性,而且需要精确的定量,才能进一步明确 miRNA的生物学功能。因此下一步的重点是研究 其可能的靶基因和靶蛋白,完整地阐明miR-20a的 调控机制。
| [1] | Ren HL, Sun Y, Li SB, et al.The correlation of E2F3, miR-17-5p and miR-20a in transitional cell carcinoma of bladder[J]. Zhonghua Mi Niao Wai Ke Za Zhi, 2012, 33(4):264-7.[任海林, 孙岩, 李世斌,等.膀胱尿路上皮癌细胞株E2F3基因与miR-17-5p和miR-20a的相互作用[J].中华泌尿外科杂志,2012,33(4):264-7.] |
| [2] | HaiLin Ren, Yan Sun, XiaoNa Li, et al. Expression of E2F3, miR-17-5p, miR-20a and their interplay in bladder cancer[J]. Afri J Biotech,2011,10 (53):11028-32. |
| [3] | Lewis BP, Shih IH, Jones-Rhoades MW, et al. Prediction of mammalian microRNA targets[J]. Cell,2003,115(7):787-98. |
| [4] | Lim LP, Lau NC, Garrett-Engele P, et al. Microarray analysis shows that some microRNAs downregulate large numbers of target mRNAs[J]. Nature, 2005, 433(7027):769-73. |
| [5] | Zhang X, Chen J, Radcliffe T, et al. An Array-based analysis of microRNA expression comparing matched frozen and formalinfixed paraffin-embedded human tissue samples[J]. J Mole Diagn,2008,10(6):513-9. |
| [6] | Xi Y,Nakajima G,Gavin E, et al.Systematic analysis of microRNA expression of RNA extracted from fresh frozen and formalin-fixed paraffi n-embedded samples[J]. RNA,2007,13(10):1668-74. |
| [7] | Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell,2009,136(2):215-33. |
| [8] | Bueno MJ, Gómez de Cedrón M, Laresgoiti U, et al. Multiple E2F-induced microRNAs prevent replicative stress in response to mitogenic signaling[J]. Mol Cell Biol,2010,30(12):2983-95. |
| [9] | Altuvia Y, Landgraf P, Lithwick G,et al. Clustering and conservation patterns of human microRNAs[J].Nucleic Acids Res,2005,33(8):2697-706. |
| [10] | He L, Thomson JM, Hemann MT, et al. A microRNA polycistron as a potential human oncogene[J]. Nature, 2005,435(7043):828-33. |
| [11] | Sylvestre Y, De Guire V, Querido E, et al. An E2F/miR-20a autoregulatory feedback loop[J].J Biol Chem,2007,282(4): 2135-43. |
| [12] | Matsubara H, Takeuchi T, Nishikawa E, et al. Apoptosis induction by antisense oligonucleotides against miR-17-5p and miR-20a in lung cancers overexpressing miR-17-92[J]. Oncogene, 2007,26(41):6099-105. |
| [13] | Aguda BD,Kim Y,Piper-Hunter MG,et al.MicroRNA regulation of a cancer network: consequences of the feedback loops involving miR-17-92,E2F,and Myc[J].Proc Natl Acad Sci U S A, 2008,105(50):19678-83. |
 2014, Vol.41
2014, Vol.41