2.解放军八一医院全军肿瘤中心肿瘤内 科;
3.蚌埠医学院第一附属医院病理科病理科
2. Department of Medical Oncology, PLA Cancer Center, Bayi Hospital;
3. Department of Pathology, The First Affi liated Hospital of Bengbu Medical College
胆管癌是起源于胆管上皮细胞的恶性肿瘤, 近年来发病率呈上升趋势[1]。 胆管癌恶性程度 高、发展迅速,临床上难于早期发现,另外由 于胆管癌所在解剖部位复杂使得手术切除率很 低;而且一般的放、化疗疗效不满意,胆管癌预 后非常差。至今仍缺乏有效的早期诊断手段和 分子生物学标记,其诊治水平一直未能取得突破 性进展[2]。从肿瘤生物学的角度寻求更好、更准 确的预测转移和预后指标是目前的研究热点。本 研究通过免疫组织化学测定肝癌组织中鼠双微体 基因2(murine double minute 2,MDM2)和第 10号染色体缺失的磷酸酶张力蛋白同源物基因 (gene of phosphate and tension homology deleted on chromsome ten,PTEN)的表达,并探讨它们与临 床病理特征以及这两个指标之间的关系。 1 资料与方法 1.1 一般资料
收集2007年1月—2010年12月蚌埠医学院第一 附属医院外科住院并行手术治疗的胆管癌患者资 料,选择其中临床资料完整的胆管癌患者42例, 癌旁22例,均经病理检查确诊,术前均未行放化 疗。男33例,女9例;年龄32~76岁,中位年龄55 岁;按AJCC的TNM分期标准:Ⅰ期7例,Ⅱ期11 例,Ⅲ期24例。按WHO病理分级标准:高分化癌 10例,中分化癌25例,低分化癌7例;局部淋巴结 转移:有转移10例,无转移32例。22例癌旁组织 取自距肿瘤边缘约1.0 cm的组织。BDC组织样本经 10%福尔马林固定,常规石蜡包埋。4 μm厚连续 切片,每个样本至少三张,分别用于HE染色和免 疫组织化学染色。 1.2 主要试剂和方法 鼠抗人PTEN单克隆抗体购自美国DAKO公 司,鼠抗人MDM2单克隆抗体购自Santa Cruz公 司,Elivision TM plus KIT-9903(A、B)检测试 剂购自福州迈新生物技术开发公司。采用免疫组 化Elivision法检测MDM2与PTEN蛋白表达,具体 步骤按试剂盒说明书进行操作[2]。用已知的MDM2 和PTEN阳性切片作为阳性对照,用磷酸盐缓冲液 PBS代替一抗作为阴性对照。 1.3 结果判定
参考Lotan等提出的标准判断结果[3, 4],由两名 病理专家独立评价。简述如下:细胞核及胞质出 现棕黄色颗粒为阳性(+),无棕黄色颗粒为阴性 (-)。同一切片中随机选择10个高倍野,每个高 倍野考察100个癌细胞,计算阳性细胞的百分数,如果阳性细胞百分比<10%,则为(-),阳性细 胞百分比≥10%为(+)。 1.4 统计学方法
应用SPSS13.0 统计分析软件进行数据分析, 各组免疫组织化学计数资料间以χ2检验或Fisher精 确法进行检验,MDM2和PTEN之间的相关性采用 Spearman等级相关分析,均以P<0.05认定为差异 有统计学意义。 2 结果 2.1 MDM2蛋白表达与临床病理特征的关系
MDM2蛋白的阳性信号为棕黄色颗粒状,主 要定位于细胞核,阳性染色细胞见图 1C和1D。在 42例胆管癌样本中,有16例MDM2表达为阳性, 阳性率为38.1%;在22例癌旁组织样本中,MDM2 呈阴性表达。MDM2表达在胆管癌和癌旁组织之 间差异有统计学意义(P<0.05)。
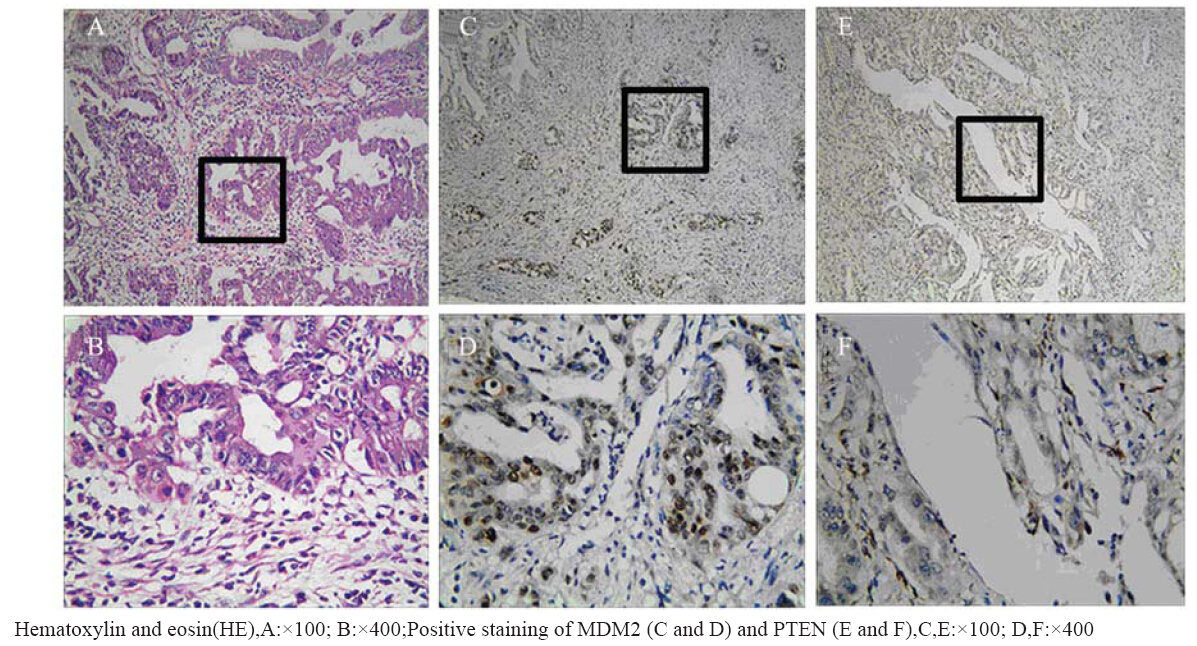 |
图 1 胆管癌的HE染色以及MDM2和PTEN在胆管癌组织中的阳性表达 Figure 1 Hematoxylin and eosin (HE) staining and positive expressions of MDM2 and PTEN in BDC |
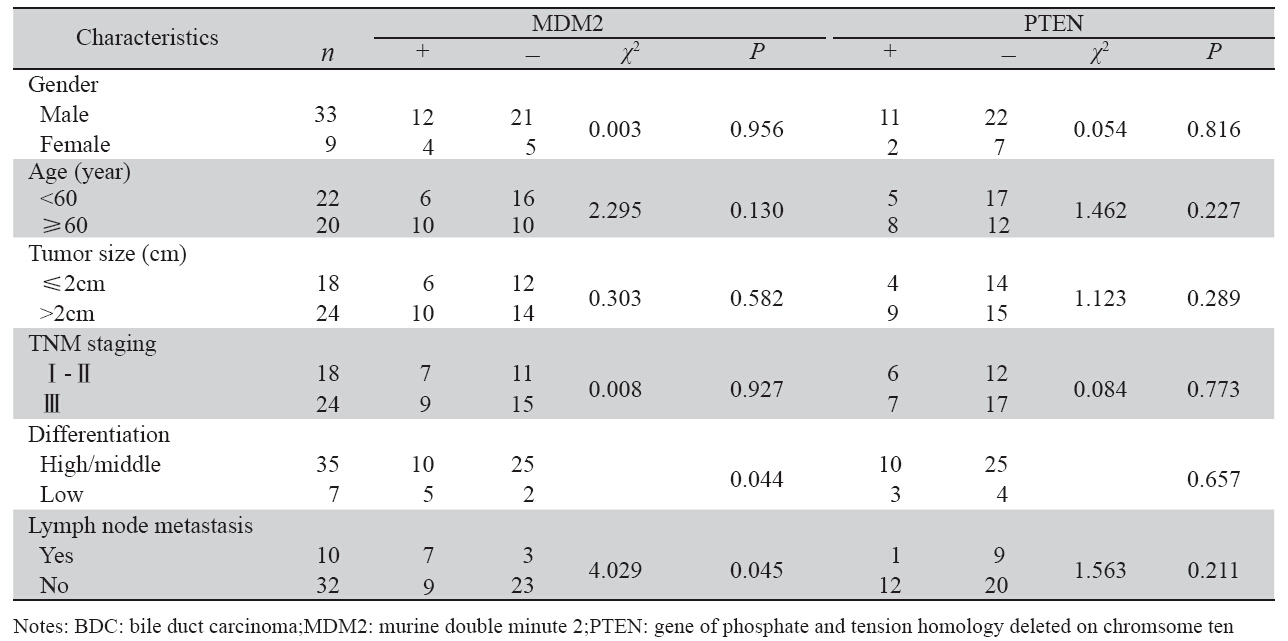
MDM2表达与临床病理特征之间的关系见表 1。 结果显示MDM2表达与分化程度、淋巴结转移有 关(P<0.05),但与患者的性别、年龄、肿瘤大 小和TNM分期无关(P>0.05)。
|
|
表 1 MDM2和PTEN表达与胆管癌临床病理参数之间的关系 Table 1 Correlation between the expressions of MDM2 and PTEN and clinicopathological parameters in BDC |
PTEN蛋白的阳性信号为棕黄色颗粒状,主要 定位于细胞质,阳性染色细胞见图 1E和图F。在 42例胆管癌样本中,13例PTEN表达为阳性,阳性 率为30.95%;在22例癌旁组织样本中,16例PTEN 表达阳性,阳性率为72.73%。PTEN在胆管癌组 织中的表达明显低于癌旁组织(χ2=10.168,P<0.05)。
PTEN表达与临床病理特征之间的关系见表1。 结果显示PTEN表达在患者性别、年龄、肿瘤大小 和分化程度、TNM分期以及淋巴结转移等临床病 理参数上差异均无统计学意义(P>0.05)。 2.3 MDM2与PTEN蛋白表达的相关性
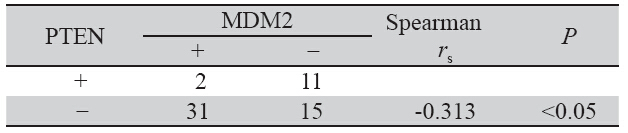
在42例胆管癌样本中,MDM2与PTEN的表达 呈显著负相关(rs=-0.313,P<0.05),见表 2。
|
|
表 2 胆管癌组织中MDM2与PTEN表达的相关性 Table 2 Relationship between the expressions of MDM2 and PTEN in BDC |
癌基因和抑癌基因的表达失常或失衡所导致 的细胞信号转导紊乱、细胞无控增殖在肿瘤的发 生、发展和转归上具有关键性作用。如前所述, 大量研究表明,抑癌基因PTEN、癌基因MDM2在 多种肿瘤中均有异常表达,并且在调节肿瘤细胞 生长、分化、侵袭转移和肿瘤血管新生等各方面 均有重要作用[5, 6]。本研究考察了MDM2和PTEN在 胆管癌和癌旁组织中的表达,发现MDM2和PTEN 的蛋白表达在胆管癌及癌旁组织中有显著差异, 且MDM2表达与部分反映预后不良的临床病理参 数有关。PTEN表达与临床病理参数无相关性。
PTEN基因位于10q23,是目前发现的第一个具有双特异性蛋白磷酸激酶活性的抑癌基因,可 通过对抗PI3K的功能,抑制PI3K/Akt通路,进而 阻断Akt及其下游激酶的活性,发挥调控细胞的生 长和凋亡的作用[7]。目前已在乳腺癌、卵巢癌、前 列腺癌等多种肿瘤组织中发现PTEN基因及蛋白表 达异常[8, 9, 10]。本研究结果显示,PTEN蛋白在胆管 癌组织中的表达明显低于癌旁组织(P<0.05), 与Chung等[11]测定结果一致,提示PTEN功能失活 或编码蛋白的缺失可能会诱导胆管癌组织癌变, 其机制还有待进一步研究。本研究还显示PTEN 表达与肿瘤大小、组织分化和淋巴结转移等均无 明显相关性,Chung等[11]研究表明PTEN表达在肿 瘤组织分化差、临床分期晚的胆管癌样本中显著 降低。这种差异可能是由于实验技术方法不同, 或人种不同,以及各级病例数分布不均等因素所 致。
MDM2为鼠双微体基因,是一种原癌基因,可 与P53形成反馈调节环路,参与调控细胞生长。目 前已经证实MDM2在多种恶性肿瘤中发生了基因 突变、扩增、过表达[12, 13, 14, 15],且其与恶性肿瘤的生物 学行为、不良预后相关。关于MDM2在胆管癌中的 表达国内尚无报道,通过本研究发现,MDM2蛋白 表达率在胆管癌组织中显著升高,其表达与分化 程度、淋巴结转移有关,与其他病理特征无关。这 一现象提示MDM2的基因扩增可能与胆管癌的恶 性程度及转移侵袭有关。Jarnagin等[16]研究表明在 包括起源于肝内胆管癌、肝门胆管癌以及远端胆 管癌在内的胆道腺癌中,MDM2均呈过表达。他们的研究认为在胆管癌R0切除后,MDM2的过表 达与胆管癌远处复发的高风险率有关,且可独立 预测胆管癌患者的生存率。这些结果说明MDM2 有可能作为胆管癌预后不良的指标。然而,我们 只通过IHC方法测定了MDM2的蛋白表达,其异常 表达的分子机制有待于进一步研究。
目前认为,MDM2蛋白在细胞质合成后,在 核定位信号的引导下从细胞质进入细胞核,这一 过程需要PI3K/Akt信号转导途径的参与,PTEN 对该途径的负调控阻止了MDM2蛋白由胞质进 入胞核,从而加速该蛋白的降解[17],进而解除了 MDM2对P53的抑制作用。本研究发现BDC中二者 均为阳性2例,MDM2(﹣)PTEN(+) 11 例, MDM2(+)PTEN(﹣)14例,MDM2(﹣) PTEN(﹣)15例,MDM2和PTEN蛋白表达之间 呈负相关性,提示在胆管癌中,MDM2的过表达 与PTEN基因的失活具有密切关系。
综上所述,本研究发现MDM2在胆管癌组织 中的表达异常升高,而PTEN在胆管癌组织中的表 达异常降低,且MDM2的表达与预后不良有关。 MDM2有可能作为评价胆管癌预后的指标。
| [1] | Khan SA,Thomas HC,Davidson BR,et al.Cholangiocarcinoma[J]. Lancet,2005,366(9493):1303-14. |
| [2] | Blechacz BR,Gores GJ.Cholangiocarcinoma[J].Clin Liver Dis,2008,12(1):131-50. |
| [3] | Chrisanthar R,Knappskog S,L?kkevik E,et al. Predictive and prognostic impact of TP53 mutations and MDM2 promoter genotype in primary breast cancer patients treated with epirubicin or paclitaxel[J].PLoS One,2011,6(4):e19249. |
| [4] | Lotan TL,Gurel B,Sutcliffe S,et al.PTEN protein loss by immunostaining: analytic validation and prognostic indicator for a high risk surgical cohort of prostae cancer patients[J].Clin Cancer Res,2011,17(20):6563-73. |
| [5] | Sugano N,Suda T,Godai TI,et al.MDM2 gene amplification in colorectal cancer is associated with disease progression at the primary site,but inversely correlated with distant metastasis[J]. Genes Chromosomes Cancer,2010,49(7):620-9. |
| [6] | Zhang MF, Zhang ZY, Fu J, et al.Correlation between expression of p53, p21/WAF1,and MDM2 proteins and their prognostic signifi cance in primary hepatocellular carcinoma[J].J Transl Med, 2009,7:110. |
| [7] | Martelli AM, Evangelisti C, Chappell W, et al.Targeting the translational apparatus to improve leukemia therapy: roles of the PI3K/PTEN/Akt/mTOR pathway[J].Leukemia,2011, 25(7):1064-79. |
| [8] | Baig RM,Mahjabeen I,Sabir M,et al.Genetic changes in the PTEN gene and their association with breast cancer in Pakistan[J]. Asian Pac J Cancer Prev,2011,12(10):2773-8. |
| [9] | Govender D,Chetty R.Gene of the month:PTEN[J]. J Clin Pathol, 2012,65(7): 601-3. |
| [10] | Skírnisdóttir I,Seidal T. Prognostic impact of concomitant p53 and PTEN on outcome in early stage (FIGO I-II) epithelial ovarian cancer[J].Int J Gynecol Cancer,2011,21(6):1024-31. |
| [11] | Chung JY,Hong SM,Choi BY,et al.The expression of phospho-AKT, phospho-mTOR,and PTEN in extrahepatic cholangiocarcinoma[J].Clin Cancer Res,2009,15(2):660-7. |
| [12] | Noon AP, Vlatkovi? N, Polański R,et al. p53 and MDM2 in renal cell carcinoma: biomarkers for disease progression and future therapeutic targets?[J]. Cancer, 2010, 116(4):780-90. |
| [13] | Sharifi -Sistani N,Zartab H, Babakoohi S,et al.Immunohistochemical comparison of the expression of p53 and MDM2 proteins in ameloblastomas and keratocystic odontogenic tumors[J].J Craniofac Surg,2011,22(5):1652-6. |
| [14] | Cui JJ,Han XL,Wang WM.Expression and signifi cance of p53 and mdm2 in patients with leukoplakia cancer[J].Asian Pac J Trop Med,2013,6(10):831-4. |
| [15] | Epistolato MC,Disciglio V,Livide G,et al.p53 Arg72Pro and MDM2 309 SNPs in hereditary retinoblastoma[J].J Hum Genet, 2011,56(9):685-6. |
| [16] | Jarnagin WR,Klimstra DS,Hezel M,et al.Differential cell cycleregulatory protein expression in biliary tract adenocarcinoma: correlation with anatomic site, pathologic variables, and clinical outcome[J]. J Clin Oncol,2006,24(7):1152-60. |
| [17] | Li Y,Guessous F,Kwon S,et al.PTEN has tumor-promoting properties in the setting of gain-of-function p53 mutations[J]. Cancer Res,2008,68(6):1723-31. |
 2014, Vol.41
2014, Vol.41