2.儿科,
3.普外科
2.Department of Pediatrics,
3.Department of General Surgery
结肠癌是常见的消化道恶性肿瘤,随着生活 水平的提高和环境的恶化,发病率已呈逐年上升的趋势。尽管治疗方法有了很大的进步,但总体 死亡率仍然很高。肿瘤的侵袭和转移是患者死亡 的主要原因之一。资料显示临床上约有50%的大肠 癌患者虽然经过有效的治疗,但最终仍然死于肿 瘤的侵袭和转移[1] 。癌胚抗原 (CEA)在结肠癌预后 判断、疗效观察以及复发和转移的监测中是最常 用的肿瘤标志物。本课题组前期研究发现miR-155 在结肠癌组织中表达增高,可能作为原癌基因参 与结肠癌的发生、发展,与结肠癌的侵袭、转移密切相关[2]。但miR-155能否成为一个新的肿瘤标 志物以便于为临床提供更多的诊断价值,目前国 内外鲜有这方面的临床和实验报告,为此,本实验 通过分析miR-155与CEA的相关性,探讨miR-155 在结肠癌疗效观察预后判断以及复发和转移的监 测等方面的价值,为临床寻找一种新的、理想的结 肠癌肿瘤标志物提供理论基础和实验依据。 1 资料与方法 1.1 一般资料
选取2009年3月至2010年12月湖北文理学院 附属医院普外科手术切除的原发性结肠癌标本84 例,每例均有癌旁组织(取材部位距离肿瘤边缘至 少2 cm)。其中男性46例、女性38例,中位年龄为 59岁。所有入选病例均经病理确诊,术前均未行 放、化疗。切除的标本30 min内放入液氮罐保存, 长期保存转至-70℃冰箱。 1.2 试剂与仪器
Trizol RNA提取试剂和反转录(RT)试剂盒购 自美国Invitrogen公司,miR-155和U6 snRNA qRTPCR 检测试剂盒均购自上海吉玛制药技术有限公 司,PCR扩增仪采用罗氏LightCycler;血清CEA 检测采用雅培i2000化学发光仪及雅培原装试剂。 CEA升高是指CEA>5 ng/ml。 1.3 组织总RNA的抽取
结肠癌组织及癌旁组织总RNA的提取采用 Trizol试剂一步提取法,实验步骤严格按照试剂说 明书进行。紫外分光光度仪检测RNA溶液OD260、 OD280的吸光度值,计算RNA浓度和纯度。另外用 1%琼脂糖凝胶电泳法检测RNA的完整性。 1.4 反转录反应
由于miRNAs长度仅有20个核苷酸左右,不能 用传统的qRT-PCR检测。本实验采用上海吉玛制药 技术有限公司提供的miR-155检测试剂盒(HairpinitTM miRNAs RT-PCR Quantitation Kit),内含针 对miR-155特异的茎环结构反转录引物。1 μl上述 提取的总RNA以此茎环引物进行反转录反应。取 特异性茎环引物2 μl,提取的总RNA1 μl,10 mM dNTP混合物1 μl,加灭菌蒸馏水至12 μl,混匀后 在65℃加热5 min,迅速置于冰上冷却,瞬时离心 后加入5×第一链合成缓冲液4 μl,0.1M DTT2μl和 RNaseOUTTM核酸酶抑制剂1 μl,混匀后在37℃ 水域中孵育2 min;在室温下加入M-MLV反转录 酶1 μl,轻轻吹打混匀。37℃孵育50 min,最后 70℃加热15 min以终止反应。反应结束后反转录产 物-20℃保存备用。U6snRNA作为内参,同样进行 上述反转录反应,反转录产物-20℃保存备用。 1.5 实时荧光定量PCR
采用上海吉玛制药技术有限公司提供的 miR-155检测试剂盒,内含TaqDNA聚合酶,PCR反应缓冲液和特异的miR-155上下游引物。上游 引物为5’-ACGCTCAGTTAATGCTAATCGTGATA -3’,下游引物为5’-ATTCCATGTTGTCCACTGTC TCTG-3’。片段长度84 bp。取2×PCR Buffer 10 μl, miR-155上下游引物(5 μM)0.36μl,cDNA 2 μl, 5 u/μlTaq聚合酶0.2 μl,反应体系为20 μl。反应条 件为:95℃ 3 min;95℃20 s,60℃ 50 s共40个循 环。记录每个反应管中的荧光信号到达所设定的 阈值时所经历的循环数即Ct值。U6 snRNA作为内 参,同样进行上述定量PCR反应,其上游引物为 5’-ATTGGAACGATACAGAGAAGATT-3’;下游引 物为5’-GGAACGCTTCACGAATTTG-3’。片段长 度70 bp。采用实时定量PCR中的相对定量法,以 N=2-△△Ct表示肿瘤组织miR-155表达相对于配对的 癌旁组织的变化倍数,其中△△Ct=(CtmiR155-CtU6)肿瘤- (CtmiR155-CtU6)癌旁。 1.6 随访
术后患者出院前检测一次血清CEA水平。随 访时间定为2年,期间每2月查一次血清CEA水 平,血清CEA水平降到最低值后转而升高(持续 半年以上)的时间,记为术后血清CEA水平再次 增高的时间。术后每6月一次肠镜、胸部X线、B 超或腹部CT检查,以确诊患者是否出现复发转 移。随访方式主要采取门诊复查、电话访问。随 访应不影响患者采取适当的治疗方式。 1.7 统计学方法
应用SPSS13.0统计学软件进行统计学分析, 结果用 x±s表示,两组之间计量资料样本比较采 用独立样本t检验,率的比较采用卡方检验。双 变量计量资料相关性分析用Pearson相关检验。以 P<0.05为差异有统计学意义。 2 结果 2.1 miR-155在结肠癌组织中的表达
miR-155及U6实时定量PCR扩增产物的熔解曲 线显示为单峰,说明茎环RT-PCR能扩增相应的目 的基因,见图 1。定量PCR产物在2.5%琼脂糖凝胶 电泳呈单一条带,进一步验证了反应的特异性。 结果显示,在84例结肠癌组织中,相对于癌旁组 织对照,65例miR-155表达上调,其中24例上调大 于4倍,11例上调大于8倍;miR-155在结肠癌中的 表达水平(N=2-△△Ct)为4.03±2.95倍,明显高于对应 癌旁组织,见表 1。
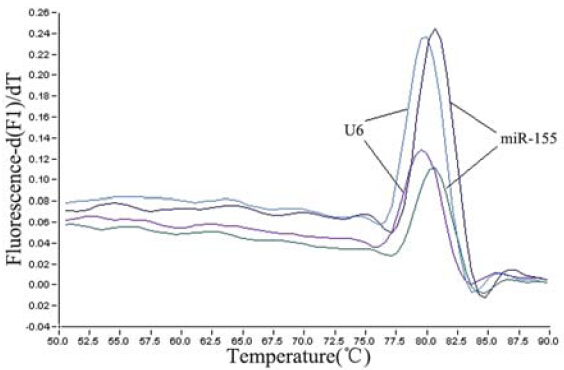 |
图 1 miR-155及U6实时定量PCR扩增产物的的熔解曲线 Figure 1 Melting curves of miR-155 and U6 amplifi cation products detected by real-time quantifi cation PCR |
|
|
表 1 miR-155、U6在结肠癌和癌旁组织的Ct值 Table 1 Ct values of miR-155 and U6 in colon cancer and normal adjacent tissues |
选取癌组织miR-155的表达倍数大于1的65例 病例,绘制以术前血清CEA水平的对数值为横坐 标,癌组织miR-155的相对表达倍数对数值为纵坐 标的散点分布图,见图 2。经Pearson相关性分析, 癌组织miR-155的表达倍数与血清CEA水平呈正相 关(r=0.708,t=7.959,P<0.01)。
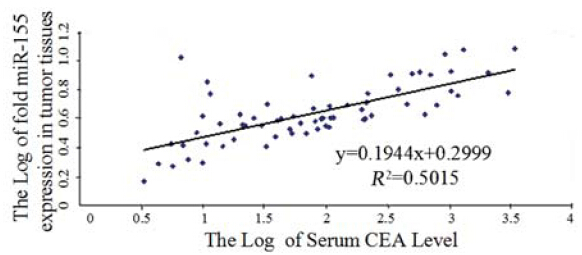 |
图 2 结肠癌组织中miR155表达与术前血清CEA分布散点图 Figure 2 Scatter diagram of miR-155 expression and preoperative serum CEA levels in colon cancer tissues |
随访2年内,24例患者术后血清CEA水平出 现增高,选取术后血清CEA出现增高的这24例患 者,以术后血清CEA水平出现增高的时间为横坐 标,癌组织miR-155的表达倍数为纵坐标绘制散 点分布图,见图 3。经Pearson相关性分析,癌组 织miR-155的表达倍数与术后血清CEA水平出现增高的时间呈明显负相关(r=-0.819,t=5.4920和 P<0.01)。
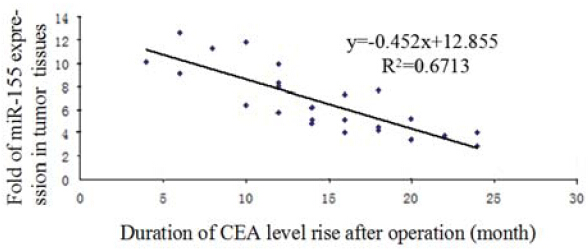 |
图 3 结肠癌组织中miR155表达与术后血清CEA水平出现 增高的时间分布散点图 Figure 3 Scatter diagram of miR-155 expression in colon cancer tissues and the time of serum CEA levels increasing after operation |
随访2年内,获知结论(是否复发转移)的病 例为68例,其中出现复发或转移(与病患死亡无 关)有19例,复发转移率为27.94%。其中肝转移 7例(10.29%) ,肺转移2例(2.94%) ,淋巴结转移5 例(7.35%),吻合口复发2例(2.94%),腹(盆)腔 转移3例(4.41%) 。复发转移组癌组织中miR-155 表达水平为6.06±3.73倍,未复发转移组癌组织中 miR-155表达水平为3.62±2.55倍,两组比较差异有 统计学意义(P=0.0144<0.05),见图 4。术后血 清CEA水平出现增高时间≤24月的24例患者中有11 例复发转移,阳性率为45.8%;术后血清CEA水平 出现增高的时间>24月的44例患者中有8例复发转 移,阳性率为18.2%;两者比较差异有统计学意义 (χ2=5.89,P<0.05),见表2。
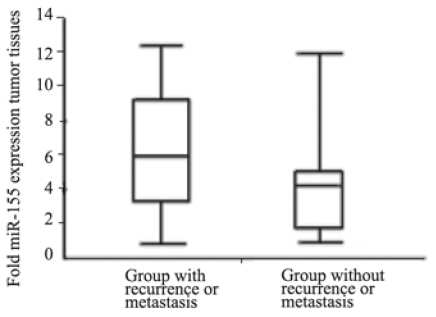 |
图 4 miR-155在术后复发转移组和未复发转移组结肠癌组 织中的表达 Figure 4 miR-155 expressions in group with recurrence or metastasis and group without recurrence or metastasis in colon cancer tissue after operation |
|
|
表 2 术后血清CEA水平再次增高的时间与术后肿瘤复发 或转移的关系 Table 2 Correlation between the time of serum CEA level increasing again after operation and tumor recurrence or metastasis |
结肠癌的发生发展是癌基因激活和抑癌基因 失活共同作用的结果,其确切的发病机制尚未完 全清楚。近年发现,miRNAs与恶性肿瘤密切相 关,主要通过与目标miRNA分子的3’端非编码 区域特异结合来抑制转录后的翻译。约52%调控 miRNAs的编码基因位于肿瘤相关基因位点和染色 体区域[3]。因此miRNAs可能成为诊断肿瘤的新的 分子标志和判断肿瘤治疗及预后的分子靶点[4, 5]。miR-155是最早被证实有促癌作用的microRNA分 子之一,其在乳腺癌[6]、肺癌[7]、结肠癌[8]、胰腺 癌[9]和肝癌[10]等多种肿瘤中表达上调。此外,高表 达的miR-155与肺癌和胰腺癌的预后有关 [11]。
本研究利用茎环qRT-PCR技术检测miR-155 在结肠癌组织中的表达水平。结果显示,在84例 结肠癌组织中,miR-155在结肠癌中的表达水平为 4.03±2.95倍,明显高于对应正常黏膜组织。说明 miR-155在结肠癌组织中的表达明显上调,提示 miR-155与结肠癌的发生、发展密切相关。国内 Wang等[12]采用miRNA微阵列分析和Q-RT-PCR两 种方法检测结肠癌中的miRNA表达,也得出了相 同的结论。Bakirtzi等[8]通过动物实验证实,沉默 miR-155不仅可以阻止肿瘤细胞团的形成,还可以 减慢肿瘤细胞的生长速度,进一步证实miR-155参 与了结肠癌的发生、发展过程。
本实验通过随访发现,结肠癌组织中miR155 表达与术后肿瘤的复发或转移密切相关,由此可 以认为miR-155表达水平越高,术后肿瘤复发或转 移的几率就越高,患者的预后就越差。研究提示 检测结肠癌组织中miR-155的表达对预测术后肿瘤 的复发或转移有重要价值。目前miR-155在肿瘤浸 润转移中的具体作用机制尚未完全阐明,国外学 者对此进行了诸多研究。Kong等[13]研究证实肿瘤 转化生长因子通过miR-155作用于RhoA蛋白,参 与了乳腺癌细胞的转移。Gironella等[14]研究认为, miR-155在胰腺癌异常高表达,可能是通过抑制 TP53INP1的mRNA功能,导致其表达下降,从而 促进肿瘤细胞增殖,抑制肿瘤细胞的凋亡。这些 作用机制是否同样存在于结肠癌中有待进一步实 验证明。miR-155的出现为结肠癌转移的预防和治 疗提供了新的研究方向。
血清CEA是目前应用最广泛的肿瘤标志物之 一,在结肠癌、直肠癌、肺癌、胰腺癌、胃癌、 乳腺癌、肝癌及其他恶性肿瘤有不同程度的阳性 率,以在结、直肠癌患者中升高最显著。术后 血清CEA动态检测对结直肠癌术后复发转移的 监测有重要意义[15]。实验研究发现结肠癌组织中 miR-155表达与血清CEA呈明显正相关性,与术后 血清CEA出现增高的时间呈明显负相关,这提示 在结肠癌发生、发展过程中,癌组织中miR155表 达越高,其血清CEA水平就越高,术后血清CEA 再次增高的时间就越短;同时本实验还发现术后 血清CEA水平再次增高的时间越短,肿瘤越容易 出现复发或转移。联合检测结肠癌组织中miR155 表达与术前术后血清CEA水平可以为临床疗效观 察、预后判断提供更加准确的信息,尤其在预测术后肿瘤的复发转移中有重要的价值。
| [1] | Saletti P,Cavalli F,et al. Metastatic colorectal cancer[J].Cancer Treat Rev,2006,32(7):557-71. |
| [2] | Cao HL,Huang SH,Liu AH, et al. Expression of miR-155 and its clinical signifi cance in tissues of colonic cancer[J].Zhonghua Xiao Hua Wai Ke Za Zhi,2013,12(6):440-2.[曹红亮,黄少军,刘爱华,等. miR-155在结肠癌组织中的表达及其临床意义[J].中华消化外 科杂志,2013,12(6):440-2.] |
| [3] | Zhong X,Coukos G,Zhang L.miRNAs in human cancer[J]. Methods Mol Boil,2012,822:295-306 . |
| [4] | Garzon R,Fabbri M,Cimmino A,et al.MicroRNA expression and function in cancer[J].Trends Mol Med, 2006,12(12):580-7. |
| [5] | Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96. |
| [6] | Zheng SR,Gun GL,Zhang W, et al.Clinical signifi cance of miR- 155 expression in breast cancer and effects of miR-155 ASO on cell viabilit y and apoptosis[J].Oncol Rep,2012,27(4):1149-55 . |
| [7] | Qin AD,Zhou Y,Sheng MX,et al.Effects of M icroRNA-155 on the growth of human lung cancer cell line 95D in vitro[J].Zhongguo Fei Ai Za Zhi,201l,14(7):575-80.[秦安东,周涯,盛美霞,等. MicroRNA-155对人肺癌95D细胞生长的影响[J].中国肺癌杂 志,201l,14(7):575-80.] |
| [8] | Bakirtzi K,Hatziapostolou M,Karagiannides I,et al.Neurotensin signaling activates microRNAs-21 and -155 and Akt,promotes tumor growth in mice,and is in creased in human colon tumors[J]. Gastroenterology,2011,141(5):1749-61. |
| [9] | Ryu JK,Hong SM,Karikari CA,et al.Aberrant microRNA-155 expression is an early event in the multistep progression of pancreatic adenocarcinoma[J].Pancreatology,2010,10(1):66-73. |
| [10] | Xie Q,Chen X,Lu F,et al.Aberrant expression of microRNA 155 may accelerate cell proliferation by targeting sex-determining region Y box 6 in hepatocellular carcinoma[J].Cancer,2012,118(9): 2431-42. |
| [11] | Greither T,Grochola LF,Udelnow A,et al.Elevated expression of microRNAs 155,203,210 and 222 in pancreatic tumors is associated with poorer survival[J].Int J Cancer,2010,126(1):73-80. |
| [12] | Wang XY,Wu MH,Liu F, et al.Differential miRNA expression and their target genes between NGX6-positive and negative colon cancer cells[J]. Mol Cell Biochem,2010,345(1-2):283-90. |
| [13] | Kong W,Yang H,He L,et al.MicroRNA-155 is regulated by the transforming growth factor beta/Smad pathway and contributes to epithelial cell plasticity by targeting RhoA[J].Mol Cell Biol,2008,28(22):6773-84. |
| [14] | Gironella M,Seux M,Xie MJ,et al.Tumor protein 53-induced nuclear protein 1 expression is repressed by miR-155,and its restoration inhibits pancreatic tumor development[J].Prec Nail Acad Sci U S A,2007,104(41):16170-5. |
| [15] | Zhou LS, Li DP, Wang B, et al.The relative parameters of liver metastasis of colorectal carcinoma after surgery[J]. Zhongguo Ai Zheng Za Zhi,2006,16(5):394-5.[周立生,李大鹏, 王斌,等.结直肠癌术后肝转移相关因素分析[J]. 中国癌症杂志,2006,16(5):394-5.] |
 2014, Vol.41
2014, Vol.41