2.河北北方学院附属第一医院临床药理学室,
3.呼吸科
2.Department of Clinical Pharmacology, First Affi liated Hospital of Hebei Northern College,
3.Department of Respiratory Medicine, First Affi liated Hospital of Hebei Northern College
肺癌是最常见的肺部原发性恶性肿瘤,其 死亡率已居全球癌症之首[1]。其高发病率和死亡 率与肿瘤的发生、发展及浸润、转移有密切关 系。转化生长因子β1(transforming growth factor β1,TGFβ1)是一种具有多种功能的多肽类生长 因子,其信号转导通路的异常往往是癌症发生、 发展以及浸润和转移的重要因素,尤其在进展 期肿瘤可促进细胞增殖进而促进肿瘤的侵袭及 转移。SPARC(secreted protein acidic and rich in cysteine)是一种富含半胱氨酸酸性蛋白,在肿瘤 中具有抗黏附、抗增殖、抗肿瘤血管生成作用并 调节细胞外基质的组成,可以抑制细胞周期,尤 其是在内皮细胞和平滑肌细胞,而内皮细胞和造 血细胞的增殖亦受具有抑制血管生成的肿瘤调控 基因TGFβ1的作用[2]。目前SPARC在肺癌中的作 用尚不明确,而且SPARC、TGFβ1在肺癌中表达 关系报道较少。因此,本研究运用原位杂交检测 SPARC mRNA和TGFβ1 mRNA在肺癌中的表达及 临床意义,进一步探讨其与肺癌侵袭转移的关系。 1 资料与方法 1.1 资料
收集河北北方学院附属第一医院2008年-2012 年肺癌71例,病理诊断结果经2名以上病理医师确 认。男性51例,女性20例,年龄45~73岁,中位年 龄59岁;按WHO(2000)肺癌分类标准,组织学 分级高分化6例,中分化41例,低分化至未分化24 例;按组织病理学分类,非小细胞肺癌67例(腺 癌50例、鳞状上皮细胞癌15例、类癌1例、肉瘤样 癌1例)、小细胞癌4例;临床分期Ⅰ~Ⅱ期41例、 Ⅲ~Ⅳ期30例;有淋巴结转移者41例、无转移者30 例。同时收集30例相应的癌旁正常肺组织(距肿 瘤切缘>5 cm)作为对照组。所有患者术前均未行 放疗、化疗。 1.2 治疗方法
人SPARC、TGFβ1原位杂交检测试剂盒、原 位杂交专用盖玻片以及DAB显色试剂均购自武汉 博士德公司。针对人SPARC靶基因的mRNA序列 特异性片段为:5’-GCCTGGATCTTCTTTCTCCTT TGCCTGGCC-3’,5’-CTTCGACTCTTCCTGCCA CTTCTTTGCCAC-3’,5’-TGAAGAAGATCCATGA GAATGAGAAGCGCC-3’;针对人TGFβ1靶基因的 mRNA序列为:5’-ACCTGCAAGACTATCGACAT GGAGCTGGTG-3’,5’-TGTACAACAGCACCCGC GACCGGGTGGCCG-3’,5’-GTACCAGAAATACA GCAACAATTCCTGGCG-3’。 1.3 染色方法
严格按照博士德公司试剂说明书进行。 SPARC、TGFβ1原位杂交法:石蜡切片常规脱蜡 水化,3%H2O2灭活内源性酶,3%柠檬酸稀释的胃 蛋白酶消化液37℃消化处理30 min,暴露mRNA 核酸片段,PBS洗涤3次,每次5 min,蒸馏水洗涤 1次;1%多聚甲醛室温固定10 min。杂交过程, 在每张切片上滴加20 μl预杂交液置于40℃恒温箱 内预杂交3 h后,20 μl含探针杂交液40℃恒温箱内 杂交24 h。杂交结束后,37℃水温的2×SSC洗涤 2次,每次5 min,0.5×SSC洗涤15 min,0.2×SSC 洗涤15 min。滴加封闭液37℃30 min;滴加生物 素化鼠抗地高辛37℃ 60 min,PBS洗涤4次,每次 5 min;滴加SABC 37℃ 20 min,PBS洗涤3次,每 次5 min;滴加生物素化过氧化物酶37℃ 20 min, PBS洗涤4次,每次5 min;DAB显色后蒸馏水冲 洗,苏木精对比染色,脱水,透明封片镜检。 1.4 结果判定
SPARC mRNA阳性主要表达于纤维母细胞, 在内皮细胞胞浆内、癌细胞内偶可见表达,呈棕 黄色弥漫或颗粒状。参照文献的判断标准[3],根 据着色强度及阳性细胞百分比进行评分:无色为0 分,淡黄色(弱阳性)为1分,棕黄色(中等染色 强度)为2分,棕褐色(强阳性)为3分;阳性细 胞<1%为0分,≥1%~25%为1分,≥25%~50%为2 分,≥50%~75%为3分,≥75%~100%为4分。反 应得分为百分率得分与染色强度得分的乘积。每 张切片高倍镜下随机选择 5个癌组织视野观察,求 其平均值为该样本的阳性系数。
TGFβ1 mRNA主要分布于细胞的胞质,呈棕 黄色弥漫或颗粒状。按染色强度打分: 无色为 0 分,淡黄色为1分,棕黄色为2分,棕褐色为3分; 按阳性率打分: 阴性为0分,阳性细胞率<10%为1 分,10%~50%为2分,>50%为3分。染色强度与 阳性细胞率的乘积:2 分为( - ) ,3 分为( + )。 1.5 统计学方法
采用SPSS 17.0统计软件对结果进行统计学分 析,主要运用χ2检验,SPARC mRNA和TGFβ1 mRNA的相关性采用 Spearman等级相关性分析, P<0.05为差异有统计学意义。 2 结果 2.1 SPARC mRNA和TGFβ1 mRNA在正常肺组织及肺癌中的表达
SPARC mRNA信号主要表达于癌细胞周围 的间质纤维细胞胞质,少数也可表达于胞核, 在癌细胞中阳性表达较少,但偶可见到有阳性表 达,阳性信号为棕黄色弥漫或颗粒状,其在肺癌 组织中的阳性表达率为61.97%(44/71),与癌旁正 常肺组织20%(6/30)相比,差异具有统计学意义 (P<0.05),见图 1、图 2。TGFβ1 mRNA信号染色主要 位于胞质,阳性信号为颗粒型棕黄色,其在肺癌 的阳性表达率为59.15%(42/71),在癌旁正常肺组 织的阳性表达率为26.67%(8/30),差异有统计学意 义(P<0.05),见图 3。
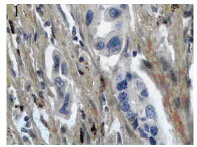 |
图 1SPARC mRNA信号在肺癌组织间质纤维细胞中阳性表达(原位杂交 ×400) Figure 1The positive expression of SPARC mRNA signal in lung tissue stromal fi broblasts( in situ hybrization ×400) |
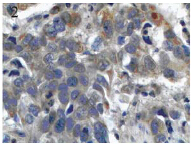 |
图 2SPARC mRNA信号在肺癌组织癌细胞中阳性表达(原位杂交 ×400) Figure 2The positive expression of SPARC mRNA signal in lung cancer tissue(in situ hybrization ×400) |
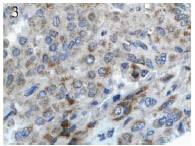 |
图 3TGFβ1mRNA信号在肺癌组织中阳性表达(原位杂交 ×400) Figure 3The positive expression of TGFβ1 mRNA signal in lung tissue( in situ hybrization ×400) |
SPARC mRNA在肺癌组织中的表达与肺癌的 临床分期及淋巴结转移有关(P<0.05),在临床 分期中,其在Ⅰ~Ⅱ期中的表达高于Ⅲ~Ⅳ期的表 达(χ2=5.164,P=0.023),差异有统计学意义; 其在无淋巴结转移中的表达高于有淋巴结转移者 (χ2=7.165,P=0.007),差异具有统计学意义,但 其表达与患者的年龄、性别、肿瘤大小、分化程 度及临床分类无关(P均>0.05)。TGFβ1mRNA 在肺癌组织中的表达与肿瘤大小、临床分期及淋 巴结转移有关(P均<0.05),TGFβ1mRNA在肿 瘤体积≥3 cm3中的表达高于肿瘤体积<3 cm3中的 表达(χ2=5.248,P=0.022),差异具有统计学意 义;在Ⅲ~Ⅳ期中的表达高于其在Ⅰ~Ⅱ期中的表 达(χ2=12.570,P<0.01),差异具有统计学意义; 在有淋巴结转移中的表达高于无淋巴结转移者 (χ2=5.382,P=0.020),差异具有统计学意义。与 肺癌患者的年龄、性别、肿瘤分化程度、临床分 类无关(P均>0.05)。随着肺癌肿瘤体积增大、 临床分期的进展及淋巴结出现转移时TGFβ1蛋白 的表达逐渐增加,见表 1。
|
|
表 1 71例肺癌SPARC、TGFβ1与临床病理参数的关系 Table 1Relationship of SPARC,TGFβ1 with clinicopathological parameters of 71 cases of lung cancer |
SPARC mRNA和TGFβ1 mRNA共同表达阳 性者为20例(28.17%),共同表达阴性者为5例 (7.04%),SPARC mRNA表达阳性、TGFβ1 mRNA表达阴性者24例(33.80%),SPARC mRNA表达阴性,TGFβ1 mRNA表达阳性者22例 (30.99%),经Spearman等级相关分析可知两者 mRNA表达呈负相关性(r=-0.356,P =0.002)。 3 讨论
SPARC是一种富含半胱氨酸的小分子糖蛋 白,最早是由Termine等人于1981年鉴定出的 一种主要的骨非胶原成分,定位于人类染色体 5q31.3-q32,包含10个外显子,全长25.9 kb,编 码由298~304个氨基酸组成的蛋白。SPARC分为3 个独立的模块结构:(1)氨基末端酸性钙离子结 合区域(Ⅰ区),具有稳定细胞外基质的作用; (2)与卵泡静止素同源的铜离子结合区域(Ⅱ 区),富含半胱氨酸,具有抑制内皮细胞周期、 抗细胞黏附、抑制内皮细胞增殖及血管生成; (3)细胞外钙离子结合区域(Ⅲ区),具有改变 细胞形态、抗细胞黏附作用[4, 5]。SPARC在肿瘤发 生发展中的作用取决于其在不同微环境中所表现 的不同功能。在恶性黑色素瘤中SPARC高表达, 通过反义RNA沉默SPARC表达后,在体外实验中 可观察到黑色素瘤细胞附着和侵袭性降低[6]。在 结直肠癌中,免疫组织化学分析显示292例结直肠 癌患者中,SPARC表达者5年存活率较高[7]。在卵 巢癌中,SPARC 表达水平与卵巢癌细胞系的恶性 程度呈负相关,而且加入外源性的 SPARC 或使 SPARC 再表达,可使卵巢癌细胞系的增殖活性下 降并介导细胞凋亡[8]。Suzuki等[9]研究显示SPARC 在肺癌细胞中表达减少,在间质细胞中高表达。 在本实验中,SPARC mRNA在肺癌组织中的阳性 表达高于癌旁正常组织(P<0.05),在癌组织中 主要表达于间质纤维细胞中,在癌细胞中阳性表 达较少,与文献[9]研究一致,且在淋巴结未出现转 移时,临床分期越早(Ⅰ~Ⅱ期),SPARC mRNA 表达越高,考虑SPARC主要表达在间质纤维细胞 中,有可能起到维持肿瘤微环境稳态的作用,进 而可能抑制肺癌的进展。
TGFβ1是一种由二硫键连接的多肽二聚体, 最早是由Arends等在1983年从人血小板中提取, 并已被证实在细胞的生长调节中起重要作用。据 文献[10]报道TGFβ1对肿瘤的作用是多样的,在肿瘤 发生的早期通过下调c-myc的表达,从而阻止肿瘤 细胞从G1期进入S期,以及增进抑癌基因p53及Rb 的活性进而发挥抑制细胞增殖、启动细胞分化、 诱导凋亡的作用;但在肿瘤的进展期通过抑制T 淋巴细胞活性,协助肿瘤细胞逃避机体的免疫监 视;通过作用于内皮细胞和具有促进血管生成的 细胞因子而形成一个易于血管形成的环境;诱导 细胞外基质的产生而促进肿瘤的侵袭和转移[11]。 乳腺癌早期,TGFβ1 的负性调控作用能够抑制肿 瘤细胞生长; 而在后期,TGFβ1的抑制作用逐渐消 失,癌基因的失活和表观遗传学改变,使TGFβ1 能够促进肿瘤的运动、侵袭以及迁移[12]。有研究 显示血清TGFβ1水平可以作为结直肠癌的肿瘤标 志物,有助于对结直肠癌临床诊断、术后复发及 高危对象的监测[13]。Muinelo-Romay等[14]报道高风 险的子宫内膜癌确定TGFβ1作为开始侵袭时的关 键因子。吴新天等[15]研究显示在非小细胞肺癌中 TGFβ1的表达与非小细胞肺癌患者的肿瘤分期和 有无淋巴结转移有关,提示TGFβ1过度表达可能 提示病变有进展或转移。何欣蓉等[16]报道TGFβ1可 能与肺癌发生及进展有关,有可能作为判断人肺 癌细胞恶性程度的指标之一。在本实验中,TGFβ1 mRNA在肺癌中的阳性表达高于癌旁正常肺组织 (P<0.05),随着临床分期等级的增加,淋巴结 出现转移时TGFβ1 mRNA表达越高。提示TGFβ1 可促进肺癌的进展,可能参与肺癌的转移过程。
有研究[17]发现,SPARC和TGFβ1之间可以相 互作用。在血管发生期间,SPARC通过与TGFβ1 的受体endoglin相互作用限制血管周细胞对TGFβ1 的感知能力,在SPARC缺陷的周细胞中增添 TGFβ1,发现血管周细胞募集会减少,而SPARC 直接与endoglin结合,可阻碍TGFβ1通路,从而 使周细胞募集增加,肿瘤血管可趋于正常化。在 肾小球系膜细胞中,添加外源性SPARC蛋白,可 使TGFβ1下游信号转导通路中SMAD2(受体激活 性)蛋白磷酸化增加2~3倍,增强JNK(应激蛋白 激酶)活化水平及c-jun总磷酸化水平[18]。JNK通路 是丝裂原活化蛋白激酶 ( mitogen- activated protein kinase,MAPK)信号转导通路之一,其作用主要 是将信号从细胞表面转导至细胞核内部,从而使 细胞发挥相应的生物学效应。TGFβ1作用于人成 纤维细胞,可以在5 h内介导SPARC蛋白的产生。 有研究发现SPARC并不与TGFβ1或其受体结合, 而是与TGFβ1及TβR-Ⅱ复合体结合,并增加其下 游的转导信号,在小鼠心肌细胞体外实验中SPARC 可增加TGFβ1依赖的SMAD2磷酸化水平[19]。有研 究显示SPARC功能可能与TGFβ1相似,在肿瘤形 成早期癌细胞内低表达,而在晚期呈高表达,在 肿瘤的不同时期扮演抑癌基因还是癌基因[10]。在 本实验中,SPARC主要表达在间质纤维细胞中, 且临床分期越早(Ⅰ~Ⅱ期)、淋巴结无转移时, SPARC mRNA表达较高,推测其有可能在肺癌中 起到维持肿瘤微环境稳态的作用,进而可能抑制 肺癌的进展。另外,在临床中肿瘤行手术治疗的 主要是Ⅰ~Ⅱ期的患者,收集的标本早期肺癌的例 数多于晚期,从而可能导致结果主要反映SPARC 在早期肺癌中的作用。对于TGFβ1,结果提示其 在肺癌中的作用可能是促进肺癌的进展,参与 肺癌的转移过程。本实验数据提示肺癌组织中 SPARC与TGFβ1的表达呈负相关性,SPARC的高 表达可能抑制肺癌的进展,TGFβ1的高表达可促 进肺癌的进展。
综上所述,肺癌组织中SPARC的高表达可抑 制肺癌的进展,而TGFβ1的高表达可促进肺癌的 进展,并参与肺癌的转移过程。此二者与肺癌的 发生、发展及恶性程度密切相关,通过检测此二 者的表达有助于判定肺癌的病理学分级,也有助 于肺癌临床评估及指导治疗。
| [1] | Jemal A, Bray F, Center MM, et al. Global Cancer Statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [2] | Blobe GC, Schiemann WP, Lodish HF. Role of transforming growth factor beta in human disease[J].N Engl J Med,2000, 342(18):1350-8. |
| [3] | Yiu GK, Chan WY, Ng SW, et al. SPARC(secreted protein acidic and rich in cysteine) induces apoptosis in ovarian cancer cells[J] Am J Pathol, 2001, 159(2): 609-22. |
| [4] | Chlenski A,Cohn SL.Modulation of matrix remodeling by SPARC in neoplastic progression[J].Semin Cell Dev Biol,2010,21(1): 55-65. |
| [5] | Brune K,Hong SM,Li A,et al.Genetic and epigenetic alterations of familial pancreatic cancers[J]. Cancer Epidemiol Biomarker Prev, 2008, 17(12) : 3536-42. |
| [6] | Prada F, Benedetti LG,Bravo AI, et al. SPARC endogenous level,rather than fibroblast-produced SPARC or stroma reorganization induced by SPARC, is responsible for melanoma cell growth[J]. J Invest Dermatol, 2007, 127(11): 2618-28. |
| [7] | Yang E,Kang HJ,Koh KH,et al.Frequent inactivation of SPARC by promoter hypermethylation in colon cancers[J].Int J Cancer,2007, 121(3): 567-75. |
| [8] | Bull Phelps SL,Carbon J,Miller A,et al. Secreted protein acidic and rich in cysteine as a regulator of murine ovarian cancer growth and chemosensitivity[J].Am J Obstet Gynecol,2009,200(2):180. e1-7. |
| [9] | Suzuki M,Hao C,Takahashi T,et al. Aberrant methylation of SPARC in human lung cancers[J].Br J Cancer,2005,92(5):942-8. |
| [10] | Arends JW.Molecular interactions in the Vogelstein model of colorectal carcinoma[J]. J Pathol,2000,190(4):412-6. |
| [11] | Wang XD,Zhan ZL.Advanced reserch on TGF-beta and tumor TGF-beta and its receptor and the research progress of tumor[J]. Zhongguo Zhong Liu Lin Chuang, 2005, 32(17):1016-20. [王旭 东, 战忠利. TGF-β及其受体与肿瘤的研究进展[J]. 中国肿瘤临 床, 2005, 32(17):1016-20.] |
| [12] | Dunning AM,Ellis PD,McBride S, et al. A transforming growth factorbeta1 signal peptide variant increases secretion in vitro and is associated with increased incidence of invasive breast cancer[J]. Cancer Res,2003,63 (10):2610-5. |
| [13] | Liu SP, Dong WG, Luo HS, et al. Determination and clinical signifi cance of serum level of transforming growth factor-beta 1 in patients with colorectal cancer[J]. Wuhan Da Xue Xue Bao(Yi Xue Ban),2009,30(5):640-3.[刘少平,董卫国,罗和生,等. 结直肠 癌患者血清转化生长因子β1含量检测及临床意义[J]. 武汉大学 学报(医学版), 2009, 30(5) : 640-3.] |
| [14] | Muinelo-Romay L,Colas E,Barbazan J,et al.High-risk endometrial carcinoma profiling identifies TGF - β1 as a key factor in the initiation of tumor invasion[J]. Mol Cancer Ther, 2011, 10 (8) : 1357-66. |
| [15] | Wu XT, Zhou SZ, Mo JM, et al. Determination and clinical significance of HIF-1α,VEGF and TGF-β1 expression in nonsmall cell lung cancinoma[J]. Zhongguo Ai Zheng Fang Zhi Za Zhi, 2013, 5(1):46-9. [吴新天, 周韶璋, 莫娟梅, 等. HIF-1α、 VEGF和TGF-β1在非小细胞肺癌中的表达及其临床意义[J]. 中 国癌症防治杂志, 2013, 5(1):46-9.] |
| [16] | He XR,Liu X,Huang YF.Expression of TGF-β1 in Lung Cancer Tissue and their Biological Significance[J].Chuan Bei Yi Xue Yuan Xue Bao,2010,25(5):403-5.[何欣蓉,刘馨,黄一凡.转化生长 因子β1在肺癌中的表达和意义[J].川北医学院学报,2010,25(5): 403-5.] |
| [17] | Rivera LB,Brekken RA. SPARC promotes pericyte recruitment via inhibition of endoglin-dependent TGF-β1 activity[J].J Cell Biol, 2011,193(7):1305-19. |
| [18] | Tang MJ, Tai IT. A novel interaction between procaspase 8 and SPARC enhances apoptosis and potentiates chemotherapy sensitivity in colorectal cancers[J].J Biol Chem,2007, 282(47):34457-67. |
| [19] | Said N, Frierson HF Jr, Chernauskas D, et al.The role of SPARC in the TRAMP model of prostate carcinogenesis and progression[J]. Oncogene,2009,28(39):3487-98. |
 2014, Vol.41
2014, Vol.41