2.武汉市协和医院肿瘤科;
3.武汉市同济医院呼吸科
2. Department of Oncology, Wuhan Union Hospital;
3.Department of Respiratory Medicine, Tongji Hospital of Wuhan
MicroRNAs(miRNA)是一种内源性的非 编码小分子RNA,可以在转录后水平调节蛋白 质的合成,广泛分布于生物细胞体内。大量研究 已经证实miRNA在恶性肿瘤细胞的发生、发展 中发挥重要作用,其中包括调控细胞的增殖、分 化、凋亡以及侵袭和转移[1, 2]。研究报道miR-96 在乳腺癌及结肠癌等恶性肿瘤中表达上调[3, 4, 5]。过 表达miR-96可以促进乳腺癌细胞的增殖[5]。然而 miR-96对肺癌细胞侵袭迁移能力的影响尚未见报 道。本实验采用荧光定量PCR法检测miR-96在肺 癌组织中的表达情况,同时利用反义寡核苷酸技术 (antisense oligonucleotide,ASO)抑制miR-96在肺 癌细胞中的表达,分析miR-96对肺癌细胞侵袭和 迁移能力的影响,同时检查侵袭相关蛋白MMP2和 MMP9的表达变化。 1 资料和方法 1.1 资料 1.1.1 临床资料
收集2006年1月—2011年1月武汉市普仁医院 和武汉市同济医院胸外科的肺癌及相应癌旁组织 手术标本116例。所有标本均经病理学检查确诊, 其中男106例,女10例,年龄32~69岁,平均年龄 49.60±2.29。所有患者术前均未接受放化疗。 1.1.2 主要试剂
肺癌A549和H1299细胞由本实验室保存; TaqMan miRNA分析试剂盒(美国ABI公司); DMEM高糖培养液(美国Gibco公司)、胎牛血清 (美国Hyclone公司)、脂质体LipfectamineTM 2000 (美国Invitrogen公司);反义miR-96寡核苷酸 (miR-96 ASO)(大连宝生物公司);总蛋白提取试剂 盒(北京普利莱公司)、兔抗人MMP2和MMP9 单克隆抗体(美国Santa cruz公司)、β-actin二抗 (北京中杉金桥公司; Transwell Chamber(美国 Chemicon公司),人工基底胶Matrigel(美国 BD 公司)。 1.2 方法 1.2.1 实时荧光定量PCR检测miR-96的表达
提取组织中总RNA。反转录为cDNA。采 用SYBR Green法定量检测,反应条件:95℃ 15 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,共45个循 环,最后72℃延伸7 min。在每个循环的最后增加 溶解曲线。阈值定义为基础荧光信号的10个标准 差,即时循环数为Ct,计算目的基因的mRNA量, 公式:2-△△Ct(ΔΔCt=miR-96 Ct-U6Ct实验组–miR-96 Ct-U6Ct对照组) ,实验重复3次。 1.2.2 反义miR-96寡核苷酸序列设计
设计miR-96反义寡核苷酸序列,同时设计 一条随机阴性对照序列,如下所示:miR-96正义: 5'-AGUCACUAGUGGUUCCGUUUA-3',反义: 5'-TAAACGGAACCACTAGTGACT-3',随机序列正 义:5'-UCUUCCGAACGUGUCACGUTT-3',反义: 5'-AAGUGACACGUUCGGAGAATT-3'。 1.2.3 反义寡核苷酸转染
运用LipfectamineTM 2000转染试剂盒进行转 染,反义miR-96寡核苷酸终浓度分别为:50、 100、150、200和250 nmol/L。本实验组筛选出最 佳终干扰浓度为150 nmol/L。转染后培养时间分别 为24、48和72 h,初步筛出最佳作用时间为48 h。 上述操作重复3次。 1.2.4 转染miR-96 ASO后对miR-96表达的影响
实验分为三组:空白对照组(MOCK组)、 转染随机ASO组(NC组)和转染miR-96 ASO 组 (miR-96 ASO 组),提取各组总RNA,测定 浓度,反转录为cDNA(反应条件同1.2.1),测 定cDNA浓度。 运用microRNA检测试剂盒检测 miR-96的表达(具体条件同1.2.1)。上述操作重 复3次。 1.2.5 Transwell侵袭和迁移实验
实验分组同1.2.4。Transwell小室的上下室之 间以孔径为8 μm的聚碳酸酯微膜孔分隔开,滤膜 上层铺盖Matrigel(迁移实验无需铺Matrigel)。 用无血清的DMEM重悬细胞,调整细胞浓度为1× 106 个/毫升。吸取500 μl含 10%血清的DMEM于外 室中作为趋化因子,加300 μl细胞悬液于内室中, 37℃、5%CO2培养箱中培养24 h。取出Transwell小 室吸除培养液,擦净小室滤膜上层的Matrigel及未 穿过滤膜的细胞。染色20 min,冲洗,风干。实 验中每组每次同时做3个重复小室,显微镜观察计 数,取平均值。 1.2.6 划痕实验
实验分组同1.2.4。采用记号笔在6孔板背面均 匀划横线。在孔中加入约5×105个细胞,第二天利 用10 μl枪头依横线划痕。PBS洗细胞3次,去除划 下的细胞,加入培养液。置于37℃、5%CO2培养 箱培养。0、48 h取样,显微镜下拍照。每个样本 至少重复3次。 1.2.7 检测各组细胞中MMP2和MMP9蛋白表达
实验分组同1.2.4。收集各组细胞,提取总蛋 白,经10%SDS-PAGE电泳后转膜,置含5%脱脂 奶粉的TBST缓冲液中37 ℃封闭2 h,加一抗稀释 液 1∶400稀释。兔抗人MMP2和MMP9单克隆抗 体在4℃孵育过夜,1×TBST缓冲液3次(每次10 min),加辣根过氧化物酶标记的山羊抗兔IgG (1∶5 000稀释),37℃孵育2 h,1×TBST缓冲液 3次(每次10 min),运用ECL化学发光法检测目 的蛋白条带。以β-actin作为内参。 1.3 统计学方法
所有数据采用SPSS17.0统计软件包进行分 析。计量资料以均数±标准差( x±s)表示,癌及 癌旁组织比较采用配对样本t检验,多组均数之间 比较采用单因素方差分析,两两比较采用LSD-t检 验,P<0.05为差异有统计学意义。 2 结果 2.1 肺癌组织miR-96的表达情况
运用实时荧光定量PCR检测116例肺癌患者 癌及癌旁组织中miR-96的表达情况,结果发现: 63.80%(74/116)的病例肺癌组织miR-96的表达 明显高于相应的正常癌旁组织,差异有统计学 意义(t=26.53,P<0.05),见图 1,另外36.2% (42/116)的病例肺癌组织miR-96的表达与癌旁组 织相比差异无统计学意义(P<0.05)。
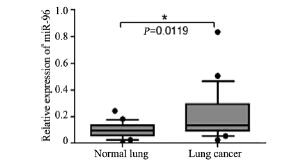 |
图 1实时荧光定量PCR检测116例患者肺癌及相应癌旁组 织miR-96表达的盒须图 Figure 1Box-plot of miR-96 expression in 116 cases of lung cancer and adjacent normal tissues by fluorogenic quantitative PCR |
荧光定量PCR方法检测结果发现:A549细胞 转染miR-96 ASO组miR-96的相对表达量较空白 对照组和转染随机ASO组显著降低(F=391.66, P<0.05);H1299细胞同样发现miR-96 ASO组 miR-96的相对表达量较空白对照组和转染随机ASO 组显著降低(F=488.42,P<0.05),见图 2。
 |
图 2转染miR-96 ASO(antisense oligonucleotide)后A549和H1299细胞miR-96的表达变化 Figure 2Expression of miR-96 in A549 and H1299 cells after transfected with miR-96 ASO |
通过各组细胞穿过人工基质胶的细胞数量 的多少,来评估各组细胞的侵袭能力,每组取5 个高倍镜视野。结果显示:转染miR-96 ASO组 的A549细胞侵袭能力与空白对照组及转染随机 ASO组相比显著降低(F=671.28,P<0.05),而 空白对照组与转染随机ASO组差异无统计学意义 (P>0.05);H1299细胞实验结果与A549细胞一 致。结果显示:转染miR-96 ASO组的H1299细胞侵 袭能力较空白对照组、转染随机ASO组显著降低 (F=741.18,P<0.05),而空白对照组与转染随机 ASO组差异无统计学意义(P>0.05),见图 3。
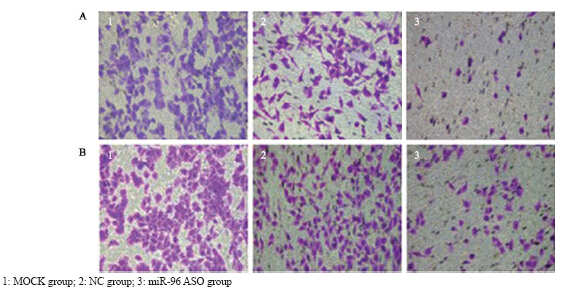 |
图 3转染miR-96 ASO对A549(A)和H1299(B)细胞侵袭能力的影响 Figure 3Effect of miR-96 ASO transfection on invasion ability of A549(A) and H1299(B) cells |
通过各组细胞穿过人工基质胶的细胞数量的 多少,来评估各组细胞的侵袭能力,每组取5个 高倍镜视野。结果显示:转染miR-96 ASO组的 A549细胞侵袭能力与空白对照组及转染随机ASO 组相比明显降低(F=472.57,P<0.05),而空 白对照组与转染随机ASO组差异无统计学意义 (P>0.05);H1299细胞实验结果与A549细胞一 致。结果显示:转染miR-96 ASO组的H1299细胞侵 袭能力较空白对照组、转染随机ASO组相比明显降 低(F=289.34,P<0.05),而空白对照组与转染 随机ASO组比较差异无统计学意义(P>0.05),见 图 4。
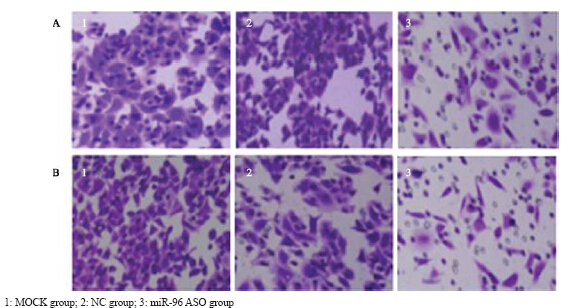 |
图 4转染miR-96 ASO对A549(A)和H1299(B)细胞迁移能力的影响 Figure 4Effect of miR-96 ASO transfection on A549(A) and H1299(B) cells |
采用划痕实验检测A549和H1299肺癌细胞的 迁移能力,结果显示,划痕48 h后,miR-96 ASO 组细胞划痕的愈合率比空白对照组和转染随机 ASO组明显下降,差异具有统计学意义(A549 细胞组间F=743.24,P<0.05;H1299细胞组间 F=564.18,P<0.05) ,见图 5。
 |
图 5转染miR-96 ASO对A549(A)和H1299细胞(B)的划痕愈合能力的影响 Figure 5Effect of miR-96 transfection on the wound healing ability of A549(A) and H1299(B) cells |
miR-96 ASO转染A549和H1299细胞后, Western blot检查各组细胞中MMP2和MMP9蛋白表 达水平,结果发现miR-96 ASO组MMP2和MMP9 的相对表达水平明显低于空白对照组和转染随机 ASO组(P<0.05),见图 6。
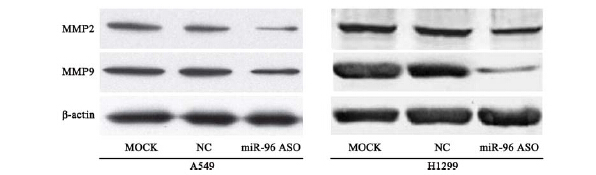 |
图 6MMP2和MMP9蛋白在转染miR-96 ASO 的A549和H1299细胞中的表达情况 Figure 6MMP2 and MMP9 protein level in A549 and H1299 cell after transfection of miR-96 ASO |
肺癌是全球发病率最高的恶性肿瘤之一,侵 袭转移是患者死亡和治疗效果不理想的主要原 因。肺癌的侵袭转移是一个多步骤、多阶段、多 途径、多个因素共同调控的复杂生物学过程[6, 7]。 miRNAs是在真核生物中发现的一类内源性的具有 调控功能的非编码RNA,其大小约20~25nt,通过 与靶mRNA互补配对从而导致mRNA降解或抑制转 录后蛋白翻译最终诱导基因沉默。近年来研究发现 miRNAs与多种恶性肿瘤的发生及侵袭转移相关[8, 9]。 因此miRNAs可能成为诊断肿瘤的新的分子标志和 判断肿瘤治疗及预后的分子靶点,有助于肿瘤的 早发现、早诊断和早治疗[10]。
研究已经证实miR-96在多种恶性肿瘤中表 达失调[3, 4, 5],但miR-96在肺癌中的表达及作用目 前尚不清楚。本实验利用实时荧光定量PCR检测 临床肺癌标本及相对应的癌旁肺组织,结果发 现miR-96在肺癌组织中呈明显高表达,这表明 miR-96在肺癌发生发展中发挥重要作用。为了研 究miR-96对肺癌细胞侵袭迁移能力的影响,本实 验通过转染miR-96 ASO降低肺癌细胞中miR-96 的表达,同时利用Transwell方法检测降低miR-96 的表达后,观察肺癌细胞侵袭迁移能力的变化, 结果显示转染miR-96 ASO的肺癌细胞侵袭迁移 能力明显降低。此外我们进一步利用划痕实验观 察到抑制miR-96的表达后,肺癌细胞的划痕愈合 能力明显下调。这些结果都表明miR-96在肺癌细 胞的侵袭迁移过程中起着非常重要的作用,这与 Chen等[11]研究发现降低miR-96的表达可以明显抑 制肝癌细胞的侵袭迁移能力结果基本一致,说明 miR-96在恶性肿瘤的侵袭转移中发挥重要作用。
为了进一步分析降低miR-96表达后引起肺癌 细胞侵袭迁移能力下降的可能机制,我们发现, 抑制miR-96的表达可以明显降低侵袭相关蛋白 MMP2和MMP9蛋白的表达,但生物信息学提示 MMP2和MMP9均不是miR-96的靶基因,所以我们 推测miR-96可能通过调控直接靶基因进而调节下 游MMP2和MMP9的表达,最终对肿瘤细胞侵袭迁 移产生影响,其具体机制有待于进一步研究。
综上所述,miR-96在调控肺癌细胞的侵袭和迁移 方面发挥重要作用,很可能成为一个新的肺癌侵袭转 移调节基因,为肺癌临床基因治疗提供新的靶点。
| [1] | Croce CM, Calin GA. miRNAs, cancer, and stem cell division[J]. Cell, 2005,122 (1): 6-7. |
| [2] | Chen CZ,Li L, Lodish HF, et al. MicroRNAs modulate hematopoietic lineage differentiation[J]. Science,2004,303(5654): 83-6. |
| [3] | Wang Y, Luo H, Li Y, et al. hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnostic marker in human bladder urothelial carcinomas[J]. Mol Med Rep,2012,5(1):260-5. |
| [4] | Lin H, Dai T, Xiong H, et al. Unregulated miR-96 induces cell proliferation in human breast cancer by downregulating transcriptional factor FOXO3a[J]. PLoS One,2010,5(12):e15797. |
| [5] | Sarver AL, French AJ, Borralho PM, et al. Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states[J]. BMC Cancer,2009,9:401. |
| [6] | Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited[J]. Nat Rev Cancer,2003,3(6):453-8. |
| [7] | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges[J]. Nat Med,2006,12(8):895-904. |
| [8] | Brennecke J, Hipfner DR, Stark A, et al. Bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila[J]. Cell,2003,113(1):25-36. |
| [9] | Gupta GP,Massagué J.Cancer metastasis: building a framework[J]. Cell,2006,127(4):679-95. |
| [10] | Jemal A, Siegel R, Ward E, et al. Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96. |
| [11] | Chen RX, Xia YH, Xue TC, Ye SL. Suppression of microRNA-96 expression inhibits the invasion of hepatocellular carcinoma cells[J]. Mol Med Rep,2012,5(3):800-4. |
 2014, Vol.41
2014, Vol.41



