HOXA7是同源盒基因(homeobox gene,HOX) 家族中一员,在造血系统发育过程中起重要调 控作用,随造血细胞CD34+向CD34-分化成熟, HOXA7表达下调[ 1 ]。在特定造血谱系分化阶段,HOXA7过表达能导致白血病发生,且其过表达 与白血病患者对治疗的反应及预后差密切相关。 RNA干扰(RNA interference,RNAi)技术因能在转 录后水平沉默某些功能基因,近年来在白血病研 究中得到广泛应用。本实验在构建靶向HOXA7特 异性真核表达载体基础上,运用RNA干扰技术抑 制白血病细胞株U937中HOXA7表达后,研究其对 U937细胞增殖、凋亡的影响,为白血病基因治疗 寻找新靶点。 1 材料与方法 1.1 主要材料与试剂
人单核细胞白血病细胞株U937(滨州医学院 肿瘤分子生物学重点实验室提供),RPMI 1640 培养液、胎牛血清(美国Hyclone公司);DNA 连接酶、DNA内切酶BbsⅠ、BamHⅠ、 PstⅠ、 反转录试剂盒(加拿大Fermentas公司);质粒 中量抽提试剂盒(爱思进生物技术有限公司); X-tremeGENE HP DNA转染试剂(Roche公司); RNAiso Plus总RNA提取试剂、PCR反应试剂盒 (日本TAKARA公司);MTT细胞增殖及细胞 毒性检测试剂盒、RIPA裂解液(碧云天生物技术 有限公司);细胞凋亡检测试剂盒(凯基生物公 司);兔抗人β-actin多克隆抗体(巴傲得生物科技 有限公司);辣根酶标记山羊抗兔IgG(中杉金桥 生物有限公司);兔抗人HOXA7多克隆抗体(博 士德生物有限公司);HOXA7和内参β-actin引物 (赛百盛生物技术有限公司)。 1.2 方法 1.2.1 靶向HOXA7特异性真核表达载体的构建 1.2.1.1 shRNA的设计、合成
根据前期实验成 功筛选出的沉默HOXA7效率最高的一对siRNA (small interfere RNA,siRNA),引物序列为:正 义链5'-CCTCCTACGACCAAAACAT-3' ,反义链 5'-ATGTTTTGGTCGTAGGAGG-3',设计相应短 发夹RNA(short hairpin RNA,shRNA),命名为 shHOXA7,同时设计与HOXA7及人类基因组无同 源性的阴性对照shNC,shRNA模板序列由上海吉 玛公司合成,见表 1。
|
|
表 1 设计合成的shHOXA7和shNC序列 Table 1 Sequences of shHOXA7 and shNC |
取溶解后的shRNA正义链、 反义链各5 μl、10×shDNA Annealing Buffer 5 μl、 灭菌水35 μl配成退火反应液,按下列程序进行退火 反应:95ºC 5 min,85ºC 5 min,75ºC 5 min,70ºC 5 min,得到双链shRNA模板,用于连接反应。 1.2.1.3 酶切
将pGPU6/GFP/Neo载体用内切酶 BbsI和BamHI 37ºC酶切1 h,琼脂糖电泳后进行凝 胶回收,用于连接反应。 1.2.1.4 连接
取退火后的双链shRNA模板和酶切 后载体按摩尔比3:1比例,由T4 DNA连接酶在22℃ 连接1 h。 1.2.1.5 转化
将连接产物转化感受态细胞DH5α, 取200 μl转化后的DH5α均匀涂布于含卡那霉素 (50 μg/ml)的LB培养板上,于37℃培养箱中培 养过夜筛选阳性克隆重组质粒载体。 1.2.1.6 鉴定
从LB培养板上挑取阳性克隆,接 种于含卡那霉素(50 μg/ml)的LB培养液中,37℃ 恒温摇床培养16 h,抽提质粒,用BamHⅠ,PstⅠ 分别酶切鉴定,酶切正确的交上海英俊生物公司 进行测序,测序正确的菌株进行高纯度提取,分 别命名为pGPU6/GFP/Neo-shHOXA7和阴性对照 pGPU6/GFP/Neo-shNC。 1.2.2 U937细胞培养
人白血病细胞株U937在10%胎牛血清和青霉素 (浓度为100 u/ml)、链霉素(浓度为0.1 mg/ml) 双抗的完全培养液中,置于37℃、5%CO2培养箱 中培养,根据细胞生长状况,2~3天传代一次,取 对数生长期细胞进行后续实验。 1.2.3 U937细胞转染
将对数生长期U937细胞接种于细胞培养板 上。实验分3组:空白对照组(不加转染试剂和 质粒载体)、阴性对照组(加转染试剂和pGPU6/ GFP/Neo-shNC)、实验组(加转染试剂和pGPU6/ GFP/Neo-shHOXA7),根据X-tremeGENE HP DNA转染试剂说明书,优化转染条件,pGPU6/ GFP/Neo-shHOXA7和pGPU6/GFP/Neo-shNC分别 用不含抗生素和血清的RPMI 1640培养液稀释,混 匀后取X-tremeGENE HP DNA转染试剂加入稀释好 的重组载体中,混匀后室温孵育30 min,小心将混 合物加到U937细胞中,置于37℃、5%CO2培养箱 中培养,24~72 h后进行相关指标检测。 1.2.4 RT-PCR检测HOXA7 mRNA表达情况
取对数生长期的U937细胞,以6×105个/孔接 种于6孔板,根据1.2.3分组及方法进行转染,转染 24 h后,收集细胞,提取细胞总RNA,测定RNA 纯度及浓度,两步法进行RT-PCR。所用引物序 列如下:HOXA7 正义链 5'-ACC GAC ACT GAA AGC TGC CG-3',反义链 5'-AGG TCC TGA AGA CCG CAT CC-3',扩增长度为410 bp。β-actin 正义 链5'-CTC CAT CCT GGC CTC GCT GT-3',反义链 5'-GCT GTC ACC TTC ACC GTT CC-3',扩增长度 为268 bp。按下列条件进行RT-PCR反应:95℃预 变性5 min;95℃变性30 s,55℃退火45 s,72℃延 伸30 s,共进行35个循环;72℃延伸10 min。实验 重复3次。PCR产物经1%琼脂糖凝胶电泳鉴定,采 用Tanon Gel凝胶图像分析软件分析,以HOXA7与 β-actin的灰度比值表示HOXA7相对表达量,计算 实验组对HOXA7的抑制率。HOXA7 抑制率=[1-实 验组(HOXA7相对表达量)/空白对照组(HOXA7 相对表达量)]×100% 1.2.5 Western blot检测HOXA7蛋白表达情况
取对数生长期U937细胞,以6×105个细胞/孔 接种于6孔板,根据1.2.3分组及方法进行转染,转 染48 h后,收集细胞,RIPA+PMSF裂解抽提细胞 总蛋白,取40 μg蛋白进行10%SDS-PAGE电泳分 离,将蛋白电转移至硝酸纤维素膜上,用含7%脱 脂奶粉的TBST封闭2.5 h,加兔抗人HOXA7多克隆 抗体(稀释度为1 : 100),4℃摇床过夜,经TBST充 分漂洗,加辣根酶标记山羊抗兔二抗(稀释度为1:5 000),室温摇床上放置2 h后洗膜,化学发光法显 色。用β-actin(稀释度为1 : 3 000)作内参重复以 上步骤。实验重复3遍。采用Chemiscope软件分析 图像,以HOXA7与β-actin的灰度比值表示HOXA7 相对表达量,计算实验组对HOXA7的抑制率。 HOXA7 抑制率=[1-实验组(HOXA7相对表达量) /空白对照组(HOXA7相对表达量)]×100% 1.2.6 MTT法检测细胞的增殖能力
取对数生长期U937细胞,以3×104个/孔接种 于96孔板,根据1.2.3分组及方法进行转染,每组 设5个平行孔,分别于转染24、48、72 h后,每 孔加入MTT 20 μl(5 mg/ml),继续置于37℃、 5%CO2培养箱中培养4 h,离心后小心吸出孔中 培养液,每孔加DMSO 150 μl,摇床上避光振荡 15~20 min,酶标仪检测各孔在560 nm处的吸光度 值(A560),5个平行孔取平均值计算各组细胞增 殖抑制率(inhibitory rate,IR),分别检测转染 24、48、72 h后各组细胞IR,实验重复3次。Ir= (1-实验组A560/空白对照组A560)×100%。 1.2.7 流式细胞术检测细胞的凋亡情况
取对数生长期的U937细胞,以6×105个/孔接种 于6孔板,根据1.2.3分组及方法进行转染,转染48 h 后离心收集细胞(2 000 r/min离心5 min),用PBS 洗涤细胞2次(2 000 r/min离心5 min)收集,加入 500 μl Binding Buffer悬浮细胞,加Annexinⅴ-FITC 和 Propidium Iodide(PI)各5 μl后混匀,室温避光 反应15 min后流式细胞仪检测各组细胞的凋亡率, 实验重复3次。 1.3 统计学方法
采用SPSS13.0统计软件进行数据统计分析,结
果以 ±s表示,多组间比较采用单因素方差分析,
多组间两两比较采用LSD检验,P<0.05为差异有统
计学意义。
2 结果
2.1 酶切鉴定重组质粒
±s表示,多组间比较采用单因素方差分析,
多组间两两比较采用LSD检验,P<0.05为差异有统
计学意义。
2 结果
2.1 酶切鉴定重组质粒
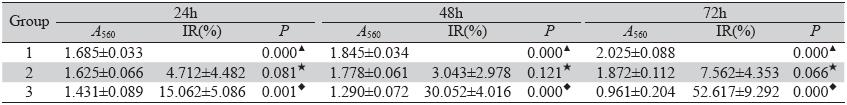
退火后的双链shRNA模板与酶切后的载体 pGPU6/GFP/Neo连接形成重组质粒,挑取2个单 克隆,分别用内切酶BamHⅠ和PstⅠ进行酶切鉴 定,由于载体pGPU6/GFP/Neo的BbsⅠ和BamHⅠ 酶切位点之间是PstⅠ的酶切位点,重组质粒因目 的基因的插入,PstⅠ酶切位点被取代,因此不能 被内切酶PstⅠ切开,重组载体因保留了BamH Ⅰ 酶切位点,因此能被内切酶BamHⅠ切开,酶切 后显示出一条约5 100 bp的条带,插入目的基因条 带太小(约60 bp)不能显示,见图 1。鉴定正确 的2个菌株进行测序,测序结果显示插入的目的片 段序列正确,证明重组质粒载体pGPU6/GFP/NeoshHOXA7 构建成功。
 |
1 and 2(left) digested by BamHⅠ;1 and 2(right) digested by PstⅠ;M: DNA marker 图 1 pGPU6/GFP/Neo-shHOXA7重组载体酶切鉴定 Figure 1 Identification of pGPU6/GFP/Neo-shHOXA7 recombination vector by restriction enzyme digestion |
RT-PCR检测各组细胞中HOXA7 mRNA相对 表达量分别为:实验组(66.946±7.249)%、阴性 对照组(117.797±8.855)%、空白对照组(127.536± 6.193)%,实验组与空白对照组和阴性对照组相比 差异均有统计学意义(P<0.05),而阴性对照组 与空白对照组相比差异无统计学意义(P>0.05)。实 验组HOXA7 mRNA相对表达量明显低于阴性对照 组和空白对照组,抑制率为(47.314±7.394)%,见图 2。
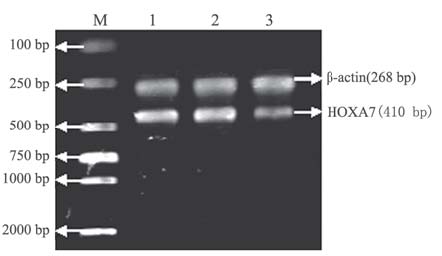 |
1:blank control group;2:negative control group;3:experimental group; M:marker 图 2 RT-PCR检测各组细胞HOXA7 mRNA表达情况 Figure 2 The expression of HOXA7 mRNA in each group detected by RT-PCR |
Western blot检测各组细胞中HOXA7蛋白相对 表达量,实验组[(39.339±4.706)%]明显低于阴性 对照组[(75.665±7.090)%]和空白对照组[(83.344± 5.883)%](P<0.05),抑制率为(52.371±9.258)%,而 阴性对照组和空白对照组HOXA7蛋白相对表达量 相比差异无统计学意义(P>0.05),见图 3。
 |
1:blank control group;2:negative control group;3:experimental group 图 3 Western blot检测各组细胞HOXA7蛋白表达情况 Figure 3 The expression of HOXA7 protein in each group detected by Western blot |
重组质粒载体转染U937细胞24、48、72 h后, MTT法检测各组细胞增殖情况,各时间点实验组 与阴性对照组和空白对照组IR相比,差异有统计 学意义(P<0.05),且随时间延长,实验组细胞 IR增加,细胞增殖受抑制效果越明显。而各时间 点阴性对照组和空白对照组IR相比,差异无统计 学意义(P>0.05) ,见表 2。
|
|
表 2 不同时间点各组细胞增殖抑制情况 Table 2 The proliferation inhibition rate of each group cells at different time points |
流式细胞术检测各组细胞的凋亡情况,空 白对照组、阴性对照组和实验组细胞凋亡率分 别为(5.067±0.983)%、(6.743±1.075)%、(24.677± 4.161)%,其中,实验组明显高于空白对照组和阴 性对照组,差异均有统计学意义(P<0.05),空 白对照组和阴性对照组相比,差异无统计学意义 (P>0.05),见图 4。
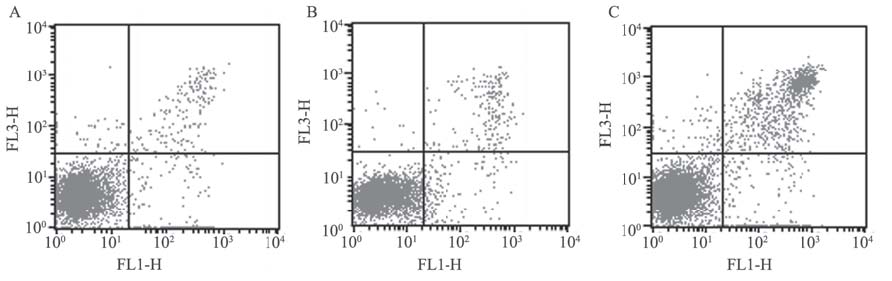 |
A: blank control group;B: negative control group;C:experimental group 图 4 流式细胞术检测各组细胞凋亡率的情况 Figure 4 The apoptosis rate of each group cells detected by fl ow cytometry |
白血病发病率在儿童恶性肿瘤中占首位,随 生物学技术发展,白血病基因治疗逐渐成为根治 白血病的新方案,近年来受到广泛关注。在造血 细胞增殖分化过程中,HOX基因家族通过与靶基 因特异性结合发挥重要调控作用。Wheadon等[ 2 ] 运用鼠胚胎干细胞体内分化模型研究发现,HOX 基因以剂量依赖性在造血调控过程中发挥主导作 用,随造血分化,大多数HOX基因表达下调, 而白血病原癌基因Tel/PDGFRβ短暂诱导能引起 HOXA7等HOX基因异常表达,从而引发白血病。 Argiropoulos等[ 3 ]发现,MEIS1作为HOX基因的辅 因子,能加速反转录病毒介导多种HOX基因过表 达导致白血病的发生,提示包含HOXA7在内的 HOX基因通路调控异常与白血病发生密切相关。
HOXA7异常高表达在白血病发生发展、信号 转导、治疗及预后等方面均发挥了重要作用。许 多白血病相关融合基因(如混合谱系白血病基因 MLL、核孔蛋白NUP98等)通过上调其转录靶标 HOXA7导致白血病发生[ 4, 5, 6 ]。Afonja等[ 7 ]检测了14 种人类髓系白血病细胞系中HOXA7的表达情况, 发现GDM-1、THP-1、MOLM-9等10种白血病细胞 系中均高表达HOXA7,进一步研究HOXA7在白血 病患者中的表达情况显示,50%AML患者骨髓细 胞中高表达HOXA7,且高表达HOXA7的患者经传 统化疗后很难达到临床缓解,提示HOXA7高表达 与白血病发生、白血病患者对化疗的反应差密切 相关,因此,抑制HOXA7高表达有望成为白血病 基因治疗的新方法。
RNAi是由外源性和内源性双链RNA介导的, 能够特异性降解其同源mRNA,并抑制相应基因 表达的技术。RNAi以siRNA为工具沉默致病基 因。目前制备siRNA的方法主要有以下4种:(1) 直接化学合成siRNA;(2)体外转录合成siRNA; (3)用RNaseⅢ消化长片段双链RNA得到siRNA; (4)利用质粒或病毒载体表达siRNA,质粒或病毒 载体转染细胞后可以稳定表达,因而得到广泛应 用。本实验通过设计合成质粒载体pGPU6/GFP/ Neo-shHOXA7,并转染U937细胞,转录出相应 shRNA,shRNA在胞内被Dicer酶剪切成siRNA而 发挥抑制HOXA7的作用,RT-PCR和Western blot分 别检测pGPU6/GFP/Neo-shHOXA7在mRNA和蛋白 水平对HOXA7的抑制率分别达(47.314±7.394)%和 (52.371±9.258)%,该载体的成功构建为靶向RNAi 抑制HOXA7高表达方面的研究奠定了实验基础。
目前国内外对RNAi抑制HOXA7对白血病影 响的研究较少。Orlovsky等[ 8 ]在NOD/SCID小鼠中 研究发现,在双表型白血病细胞株RS4:11中沉默 HOXA7后能阻碍白血病细胞在骨髓中的植入,并 抑制白血病细胞在小鼠体内增殖。本实验MTT结 果显示,RNAi抑制HOXA7表达后U937细胞增殖 明显受抑,且随时间延长,抑制效果越明显,这 与Gessner等[ 9 ]研究的siHOXA7沉默HOXA7表达后 通过抑制端粒酶转录和端粒酶反转录酶TERT活性 从而抑制白血病细胞增殖的结论相同。本实验运 用流式细胞术检测各组细胞凋亡率,发现RNAi抑 制HOXA7表达后,与阴性对照组和空白对照组相 比,实验组白血病细胞U937的凋亡率明显增加。 因此,RNAi抑制HOXA7高表达能有效抑制白血病 细胞增殖并促进其凋亡,HOXA7有望成为白血病 基因治疗的新靶点。
| [1] | Eklund EA. The role of HOX genes in malignant myeloid disease[J]. Curr Opin Hematol,2007,14(2):85-9. |
| [2] | Wheadon H, Ramsey JM, Dobbin E, et al. Differential Hox expression in murine embryonic stem cell models of normal and malignant hematopoiesis[J]. Stem Cells Dev,2011,20(8):1465-76. |
| [3] | Argiropoulos B, Humphries RK. Hox genes in hematopoiesis and leukemogenesis[J]. Oncogene,2007,26(47):6766-76. |
| [4] | Ayton PM, Cleary ML. Transformation of myeloid progenitors by MLL oncoproteins is dependent on Hoxa7 and Hoxa9[J]. Genes Dev,2003,17(18):2298-307. |
| [5] | Gough SM, Slape CI, Aplan PD. NUP98 gene fusions and hematopoietic malignancies: common themes and new biologic insights[J]. Blood,2011,118(24):6247-57. |
| [6] | Wang GG, Cai L, Pasillas MP, et al. NUP98-NSD1 links H3K36 methylation to Hox-A gene activation and leukaemogenesis[J]. Nat Cell Biol,2007,9(7):804-12. |
| [7] | Afonja O, Smith JE Jr, Cheng DM, et al. MEIS1 and HOXA7 genes in human acute myeloid leukemia[J]. Leuk Res,2000,24(10):849-55. |
| [8] | Orlovsky K, Kalinkovich A, Rozovskaia T, et al. Down-regulation of homeobox genes MEIS1 and HOXA in MLL-rearranged acute leukemia impairs engraftment and reduces proliferation[J]. Proc Natl Acad Sci USA,2011,108(19):7956-61. |
| [9] | Gessner A, Thomas M, Castro PG, et al. Leukemic fusion genes MLL/AF4 and AML1/MTG8 support leukemic self-renewal by controlling expression of the telomerase subunit TERT[J]. Leuke mia,2010,24(10):1751-9. |
 2014, Vol.41
2014, Vol.41