2.妇产科
2. Department of Gynaecology and Obstetrics
氯化锂(lithium chloride,LiCl)是治疗躁郁 型精神障碍的主要药物,是糖原合成酶激酶-3 (GSK-3)的抑制剂。大量研究显示,氯化锂在人体多个系统中具有广泛的生理调节作用,在神经 变性、糖尿病、中风、肿瘤、慢性炎症等疾病中 有一定的治疗意义[ 1 ];在造血系统中能增强造血干 细胞的自我更新和增殖分化能力,临床上用于放 化疗后造血系统的恢复[ 2 ],相关机制研究发现,这 些作用均与其对GSK-3的抑制密切相关[ 3 ]。但氯化 锂对白血病细胞THP-1的作用,目前尚未见报道, 本文研究了氯化锂对THP-1细胞增殖、凋亡、周期 的影响,并初步观察了氯化锂作用后细胞内Wnt通 路的变化情况。 1 材料与方法 1.1 材料
人THP-1白血病细胞株购自美国ATCC公司。 RPMI1640培养液购自美国Gibco公司,胎牛血清 购自杭州四季青公司。氯化锂购自美国Sigma公 司。噻唑蓝(MTT)、二甲基亚砜(DMSO)、 碘化吡啶(PI)购于美国Sigma公司。Annexin V-FITC/PI双染试剂盒购自南京凯基生物公司。 GSK3β、P-GSK3β(Ser9)、β-catenin、c-myc、 cyclinD1兔抗人单克隆抗体均购自美国C e l l Signaling公司,GAPDH鼠抗人单克隆抗体购自美 国Epitomics公司。皮克级化学发光底物试剂盒购 自美国Thermo公司。 1.2 细胞增殖MTT实验
将细胞(1×104 /ml)接种于96孔板,200微升 /孔,加入终浓度为0、2、 4、 8、 16、 32、64及 128 mM/ml的氯化锂,以不加细胞和药物的培养 基为空白对照,每组设4个平行复孔。分别于培养 后24、48、72、96 h后,每孔加入5 mg/ml MTT20 μl,继续培养4 h,离心去除上清,每孔加入200 μl DMSO,振荡溶解,酶标仪492 nm波长处测吸光 度(A),按如下公式计算抑制率。
抑制率%=[1- ( A实验组 - A空白对照组 ) / (A阴性对照组 - A空白对照组 )]×100% 1.3 流式细胞术检测细胞凋亡
氯化锂各浓度作用THP-1细胞24、48 h后,收 集细胞,PBS洗涤两次后,取1×106细胞,用500 μl 的Binding Buffer重悬,加入2 μl Annexin V-FITC 和 5 μl PI,混匀,室温避光反应15 min后,于1 h内上 机检测。 1.4 流式细胞术检测细胞周期分布
收集氯化锂各浓度处理24、48 h细胞,PBS洗 涤两次,取5×105细胞离心后沉淀物,加入70%冰 乙醇-20℃过夜。离心去上清,沉淀用200 μlPBS 重悬,加入20 μlRNA酶,室温5 min,再加入50 μl PI,室温避光20 min,于1 h内上机检测。 1.5 Wnt通路的Western blot检测
收集氯化锂各浓度处理4、12、24、48 h的细 胞,用RIPA蛋白裂解液提取收集细胞蛋白质,用 考马斯亮蓝法测定蛋白浓度。取80 μg变性后蛋白 样品上样于10%SDS-PAGE,电泳后冰浴电转至 PVDF膜上,5%脱脂奶粉室温封闭1 h,加入各一 抗抗体4℃孵育过夜。TBS洗膜后,加入荧光二抗 室温孵育1 h。TBS洗膜,用皮克级化学发光底物 试剂盒进行曝光显影。 1.6 统计学方法
结果数据以均数±标准差( ±s)表示,应用
GraphPad Prism 5.0 软件进行统计分析,t检验分析
实验组和对照组之间差异,以P<0.05为差异具有
统计学意义。
2 结果
2.1 氯化锂对THP-1细胞增殖的影响
±s)表示,应用
GraphPad Prism 5.0 软件进行统计分析,t检验分析
实验组和对照组之间差异,以P<0.05为差异具有
统计学意义。
2 结果
2.1 氯化锂对THP-1细胞增殖的影响
MTT法检测显示,8~128 mM/ml氯化锂作 用THP-1细胞24、48、72、96 h,其抑制率均 明显高于对照组(8 mM/ml24、48、72 h时, P=0.0079、P=0.0079、P=0.0076;8 mM/ml作用 96 h以及16~128mM/ml 作用24、48、72、96 h,P 均<0.0001),且抑制率随浓度增大和时间延长而 增加。当4 mM/ml氯化锂作用白血病THP-1细胞96 h,其抑制率也明显高于对照组(P=0.0002,), 见图 1。
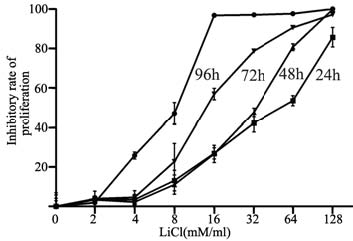 |
图 1 氯化锂对THP-1细胞增殖的影响 Figure 1 Effects of LiCl on proliferation of THP-1 cells |
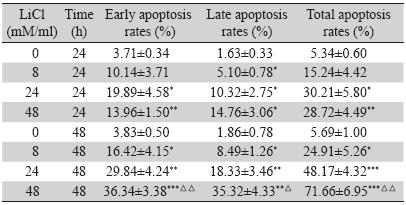
以流式散点图右下象限的早期凋亡细胞与 右上象限的晚期凋亡细胞之和表示总凋亡率。 结果显示,氯化锂8 mM/ml作用24 h,细胞凋 亡率与对照组相比,差异无明显统计学意义 (P=0.0908),而作用48 h后,细胞凋亡率明显高 于对照组(P=0.023);24和48 mM/ml氯化锂分别 作用24、48 h,细胞凋亡率明显高于对照组(24 mM/mL作用24、48 h ,P=0.013、P=0.0007,48 mM/ml作用24、48 h,P=0.0067、P=0.0007);且 48mM/ml氯化锂作用48 h与作用24 h相比,凋亡率 明显增高,差异有统计学意义(P=0.0066),见 表 1、图 2。
|
|
表 1 流式细胞术检测氯化锂作用THP-1细胞后的凋亡率(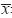 ±s,
n=3)
Table 1 Effects of LiCl on apoptosis rates of THP-1 cells
detected by fl ow cytometry( ±s,
n=3)
Table 1 Effects of LiCl on apoptosis rates of THP-1 cells
detected by fl ow cytometry(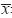 ±s,n=3) ±s,n=3) |
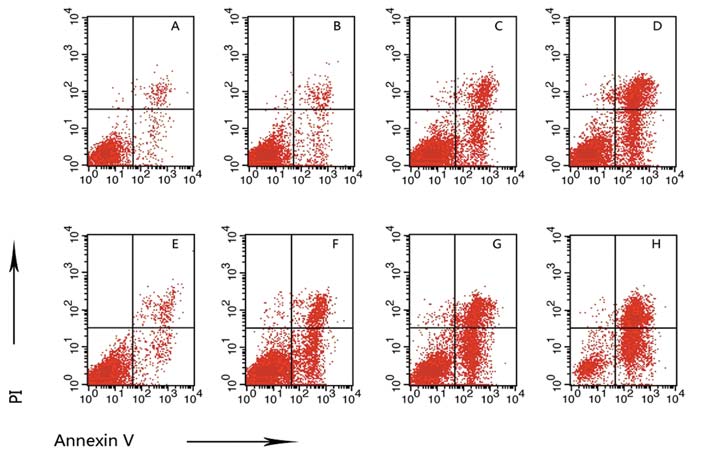 |
A,B,C,D: 0,8,24,48mM/ml treatment for 24h,respectively; E,F,G,H: 0,8,24,48mM/ml treatment for 48h,respectively 图 2 THP-1细胞经氯化锂处理后的凋亡检测 Figure 2 Effects of LiCl on apoptosis of THP-1 cells |
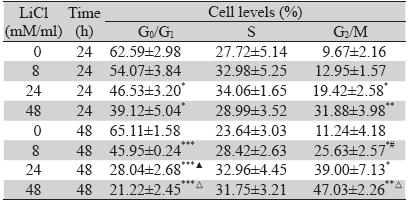
流式细胞术检测细胞周期分布,结果显示: 氯化锂8 mM/ml作用细胞24 h,细胞周期变化不 明显(G0/G1期P=0.1543,S期P=0.514,G2/M期 P=0.2887),8 mM/ml作用48 h、24和48 mM/ml 分别作用24和48 h,与对照组相比,G0/G1期细胞 比例明显减少(8 mM/ml作用48 h,P=0.0003, 24 mM/ml作用24、48 h,P=0.0214、P=0.0003; 48 mM/ml作用24、48 h,P=0.0161、P=0.0001), G2/M期细胞比例明显增多(8 mM/ml作用48 h, P=0.0427;24 mM/ml作用24、48 h,P=0.0446、 P=0.0283;48 mM/ml作用24、48 h,P=0.0081、 P=0.0017),S期细胞比例变化不明显(8 mM/ml 作用48 h,P=0.2997;24 mM/ml作用24、48 h, P=0.3058、P=0.1587;48 mM/ml作用24、48 h, P=0.8481、P=0.1404);48 mM/ml作用细胞48 h和 作用24 h相比,G0/G1、G2/M期细胞比例均差异显 著(P=0.0331,P=0.0297)。提示氯化锂将THP-1 细胞阻滞于G2/M期,且浓度越大、时间越长,阻 滞越明显,见表 2、图 3。
|
|
表 2 流式细胞术检测氯化锂作用THP-1细胞后的周期分布
(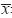 ±s,n=3)
Table 2 Effects of LiCl on cell cycle of THP-1 cells detected
by fl ow cytometry( ±s,n=3)
Table 2 Effects of LiCl on cell cycle of THP-1 cells detected
by fl ow cytometry(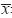 ±s,n=3) ±s,n=3) |
 |
A,B,C,D: 0,8,24,48mM/ml treatment for 24h,respectively; E,F,G,H: 0,8,24,48mM/ml treatment for 48h,respectively 图 3 THP-1细胞经氯化锂处理后的周期检测 Figure 3 Effects of LiCl on cell cycle of THP-1 cells |
氯化锂8、24、48 mM/ml作用于THP-1细胞4、 12、24、48 h,用Western blot检测Wnt通路各蛋白 表达情况,结果显示,与对照组相比,t-GSK3β在 各浓度各时间作用下,表达基本不变;p-GSK3β表 达升高;β-catenin随浓度增加和时间延长而升高; 氯化锂各浓度作用4和12 h时,β-catenin下游c-myc 表达升高,8和24 mM/ml作用24h,以及8 mM/ml作 用48 h时,c-myc蛋白表达也升高,而在48mM/ml作 用24 h,24和48 mM/ml作用48 h时,c-myc蛋白表达 则下调;β-catenin下游另一蛋白cyclinD1则在氯化 锂各浓度各时间作用下表达变化不明显,见图 4。
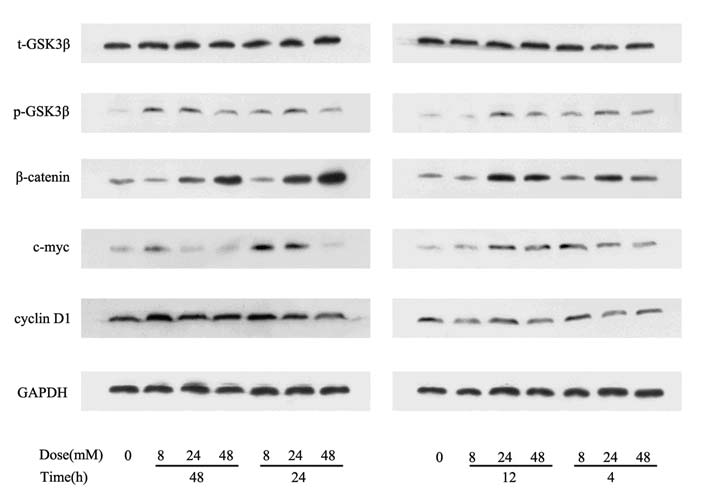 |
图 4 Western blot检测THP-1细胞经氯化锂作用后Wnt信号通路的变化 Figure 4 Effects of LiCl on expressions of Wnt signaling pathway proteins in THP-1 cells |
糖原合成酶激酶-3(GSK-3)是一种多功能 丝/苏氨酸蛋白激酶,普遍存在于所有真核细胞 生物,在多个信号转导通路中扮演重要角色,影 响细胞的基因表达、蛋白合成、糖原代谢以及增 殖、凋亡等生理过程,GSK-3的异常调节可能导 致糖尿病、心血管疾病、神经精神疾病等多种人 类疾病的发生[ 4 ]。以及肿瘤的发生与进展,其对肿 瘤调控最重要的一条途径是参与Wnt/β-catenin信号 通路。Wnt通路活化能抑制 GSK-3活性,使胞浆 内β-catenin水平升高并发生核转移,进入胞核的 β-catenin与转录因子TCF/LEFs结合,从而刺激下 游促癌基因(c-myc、cyclinD1、MMP-7)的高表 达,由此推测,抑制GSK-3可能促进肿瘤生长[ 5 ]。 但是,事实并非如此,有研究证实,在GSK3β缺 失的小鼠中,β-catenin和cyclinD1水平并不升高; 在结肠腺瘤性息肉病基因(APC)突变的小鼠中使用 GSK-3抑制剂氯化锂并不能导致肿瘤的发生;还有 研究表明长期使用氯化锂治疗精神疾病的人群肿 瘤发生率低于普通人群。因此,GSK-3对肿瘤是促 进还是抑制,目前仍存争议,一方面,GSK-3通 过对β-catenin的调节抑制肿瘤发生,但另一方面, GSK-3抑制剂却并不增加肿瘤发生率,相反对肿 瘤有一定的抑制作用,这可能与GSK-3参与除Wnt/ β-catenin通路以外的其他调节途径有关[ 6 ]。
多个研究表明,在血液系统恶性肿瘤,如慢 性粒细胞白血病(CML)、急性淋巴细胞白血病 (ALL)和急性髓系白血病(AML)中,均能检 测到Wnt通路的活化[ 7 ]。也有文献报道,GSK-3 抑制剂BIO对白血病细胞系有生长抑制作用[ 8, 9 ] , GSK-3是急性髓系白血病(AML)一个潜在的治 疗靶点[ 10 ]。然而,GSK-3抑制剂氯化锂对白血病 细胞系THP-1的生长以及细胞内Wnt通路的影响, 目前还未有相关研究。本实验中,氯化锂能抑制 THP-1细胞的增殖,且具有浓度和时间依赖性, 流式细胞术检测发现,不同浓度的氯化锂作用于 THP-1细胞24和48 h,细胞凋亡率均明显高于对照 组。此外,氯化锂对THP-1细胞的周期影响显著, 在不同浓度和时间的处理下,细胞阻滞于G2/M 期,S期变化不明显,G0/G1期细胞相对减少。对细 胞内Wnt通路进行Western blot检测,可以发现,不 同浓度氯化锂分别作用THP-1细胞4、12、24、48 h,Wnt通路活化,β-catenin随着作用时间和浓度 的增加表达明显升高,其下游c-myc蛋白在作用时 间短,浓度低时表达升高,但随着作用时间的延 长和浓度的增加,其表达也逐渐降低,而另一下 游分子cyclinD1则表达不变。
由此推测,在THP-1细胞中,氯化锂有效抑 制了GSK-3的活性,使得Wnt通路活化,β-catenin 升高,在短时间和低浓度情况下,促进下游靶基 因c-myc的表达,使得c-myc水平升高,c-myc是 细胞周期和凋亡相关蛋白,能促进细胞进入细胞 周期和发生凋亡[ 11,12 ] ,因此在本实验中,氯化锂短 时间低浓度的刺激即可促进THP-1细胞从G0/G1期 进入G2/M期,并同时发生凋亡。然而,随着作用 时间和浓度的增加,抑制GSK-3可能通过其他途 径抑制c-myc表达,从而使得c-myc下调,细胞发 生周期阻滞和凋亡[ 13,14 ] ,因此THP-1细胞被阻滞 于G2/M期,凋亡亦可同时发生。作为重要的肿瘤 调控蛋白[ 15 ],c-myc的表达变化可能是氯化锂抑 制白血病细胞THP-1生长的机制之一。另外,当 β-catenin升高,cyclinD1可能受其调控升高,但同 时,抑制GSK-3也能抑制NF-κB途径,使其下游 的cyclinD1下调,因此,氯化锂作用THP-1细胞可 能导致cyclinD1表达水平不变[ 5,6 ]。 当然,c-myc和 cyclinD1参与了细胞复杂的周期和凋亡调控系统, 氯化锂对THP-1细胞周期和凋亡的影响尚不能仅通 过c-myc和cyclinD1的变化来解释,还有待进一步 的研究。
总之,虽然GSK-3对肿瘤的调控机制尚不明 朗,但本实验证明了GSK-3抑制剂氯化锂能抑制 白血病细胞THP-1的生长,促进细胞凋亡和诱导 G2/M期阻滞,发挥抗白血病作用,为进一步探索 氯化锂在白血病中的作用机制,以及临床治疗白 血病的可行性提供了一定的研究基础。
| [1] | Gould TD, Gray NA, HK. Effects of a glycogen synthase kinase-3 inhibitor, lithium, in adenomatous polyposis coli mutant mice[J].Pharmacol Res, 2003, 48(1): 49-53. |
| [2] | Huang J, Zhang Y, Bersenev A, et al. Pivotal role for glycogen synthase kinase-3 in hematopoietic stem cell homeostasis in mice[J]. J Clin Invest, 2009, 119(12): 3519-29. |
| [3] | Grimes CA, Jope RS. The multifaceted roles of glycogen synthase kinase 3beta in cellular signaling[J]. Prog Neurobiol, 2001, 65(4): 391-426. |
| [4] | Rayasam GV, Tulasi VK, Sodhi R, et al. Glycogen synthase kinase 3: more than a namesake[J]. Br J Pharmacol, 2009, 156(6): 885-98. |
| [5] | Luo J. Glycogen synthase kinase 3beta (GSK3beta) in tumorigenesis and cancer chemotherapy[J]. Cancer Lett, 2009, 273(2): 194-200. |
| [6] | Ougolkov AV, Billadeau DD. Targeting GSK-3: a promising approach for cancer therapy?[J]. Future Oncol, 2006, 2(1): 91-100. |
| [7] | Ge X, Wang X. Role of Wnt canonical pathway in hematological malignancies[J]. J Hematol Oncol, 2010, 3:33. |
| [8] | Song EY, Palladinetti P, Klamer G, et al. Glycogen synthase kinase--3β inhibitors suppress leukemia cell growth[J]. Exp Hematol, 2010, 38(10): 908-21. |
| [9] | Holmes T, O’Brien TA, Knight R, et al. Glycogen synthase kinase-3beta inhibition preserves hematopoietic stem cell activity and inhibits leukemic cell growth[J]. Stem Cells, 2008, 26(5): 1288-97. |
| [10] | Banerji V, Frumm SM, Ross KN, et al. The intersection of genetic and chemical genomic screens identifies GSK-3α as a target in human acute myeloid leukemia[J]. J Clin Invest, 2012, 122(3): 935-47. |
| [11] | Dang CV. c-Myc target genes involved in cell growth, apoptosis, and metabolism[J]. Mol Cell Biol, 1999, 19(1): 1-11. |
| [12] | Shortt J, Johnstone RW. Oncogenes in cell survival and cell death[J]. Cold Spring Harb Perspect Biol, 2012, 4(12). |
| [13] | Ryves WJ, Harwood AJ. The interaction of glycogen synthase kinase-3 (GSK-3) with the cell cycle[J]. Prog Cell Cycle Res, 2003, 5:489-95. |
| [14] | Cornils H, Kohler RS, Hergovich A, et al. Downstream of human NDR kinases: impacting on c-myc and p21 protein stability to control cell cycle progression[J]. Cell Cycle, 2011, 10(12): 1897-904. |
| [15] | Albihn A, Johnsen JI, Henriksson MA. MYC in oncogenesis and as a target for cancer therapies[J]. 2010, 107:163-224. |
 2014, Vol.41
2014, Vol.41