2.机能实验中心
2. Center of Functional Experiment
多烯紫杉醇治疗前列腺癌易产生耐药性,大 部分患者接受治疗后发展成激素抵抗性或难治 性前列腺癌。DU145细胞为多烯紫杉醇耐药细胞株,且细胞表面高表达Somatostatin Receptor Subtype 2(SSTR2)和Subtype5 (SSTR5)受体。奥曲 肽主要是通过与靶细胞受体(SSTR)特异性结合 后,通过SSTR进行信号转导调控,进而调控靶细 胞的功能[1]。奥曲肽具有抑制细胞增殖、诱导凋亡 和抗肿瘤的作用,且临床应用不良反应小。本实 验通过采用多烯紫杉醇与奥曲肽联合应用对前列 腺癌DU145细胞的体外肿瘤抑制作用研究,旨在 探讨奥曲肽对多烯紫杉醇耐药人前列腺癌DU145 细胞株药物敏感度的影响及可能的机制,为临床 治疗提供依据。 1 材料与方法 1.1 材料
前列腺癌细胞DU145由美国弗雷德癌症 研究中心(FHCRC)惠赠。多烯紫杉醇购自 Sigma公司,奥曲肽(善宁)购自诺华公司。 DMEM/F12 1:1高糖培养液与胎牛血清购自 Thermo公司。RNA反转录试剂盒购自Fermentas life science公司。引物由苏州金唯智生物科技有 限公司合成。引物序列(5′----3′)CASP3-F: CTCATACCTGTGGCTGTGTATC,CASP3-R GCTCCTTTTGCTGTGATCTTC 498 bp。 ACBC1-F GTCGGAATGGATCTTGAAGGG, ACBC1-R ACATCAAACCAGCCTATCTCC 500 bp。CASP9-F AGAGATTCGCAAACCAGAGG, CASP9-R CAAGATAAGGCAGGGTGAGG 493 bp。VEGFA-F CCGAAACCATGAACTTTCTGC, VEGFA-R CCTTTCCCTTTCCTCGAACTG 456 bp。β-actin-F AAGGGCCATCCACAGTCTTC, β-actin-R AGAAGGCTGGGGCTCATTG 250 bp。 1.2 方法 1.2.1 MTT法分别检测不同浓度多烯紫杉醇﹑奥 曲肽及不同浓度多烯紫杉醇与奥曲肽(100 nM)联合应用对DU145细胞的增殖抑制作用
消化细胞,制备单细胞悬液,接种于96孔 板,每孔3×103个;待细胞贴壁后,加入不同浓度 DTX(5、10、20、50、100 nM),不同浓度OCT (10、102、103、104、0.5×105 nM)及不同浓度 DTX与奥曲肽(100 nM)联合作用,每组5个复 孔,同时设不加药物为对照组及只加培养液的调 零孔。每孔终体积为200 μl,置37℃的CO2培养箱 继续培养;药物处理24 h后,取出一块培养板,弃 培养液,用PBS清洗两遍,每孔加MTT 20 μl,培养 液100 μl,继续孵育4 h。去上清液,每孔加DMSO 150 μl,孵育15 min;摇床混匀10 min,酶标仪450 nm测各孔的吸光值,计算抑制率。同样方法分别 检测48 h及72 h的OD值。细胞增殖抑制率=[1-(实 验组OD值-调零孔OD值)/(对照组OD值-调零孔 OD值)]×100%。实验重复三次根据MTT结果后 续实验分四组:空白对照组﹑DTX组﹑DTX/OCT 组及DTX组,DTX浓度为10 nM,OCT浓度为100 nM。 1.2.2 RT-PCR检测各组细胞VEGF AmRNA﹑ Caspase9 mRNA﹑Caspase3 mRNA及ABCB1 mRNA的表达
实验分组同上,各组药物处理24 h后使用 Trizol总RNA提取试剂盒提取各组RNA,反转录 成cDNA,按以下条件进行PCR反应:预变性94℃ 5 min;变性 94℃ 30 s;退火 55℃~60℃ 45 s; 延伸,共30~35个循环,72℃ 45 s 。最终延伸, 72℃ 7 min。琼脂糖凝胶电泳:取5 μl PCR产物与 2 μl 6×loadding buffer溶液混匀后加入到琼脂糖凝 胶梳孔内,另将DNA Maker上样至其他孔内。90 V 电压条件下电泳(20~25)min,在凝胶成像扫描仪 中观察琼脂糖凝胶,并拍照。Quantity one分析软件 测得其灰度值,以目的条带/β-actin mRNA条灰度比 值计算,实验重复三次,结果以均数±标准差表示。 1.2.3 划痕实验检测人前列腺癌DU145各组细胞 迁移能力
用记号笔在六孔板背后划线,每隔1 cm一道 线,每孔至少穿过三条线,消化细胞铺板。细胞 密度长到80%~90%时,用10 μl枪头垂直六孔板背 后横线划痕。弃旧培养液,PBS洗三遍,加入2% 培养液及药物,实验分组同上。倒置显微镜下观 察,24 h后照相记录各交叉点结果,实验重复三 次。 1.3 统计学方法
实验数据以均数±标准差(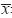 ±s)表示,根据
实验设计选择完全随机设计的单因素方差分析和t
检验比较均值差异性。所有数据统计均采用SPSS
12.0统计软件完成。所有作图均采用GraphPad
Prism 5.0软件完成。
2 结果
2.1 奥曲肽与多烯紫杉醇及联合用药对细胞生长
的抑制作用
±s)表示,根据
实验设计选择完全随机设计的单因素方差分析和t
检验比较均值差异性。所有数据统计均采用SPSS
12.0统计软件完成。所有作图均采用GraphPad
Prism 5.0软件完成。
2 结果
2.1 奥曲肽与多烯紫杉醇及联合用药对细胞生长
的抑制作用
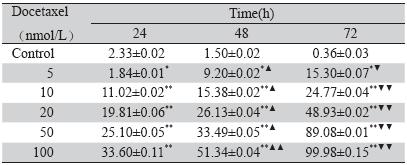
不同浓度的DTX(5 nM~100 nM)对DU145细胞 的增殖均有明显抑制作用,随着浓度和时间的增 高抑制作用均增大,100 nM DTX在72 h节点能完 全抑制DU145细胞的增殖。提示DTX对DU145细胞 抑制作用具有时间剂量依赖性。多烯紫杉醇处理 细胞72 h的IC50值为(24.55±0.36) nM,见表 1、图 1。
|
|
表 1 多烯紫杉醇对DU145细胞的增殖影响 Table 1 Effects of docetaxel on DU-145 cell proliferation |
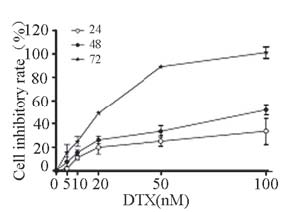 |
图 1 多烯紫杉醇不同浓度及时间对DU145细胞的增殖影响 Figure 1 Effects of docetaxel at different concentrations and time on DU-145 cell proliferation |
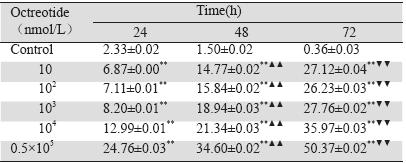
OCT(10~0.5×105 nM)单独应用时对细胞具 有一定的抑制作用,OCT在10 nM至104 nM浓度 范围内,对细胞的抑制作用没有明显的剂量依赖 性,具有时间依赖性,见图 2﹑表 2。0.5×105 nM的 OCT对DU145细胞的抑制作用非常明显,镜下可 观察到细胞凋亡。
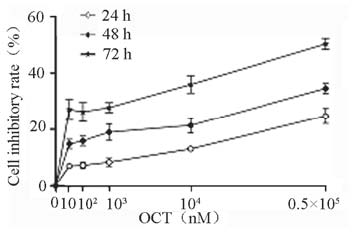 |
图 2 奥曲肽不同浓度及时间对DU145细胞的增殖影响 Figure 2 Effects of octreotide at different concentrations and time on DU-145 cell proliferation |
|
|
表 2 奥曲肽对DU145细胞的增殖影响 Table 2 Effects of octreotide on DU-145 cell proliferation |
DTX(5~100)nM与OCT(100 nM)联合应 用时抑制率均高于单独用药组抑制率,在72 h时 最明显,见图 3。联合用药72 h后,DU145对多 烯紫杉醇的IC50与多烯紫杉醇组相比降低[(11.85± 0.25)vs.(24.55±0.36),(P﹤0.01)]。表明OCT增强 了DTX对DU145细胞的药物敏感度。OCT(100 nM)/DTX(10 nM)联合用药组细胞抑制率均高 于单独用药组,[(55.70±0.08)% vs.(26.23±0.03)%, (24.77±0.04) %,(P﹤0.01)],见图 4。
 |
**:P<0.01,compared with DTX group 图 3 奥曲肽增强DU145细胞对多烯紫杉醇的敏感度 Figure 3 Octreotide enhanced the sensitivity of DU-145 cells to docetaxel |
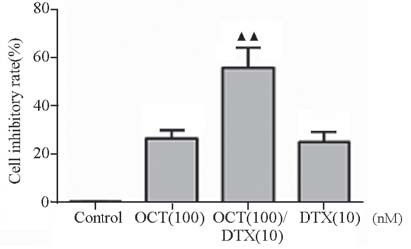 |
▲▲:P<0.01,compared with OCT(100)group;DTX(10)group 图 4 多烯紫杉醇与奥曲肽联合作用于DU-145细胞72 h的 抑制作用 Figure 4 Inhibitory effect of docetaxel and octreotide combinaton on DU-145 cells for 72 h |
RT-PCR检测多烯紫杉醇与奥曲肽联合用药24 h 对DU145细胞VEGFAmRNA﹑Caspase9mRNA﹑ Caspase3 mRNA及ABCB1 mRNA表达的影响。结 果见图 5~8,其中A图为PCR电泳结果图,B图为数 据统计图。
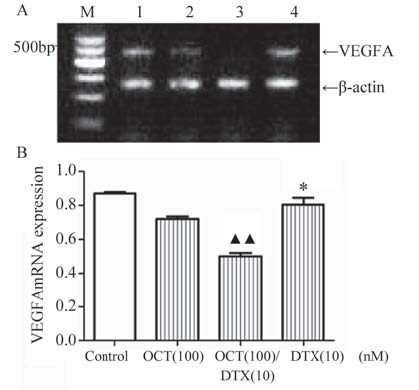 |
A: the result of PCR electrophoresis;M: marker;1.control;2.OCT (100nM);3.OCT(100nM)/DTX(10nM);4.DTX(10nM) B: statistics;*:P<0.05,compared with OCT(100)group;▲▲:P<0.01 ,compared with OCT(100)group,DTX(10)group 图 5 多烯紫杉醇与奥曲肽联合用药作用于DU145细胞24 h VEGFAmRNA的表达 Figure 5 Expression of VEGFA mRNA in DU-145 cells after docetaxel and octreotide combinaton treatment for 24h |
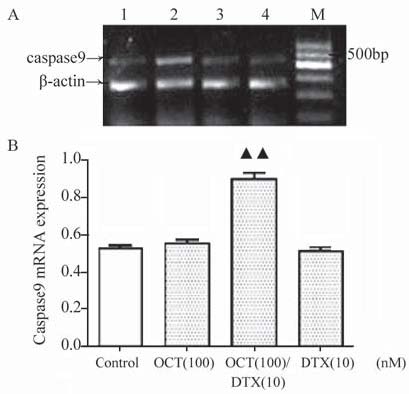 |
A :M: marker;1:control;2:OCT(100nM);3:OCT(100nM)/DTX (10nM);4:DTX(10nM) B: ▲▲:P<0.01,compared with OCT(100)group,DTX(10)group 图 6 多烯紫杉醇与奥曲肽联合用药作用于DU145细胞 24 h Caspase9 mRNA的表达 Figure 6 Expression of Caspase 9 mRNA in DU-145 cells after docetaxel and octreotide combinaton treatment for 24h |
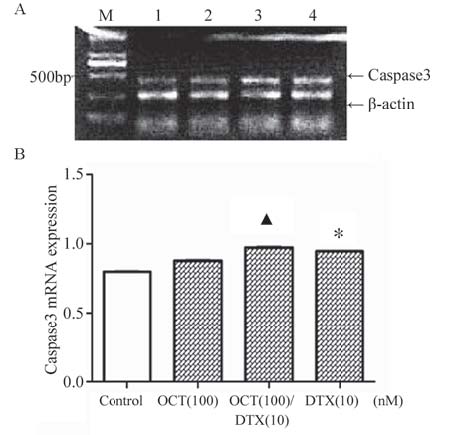 |
A:M:marker;1:control; 2:OCT(100nM);3:OCT(100nM) /DTX(10nM);4:DTX(10nM) B:*:P<0.05,compared with OCT(100)group;▲:P<0.05,compared with OCT(100)group,DTX(10)group 图 7 多烯紫杉醇与奥曲肽联合用药作用于DU145细胞24 h Caspase3mRNA的表达 Figure 7 Expression of Caspase3 mRNA in DU-145 cells after docetaxel and octreotide combinaton treatment for24h |
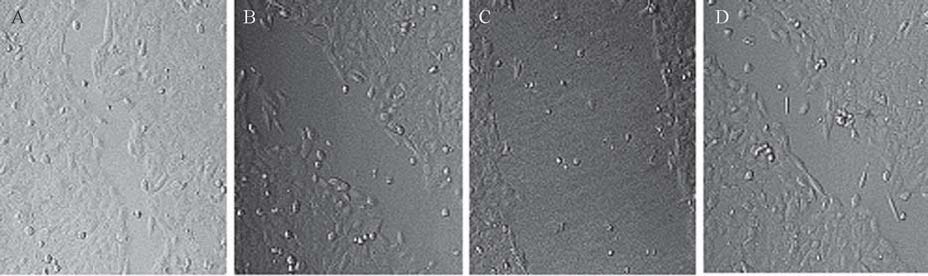 |
A :control(×200); B:OCT(100nM)(×200);C:OCT(100nM)/ DTX(10nM)(×200);D:DTX(10nM)(×200) 图 8 多烯紫杉醇与奥曲肽联合用药作用于DU145对细胞迁移的影响 Figure 8 Effects of docetaxel and octreotide combinaton on cell migration of DU-145 cells |
VEGFAmRNA的相对表达量由图 5可以观察 到联合用药组与对照组﹑100 nM OCT组﹑10 nM DTX组[(0.50±0.04) vs.(0.87±0.02)﹑(0.72±0.03)﹑ (0.78±0.03) ;(P﹤0.01)]相比表达下降,单独用 药组与对照组相比表达有下降(P﹤0.05),其 中100 nM OCT组的表达低于10 nM DTX组(P﹤ 0.05);如图 6所示各组均有Caspase9mRNA的表 达,联合用药组与对照组﹑100 nM OCT组﹑10 nM DTX组[(0.90±0.06) vs.(0.53±0.03)﹑(0.55±0.04)﹑ (0.51±0.04);(P﹤0.01)]相比表达升高;各组均 有Caspase3 mRNA的表达,联合用药组与对照组﹑ 100 nM OCT组﹑10 nM DTX组[(0.97±0.01) vs.(0.80 ±0.01)﹑(0.88±0.01)﹑(0.94±0.00);(P﹤0.05)]相 比相对表达量升高。其中10nM DTX组的表达高于 100nM奥曲肽组(P﹤0.05),药物处理组均高于 对照组(P﹤0.05),见图 7。ABCB1 mRNA的表 达相互之间没有差异。 2.3 多烯紫杉醇与奥曲肽对细胞迁移的影响
由图 8可以观察到,A图为对照组细胞,划痕 区几乎愈合;B图OCT(100nM)组和D图DTX (10nM)组划痕区均有细胞迁移,迁移距离均 小于对照组,C图为OCT(100 nM)/ DTX(10 nM)组细胞几乎没有迁移。结果表明两种药物均 能抑制细胞的迁移能力,联合用药时抑制作用最大。 3 讨论
多烯紫杉醇诱导细胞凋亡主要通过增大Bcl-2 磷酸化水平,下调Bcl-xL蛋白表达水平,诱导p53和 抗血管生成因子的生成[2]。此外凋亡还和特定基因 的表 达有关,如半胱氨酸酶(Caspases)家族。
Caspase家族以非活性酶原存在,被激活后, 可以有序地引起各种Caspases参与下游细胞蛋白的 连锁反应,引起细胞凋亡。实验组中细胞随着DTX 药物浓度的增加,细胞形态发生变化:细胞变圆﹑ 脱落﹑胞质中出现空泡及胞膜皱缩等凋亡典型改 变。并且浓度越高,时间越长,变化越明显。这从 形态学上证实了多烯紫杉醇对DU145细胞的抑制作 用。我们同时采用MTT法证实了DTX对人前列腺 癌的抑制作用具有时间和剂量依赖性。
生长抑素(somatostatin,SST)是十四肽类抑 制剂,具有多种分泌作用并参与多种细胞活动, 包括抑制细胞分泌和增殖。这些细胞功能的实现 是通过SST与6个G蛋白偶联受体(SSTR1,2A, 2B,3,4和5)结合介导。SST作用的靶目标均 表达不同亚型的SSTRs[3]。多项体外实验证实SST 与SSTRs之间连接具有特异性。所有的受体亚型 (SSTR1-5)都介导细胞抑制作用,而SSTR2和 SSTR5可以介导细胞凋亡。人类前列腺癌DU145 细胞表达SSTR2和SSTR5。因此SSTRs可能成为治 疗前列腺癌的潜在靶点。大量研究表明,SST及其 类似物对多种实体瘤具有抑制作用,如胃癌﹑结 肠癌﹑胰腺癌﹑肺癌﹑肝癌﹑前列腺癌等[4]。这种 抑制作用与SST诱导的肿瘤细胞凋亡有关[5],并且 SST及其类似物与其他化疗药物联合应用时可以增 强多种肿瘤细胞对药物的敏感度[6]。
奥曲肽(OCT)是人工合成的八肽SST类似 物,与SSTR2和SSTR5亚型受体具有较高的亲和 力。本实验发现不同浓度奥曲肽对细胞均具有一 定抑制作用,抑制作用非常小,没有剂量依赖 性,显微镜下观察细胞凋亡不明显。但是随着时 间延长,细胞抑制作用增大,并且差异具有统计 学意义。OCT对细胞的抑制作用具有时间依赖 性。本实验使用的OCT是临床用药,采用不同稀 释倍数处理细胞,实验使用的药物浓度受限于药 物本身最大浓度。稀释的最大浓度是0.5×105 nM。 此时培养细胞72 h,可以观察到部分细胞有明显 的凋亡形态改变。我们推测,随着细胞浓度的增 大,细胞凋亡会增加。
DTX是目前已知能够明显延长难治性前列腺 癌生存时间的药物,但是其临床应用非常有限。 DTX临床应用易产生耐药性,大部分患者经过 DTX治疗后出现转移,并且DTX细胞毒性强,除 了作用于肿瘤细胞也作用于正常细胞。这种不具 有选择性的药物作用导致临床应用产生广泛的不 良反应。血液系统不良反应有白细胞减少。神经 毒性主要表现在四肢末梢麻木,并随着用药浓度 的升高而加剧。此外还有严重的过敏反应等。而 OCT在临床上应用非常广泛,不良反应少[1]。关键 一点OCT和高表达SSTR2、SSTR5受体的前列腺癌 细胞结合,靶向作用于癌细胞。本实验目的在于 DTX与OCT联合应用于细胞,一方面减少DTX的 用药剂量,降低不良反应和细胞耐药性,另一方 面通过OCT靶向作用癌细胞提高药物疗效。MTT 结果显示OCT能够明显增加DTX对DU145细胞的 敏感度。
细胞凋亡是受基因调控的细胞自主启动的程 序性死亡方式,是一种非常复杂病理和生理过 程。近年来许多研究证实肿瘤的发生与凋亡密切 相关。研究肿瘤细胞凋亡有可能为临床治疗肿瘤 提供依据。实验研究表明所有动物细胞凋亡机制 类似,其中Caspase家族在凋亡中具有重要作用。 Caspase3是凋亡启动蛋白[7]。活化的Caspase3既 可以激活下游底物Caspase3﹑Caspase9,共同降 解底物,也可以直接降解底物,如降解DNA,使 其片段化等[8]。本实验发现联合用药组Caspase3 mRNA和Caspase9 mRNA表达均升高,单独用 药组Caspase9 mRNA表达无变化,单独用药组 Caspase3 mRNA表达有差异,DTX组高于OCT组 (P < 0.05),提示联合用药可能激活Caspase3和 Caspase9促进细胞启动凋亡机制。
恶性肿瘤最大的特点是转移和扩散,对肿瘤 患者危害极大。肿瘤转移的首要条件是血管生 成,是肿瘤生物学行为的重要因素[9]。VEGFA是 重要的血管生成因子,可以刺激内皮细胞增殖、 迁移和增强血管通透性。目前VEGFA被认为是特 异性高、作用最强的血管生成因子[10]。VEGFA主 要是通过与VEGER1和VEGFR2特异性结合,受 体磷酸化激活胞内信号转导通路发挥作用[11]。最 新的实验显示VEGFA还可以促进人淋巴血管内皮 细胞的迁移和增生[12]。多种肿瘤包括前列腺癌高 表达VEGFA[13],在胃癌﹑乳腺癌[14]中发现VEGFA 的表达和肿瘤的转移有关。本实验初步证实了 VEGFA表达的变化和前列腺癌DU145细胞的迁移 正相关。DTX及OCT部分抑制VEGFA的表达, OCT的抑制作用大于DTX的抑制作用,差异有统 计学意义。OCT(100)/DTX(10)组抑制作用增强。 实验结果表明OCT(100)/DTX(10)对细胞迁移抑制 作用增强可能和VEGFA的表达有关。
我们在同样条件下检测了耐药基因ABCB1的 表达,各组间无差异。ABCB1是药物代谢转运通 路中蛋白,在多药耐药中起主导作用。实验证实 联合用药对耐药基因ABCB1的表达没有影响。
目前DTX是治疗前列腺癌的一线药,能够有 效延长患者的寿命,但是延长时间有限。奥曲 肽具有靶向抑制肿瘤细胞的作用,两者联合用 药,可以降低多烯紫杉醇的剂量,减少不良反应 及增大杀伤作用。但是奥曲肽作用于表达SSTR2 与SSTR3的靶细胞才能发挥抑制作用和促凋亡作 用。多烯紫杉醇与奥曲肽联合处理细胞能否应用 于临床仍需要进一步研究。
| [1] | Hejna M, Schmidinger M, Raderer M. The clinical role of somatostatin analogues as antineoplastic agents: much ado about nothing?[J] Ann Oncol,2002,13(5):653-68. |
| [2] | Gligorov J, Lotz JP. Preclinical pharmacology of the taxanes: implications of the differences[J]. Oncologist,2004,9 Suppl 2:3-8. |
| [3] | Lo Nigro C, Maffi M, Fischel JL, et al. The combination of docetaxel and the somatostatin analogue lanreotide on androgenindependent docetaxel-resistant prostate cancer: experimental data[J]. BJU Int,2008,102(5):622-7. |
| [4] | Kewkkeboom DJ,Mueller-Brand J, Paganelli G, et al. Overview of results of peptide receptor radionuclide therapy with 3 radiolabled somatostatin analogs[J]. J Nucl Med,2005,46 Suppl 1:62S-6S. |
| [5] | Bondanelli M, Ambrosio MR, Zatelli MC, et al. Regression of liver metastases of occult carcinoid tumor with slow release lanreotide therapy[J]. World J Gastroenterol,2005,11(13):2041-4. |
| [6] | Vuaroqueaux V, Dutour A, Briard N, et al. No loss of sst receptors gene expression in advanced stages of colorectal cancer[J]. Eur J Endocrinol,1999,140(4):362-6. |
| [7] | Mikati MA,Zeinieh M,Habib RA,e t a l. Changes in sphingomyelinases, ceramide, Bax, Bcl(2), and caspase-3 during and after experimental status epilepticus[J].Epilepsy Res,2008,81(2-3):161-6. |
| [8] | Sharma AK,Jordan WH,Reams RY,et al. Temporal profile of clinical signs and histopathologic changes in an F-344 rat model of kainic acid-induced mesial temporal lobe epilepsy[J].Toxicol Pathol,2008,36(7):932-43. |
| [9] | Schmidt T,Carmeliet P. Angiogenesis: a target in solid tumors, also in leukemia?[J] Hematology Am Soc Hematol Educ Program,2011,2011:1-8. |
| [10] | Guo XL,Wang BQ,Liu T,et al. The Expression of VEGF-A, VEGF-C and VEGF-R3 and its Relationship with Node Metastasis in Laryngeal Squamous Cell Carcinoma[J]. Shi Yong Ai Zheng Za Zhi,2009,24(1):15-8. [彭晓林,王斌全,刘涛,等.VEGF-A、VEGF-C、VEGF-R3 在喉癌中的表达及其与淋巴转移的关系[J].实用癌症杂志,2009,24(1):15-8.] |
| [11] | Luan N,Wang XF. The investigation and progression about VEGF-C in the course of metastasis of tumour[J]. Xian Dai Zhong Liu Yi Xue, 2009,17(9):1805-1807.[栾宁,王雪峰.VEGF-C 与肿瘤转移的研究进展[J].现代肿瘤医学,2009,17(9):1805-7.] |
| [12] | Hirakawa S,Kodama S,Kunstfeld R,et al. VEGF-A induces tumor and sentinel lymph node lymphangiogenesis and promotes lymphatic metastasis[J]. J Exp Med,2005,201(7):1089-99. |
| [13] | Hoeben A,Landuyt B,Highley MS,et al. Vascular endothelial growth factor and angiogenesis [J].Pharmacol Rev,2004,56(4):549-80. |
| [14] | Mohammed RA,Green A,El-Shikh S,et al.Prognostic significance of vascular endothelial cell growth factors -A, -C and -D in breast cancer and their relationship with angio- and lymphangiogenesis[J].Br J Cancer,2007,96(7):1092-100. |
 2014, Vol.41
2014, Vol.41