2.甘肃省中药药理与毒理学重点实验 室中西医结合基础室;
3.敦煌医学与转化省部共建教育部重 点实验室
2. Traditional Chinese medicine and Western medicine Basic Room of Key Laboratory of pharmacology and toxicology of Traditional Chinese Medicine of Gansu Province;
3. Key Laboratory of Dunhuang medicine and Transformation of Education Ministry and Gansu Province
恶性肿瘤在中医学中多属积的范畴,按发病 阶段分为气滞血阻、瘀血内结、正虚瘀结3个证 型,分别予以理气通络、活血消积;祛瘀软坚、 调理脾胃;补益气血、活血化瘀。参归丸首见 于《古今医鉴》卷九,由苦参、当归2:1的比例 组成,有清热凉血之功。苦参性寒味苦,具有清 热燥湿、杀虫、利尿功效,据《神农本草经》记 载,苦参主心腹结气、症瘕积聚、溺有余沥、逐 水、除痈肿等。当归性温味辛微苦,功效为补血 活血、调经止痛、润燥滑肠。两药合用符合中医 治疗肿瘤之扶正祛邪、攻补兼施的基本法则。研 究证明多种苦参活性成分具有显著体内抗肿瘤活 性[1, 2, 3],当归的活性成分具有免疫调节和促进造血 的作用[4, 5]。 本实验研究了参归丸对小鼠移植瘤的 抑瘤作用及对顺铂化疗的增效减毒作用。 1 资料与方法 1.1 材料 1.1.1 动物
SPF级昆明小鼠100只,雌雄各半,体质 量20~22 g,由甘肃中医学院SPF级动物实验中心 提供,动物合格证号: SCXK(甘) 2011-0001,SPF 级动物实验设施使用证号:SYXK(甘)2011-0001。 1.1.2 细胞株
H22肝癌瘤株由本实验室传代培养。 1.1.3 药物与试剂
RPMI1640(美国Invitro公司), 顺铂注射液,每只10 mg,齐鲁制约有限公司(批 号: 201002CF); HIF1α 试剂盒,上海源叶生物科 技有限公司(批号:20121001A);LDH试剂盒, 南京建成生物工程研究所(批号:20121011)。 参归丸为自制汤剂(0.45 g/ml)。 1.1.4 仪器
CO2培养箱(NAPCO法国),SWCJ- IF超净台(中国苏州净化设备厂),电子天平 (LD100001,龙腾电子有限公司),Abacus Junior vet 5动物血清分析仪(兰桥医疗),酶标仪(680 型,美国BD-RAD公司),UV1101紫外-可见分光 光度仪(上海天美科学有限公司)。 1.2 方法 1.2.1 参归丸汤剂的制备
将当归饮片15 g,苦参 饮片30 g放在陶土药锅中,加500 ml去离子水浸泡 30 min,煎药1 h,将药液倒入烧杯中,再加500 ml 去离子水浸泡30 min,煎药1 h,将两次煎出液混 合后在水浴锅中水浴加热浓缩到100 ml,高压灭 菌。药物浓度按生药量计算为 0.45 g/ml。 1.2.2 动物模型制备
在无菌条件下,在SPF级实验室内取100只KM小鼠,雌雄各半,实验室条件下 适应环境4 d后,按随机数字表法分出雌雄各8只,设 为正常对照组。取传代 7 天的腹水型 H22小鼠腹水, 用0.9%氯化钠溶液调至细胞浓度为2 ×106个/毫升, 将84只小鼠以 75% 乙醇消毒,按常规方法皮下注 射配制好的 H22肝癌细胞悬液 0.2 ml,接种于昆明 小鼠右前腋皮下,细胞计数约为4 ×105个,以出现 皮丘为皮下接种部位正确。5~7天内观察小鼠接种 部位的肿瘤生长情况,接种部位触及到结节为接 种成功[6]。 1.2.3 模型动物分组及处理
第8天剔除接种不成 功的小鼠,随机挑选接种成功的小鼠,雌雄各32 只随机分为模型对照组、顺铂组、参归丸组和参 归丸加顺铂组,每组 16 只。分组后称重,模型对 照组灌胃和腹腔注射0.9%氯化钠溶液0.4 ml/20 g, 0.2 ml/20 g;顺铂组灌胃0.9%氯化钠溶液0.4 ml/20 g, 以每天2.0 mg/kg腹腔注射顺铂0.2 ml/20 g;参归丸 组以每天 9 g/kg灌胃0.4 ml/20 g 参归丸药液,腹腔 注射0.9%氯化钠溶液0.4 ml/20 g;参归丸加顺 铂组组以每天 9 g/kg灌胃参归丸药液,腹腔注射 2.0 mg/kg顺铂0.2 ml;连续给药 14 天。 1.2.4 指标检测
(1)小鼠一般状态观察及计算。 观察小鼠生存状态,记录小鼠的神态、发育、营 养、活动、饮食、二便等,反映小鼠的一般情 况。记录开始给药第1天和处死时的体质量,计算 治疗前后的体质量变化。体质量变化=处死时的体 质量-分组给药时的体质量。有效体质量变化=处 死时的体质量-肿瘤质量-分组给药时的体质量。 (2)计算抑瘤率、q值、肿瘤指数、器官指数。剥 离瘤体组织,摘取肝、脾、肾、胸腺后分别称质 量。计算抑瘤率、肿瘤、肝脏、肾脏、脾脏、胸 腺等的指数。抑瘤率 (%)=(模型对照组平均瘤体质 量-实验组平均瘤体质量) /模型对照组平均瘤体质 量。q值计算:两药联合应用时可能表现为拮抗、 相加或协同。拮抗是指联合用药的效应低于强效 应药物的效应。相加是联合用药的效应为两药的 效应和。协同是指联合用药的效应大于两药各自效 应的和,可以通过计算q值来具体确定两药联合应 用时相互间的作用。q=EAB/(EA+ EB-EA×EB) [7-8]。 式中EA为A药(参归丸)抑瘤率,EB为B药(顺 铂)抑瘤率,EAB为联合用药组两药合用的抑瘤 率,q=0.85~1.15为两药作用相加,q>1.15为两药 作用增强(或协同),q<0.85为两药拮抗[7-8]。器官 指数 = 器官质量(mg) /体质量(g)。(3)血常规检测。 在1.5 ml离心管中加入0.9%氯化钠溶液80 μl,滴加20 μl新鲜血液,以动物血清分析仪检测血常规。 (4)HIF-1α和LDH检测。按照ELISA试剂盒说明书 检测血清HIF-1α,按照血生化试剂盒说明书检测 血清LDH。 1.3 统计学方法
应用SPSS17.0统计软件进行单因素方差分析。 样本实验数据以平均值±标准差(x±s)表示。以P <0.05为差异有统计学意义。 2 结果 2.1 荷瘤小鼠的一般状况
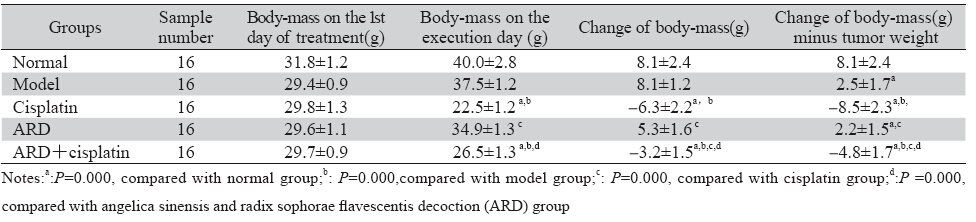
接种成功后,瘤块体积逐渐增大,外观呈球 形、半球形或山脉状。初期能活动,后来大多逐 渐变硬。分组前荷瘤小鼠身形匀称(瘤体隆起处 除外),动作敏捷,反应灵活,皮毛光滑,进食 进水正常; 分组7天后,随着实验时间的继续延 长,顺铂组小鼠最先出现精神萎靡,饮食活动减 少,聚集一团,皮毛成揪失去光泽,下腹部不洁 净,尿液变黄等现象,参归丸加顺铂组中上述现 象的出现比顺铂组较晚。模型组中上述现象的出 现又晚一些,参归丸组中上述现象的出现最晚。 从饮食、活动及毛发色泽来看,参归丸组小鼠生 存质量和生存状态均明显高于顺铂组。一般状况 比较表明顺铂整体状况最差。 2.2 各组小鼠体质量和有效体质量给药前后的变化
结果见表 1。
|
|
表 1 各组小鼠体质量及有效体质量变化比较(x±s) Table 1 Changes of bodyweight and bodyweight minus tumor weight(x±s) |
结果见表 2。q=EAB/[EA+(l-EA)EB]=0.709÷[0436 +(1-0.436)×0.600]≈0.92说明联合用药有相加作用。
|
|
表 2 各组瘤体质量(x±s)、肿瘤指数(x±s)及抑瘤率的比较 Table 2 Tumor weights(x±s),tumor indexes(x±s) and tumor inhibition rates |
结果见表 3。
|
|
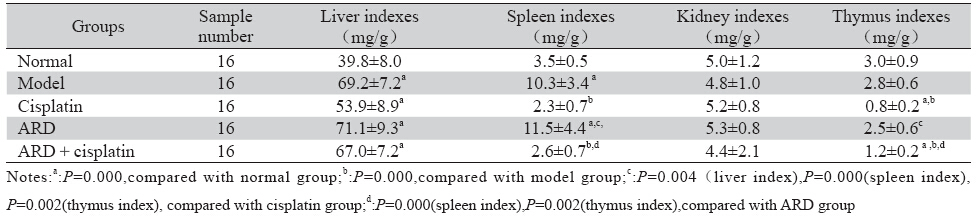
表 3 肝癌 H22荷瘤小鼠肝脏指数、脾脏指数、肾脏指数、胸腺指数比较(x±s) Table 3 Indexes of liver,spleen,kidney,thymus in H22 tumor-bearing mice(x±s) |
结果见表 4。
|
|
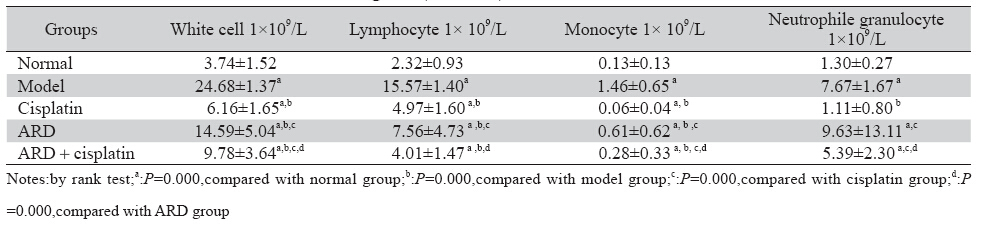
表 3 肝癌 H22荷瘤小鼠白细胞计数比较(n=10,x±s) Table 3 White cell counts of H22 tumor-bearing mice(n=10,x±s) |
结果见表 5。
|
|
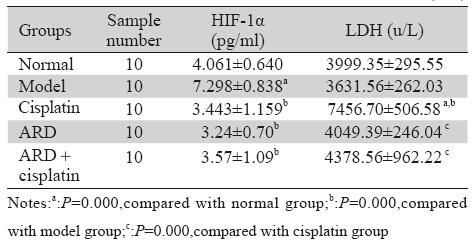
表 5 各组小鼠血清HIF-1α、LDH水平比较(x±s) Table 5 Serum levels of HIF-1α and LDH activities(x±s) |
本研究中小鼠移植瘤于注射瘤细胞悬液7日 后形成,即中医上的癌毒湿邪瘀久化热,炼液为 痰,酿生痰浊,积而为病,治当清热燥湿。参归 丸由当归、苦参以1:2比例组成,具有清热燥湿的 功效,以参归丸治疗皮下移植瘤方药对证,而且现 代研究认为苦参中的苦参碱[1]、氧化苦参碱[2]、槐 果碱[9]、槐定碱[10]等多种碱类物质对多种肿瘤细胞具有G0/G1期周期阻滞、增殖抑制、分化诱导、凋 亡诱导和抗恶病质活性,苦参黄酮类物质抗肿瘤 活性更强[3],为本实验取得较好疗效提供了研究基 础。本研究模型对照组小鼠肿瘤均值5.5 g >1 g,参 归丸组肿瘤抑制率43.6% >30%,参归丸组小鼠体 质量增加,参归丸联合顺铂组小鼠体质量下降不 超过15%,实验中各组小鼠未死亡,符合原卫生部 药政管理局制定的治疗恶性肿瘤的中药药效评价 标准[11]。
实验中参归丸组及参归丸联合顺铂给药组能 增加顺铂化疗荷瘤小鼠的有效体质量;改善荷瘤 小鼠的生存状态;对顺铂化疗所致中性粒细胞和 单核细胞减低有升高作用;参归丸能够拮抗顺铂 化疗引起的脾脏指数和胸腺指数降低,有升高脾 脏指数和胸腺指数的作用,对小鼠重要免疫器官 具有一定的保护作用;q值为0.92,说明参归丸和顺 铂联合应用存在相加作用。单体研究证实参归丸 中的当归多糖有改善机体免疫,对化疗引起的骨 髓抑制有促进造血作用[4, 5]。当归多糖能够提高放 疗小鼠的胸腺和脾脏指数,外周血红细胞计数和 白细胞计数,保护骨髓免于放疗所致的骨髓微核 的形成,促进骨髓造血[12]。研究结果未显示肾脏 指数的明显改变,可能与肾脏不参与机体免疫调 节有关。
恶性肿瘤的发生和转移与肿瘤细胞的耐受缺 氧能力及代谢有关。HIF-1α是组织细胞对低氧的 适应性反应,是独立于血氧浓度的敏感控制因 子,能够激活细胞内代谢废物清除基因[13]及VEGF 的表达[14],促进肿瘤组织代谢产物的清除及血管 生成。模型组HIF-1α过度表达,预后差[15]。HIF- 1α可以成为肿瘤治疗的潜在靶点,参归丸能够通 过下调HIF-1α抑制肿瘤细胞内代谢产物的清除, 促进肿瘤细胞死亡,其分子机制可能与苦参碱能 够剂量依赖性地降低肺腺癌细胞HIF-1α mRNA的 表达[16]有关。LDH同工酶是诊断心肝肾损伤的重 要指标,细胞膜损伤后释放到细胞外。队列研究 表明顺铂导致肾脏毒性及LDH高[17]。LDH升高, 肿瘤患者预后差[18]。参归丸降低顺铂化疗所致血 清LDH活性升高可能与苦参碱能够保护细胞膜的 完整性,减少LDH释放,降低血清LDH的活性有 关[19]。当归长于补血,濡养心肾等组织,减少顺 铂伤津耗气所致心肾细胞损伤[20]。精血同源,血能 生精,发挥肾(中医认为肾为先天之本,包括了肾 脏、性腺、肾上腺等的功能)藏精功能,使肾气健 旺,恢复肾主骨生髓(骨髓和脑髓)的功能,通过耳窍反映出来,为减轻顺铂化疗引起的中医肾系的 性腺抑制 [21]、肾毒性[17, 22]、精子及DNA(先天之本 的物质基础)毒性[23]、神经毒性[24]、耳毒性[25]、骨 髓抑制[26]提供了中医学理论依据。研究表明富含黄 酮和生物碱的吊灯树果实提取物能够显著消除顺 铂化疗所致睾丸毒性[21],顺铂等化疗药与抗肿瘤的 植物药物联合应用能够增强多药耐药肿瘤细胞对 顺铂等化疗药物的敏感度[27]。因此,研究具有抑 瘤作用及对化疗药物具有增效减毒作用的中药及其有效单体逐渐成为中医药研究的热点。参归丸 能够降低HIF-1α的浓度水平,消弱肿瘤细胞耐受 低氧的能力,促进肿瘤细胞死亡;参归丸能够降 低LDH的活性,减少LDH对正常细胞的损伤,从 而对顺铂化疗有减毒作用。苦参丸方药中含有多 种促进肿瘤细胞凋亡及调节免疫监视的抗肿瘤成 分,苦参碱注射液和当归多糖制剂已经应用于临 床。苦参黄酮、当归内酯等抗肿瘤成分有待于进 一步开发。
| [1] | Zhang Z, Wang X, Wu W, et al. Effects of matrine on proliferation and apoptosis in gallbladder carcinoma cells (GBC-SD)[J]. Phytother Res, 2012, 26(6):932-7. |
| [2] | Jin N, Zhao YX, Deng SH, et al. Preparation and in vitro anticancer activity of oxymatrine mixed micellar nanoparticles[J]. Pharmazie. 2011,66(7):506-10. |
| [3] | Berghe WV, De Naeyer A, Dijsselbloem N, et al. Attenuation of ERK/RSK2-driven NFκB gene expression and cancer cell proliferation by kurarinone, a lavandulyl fl avanone isolated from Sophora flavescens ait. roots[J]. Endocr Metab Immune Disord Drug Targets, 2011, 11(3):247-61. |
| [4] | Liu C, Li J, Meng FY, et al. Polysaccharides from the root of Angelica sinensis promotes hematopoiesis and thrombopoiesis through the PI3K/AKT pathway[J]. BMC Complement Altern Med, 2010,10:79. |
| [5] | Hui MK, Wu WK, Shin VY, et al. Polysaccharides from the root of Angelica sinensis protect bone marrow and gastrointestinal tissues against the cytotoxicity of cyclophosphamide in mice[J]. Int J Med Sci, 2006,3(1): 1-6. |
| [6] | Zhang MH, Wang XY,Wang XM, et al. Inhibition of Lycium barbarum polysaccharide on transplanted liver cancer in mice[J]. Zhong Cao Yao, 2012,43(6):1142-6.[张鸣号, 王秀玉,王秀梅, 等.枸杞多糖对小鼠移植性肝癌抑制作用的实验研究[J].中草 药, 2012,43(6):1142-6.] |
| [7] | Ling HY, Gu KS. The effec t of epirubici combined with nimotuzum ab on human hepatocellular carcinoma cell lineHepG2 in vitro[J]. Lin Chuang Zhong Liu Xue Za Zhi, 2011,16(2):113-7.[ 凌华毓, 顾康生. 尼妥珠单抗联合表阿霉素对人肝癌细胞株 HepG2体外生长的影响[J]. 临床肿瘤学杂志, 2011,16(2):113-7.] |
| [8] | Wang J , Ma SM, Chen XH. Antitumor Efect o f Thalidomide Combined with Cyctlophosphamide and Its Antitumor Mechanism[J].Zhongguo Yi Yao Gong Ye Za Zhi,2011,42 (12): 918.[王娟,马淑梅, 陈秀华. 沙利度胺合并环磷酞胺的抗肿瘤作用 及相关作用机制研究[J]. 中国医药工业杂志,2011,42 (12 ):918.] |
| [9] | Liang L, Wang XY, Zhang XH, et al. Sophoridine exerts an anticolorectal carcinoma effect through apoptosis induction in vitro and in vivo[J]. Life Sci, 2012,91(25-26):1295-303. |
| [10] | Zhang Y, Wang S, Li Y, et al. Sophocarpine and matrine inhibit the production of TNF-alpha and IL-6 in murine macrophages and prevent cachexia-related symptoms induced by colon26 adenocarcinoma in mice[J]. Int Immunopharmacol,2008,8(13-14): 1767-72. |
| [11] | Drug Administration of Health Ministry o People’s Republic of China. Protocol for the study of Traditional Chinese Medicine and new drugs[M]. Beijing: Drug Administration of Health Ministry o People’s Republic of China, 1994:104.[中华人民共和国卫生部 药政局.中药新药研究指南[M].北京:中华人民共和国卫生部 药政管理局,1994:104.] |
| [12] | Zhao L, Wang Y, Shen HL, et al. Structural characterization and radioprotection of bone marrow hematopoiesis of two novel polysaccharides from the root of Angelica sinensis (Oliv.) Diels[J]. Fitoterapia,2012, 83(8):1712-20. |
| [13] | Kitagawa N, Kondo S, Wakisaka N, et al. Expression of seven-inabsentia homologue 1 and hypoxia-inducible factor 1 alpha: novel prognostic factors of nasopharyngeal carcinoma[J]. Cancer Lett, 2013,331(1):52-7. |
| [14] | Cheng C, Cai S, Wang G, et al. c-Myc enhances colon cancer cell-mediated angiogenesis through the regulation of HIF-1α[J]. Biochem Biophys Res Commun, 2013, 430(2): 505-11. |
| [15] | Takala H, Saarnio J, Wiik H, et al. HIF-1α and VEGF are associated with disease progression in esophageal carcinoma[J]. J Surg Res, 2011,167(1): 41-8. |
| [16] | ZHOU Juan,NI Songshi,BEN Suqin. Effect of matrine on proliferation and HIF-1α,VEGF expression of A549 cells [J]. Shandong Yi Yao, 2012,52(3):25-7.[周娟,倪松石,贲素琴. 苦参碱 对人肺腺癌A549 细胞增殖及HIF-1α、VEGF 表达的影响[J]. 山东医药,2012,52(3):25-7.] |
| [17] | Nishihara K, Masuda S, Shinke H, et al. Urinary chemokine (C-C motif) ligand 2 (monocyte chemotactic protein-1) as a tubular injury marker for early detection of cisplatin-induced nephrotoxicity[J]. Biochem Pharmacol, 2013, 85(4): 570-82. |
| [18] | Cangemi G, Reggiardo G, Barco S, et al. Prognostic value of ferritin, neuron-specific enolase, lactate dehydrogenase, and urinary and plasmatic catecholamine metabolites in children with neuroblastoma[J]. Onco Targets Ther,2012, 5: 417-23. |
| [19] | Chen F,Huang K. Effects of the Chinese medicine matrine on experimental C. parvum infection in BALB/c mice and MDBK cells[J]. Parasitol Res,2012, 111(4):1827-32. |
| [20] | Demkow U, Stelmaszczyk-Emmel A. Cardiotoxicity of cisplatinbased chemotherapy in advanced non-small cell lung cancer patients[J]. Respir Physiol Neurobiol,2013, 187(1): 64-7. |
| [21] | Azu OO, Duru FIO, Osinubi AA, et al. Histomorphometric effects of Kigelia africana (Bignoniaceae) fruit extract on the testis following short-term treatment with cisplatin in male Sprague- Dawley rats[J]. Middle East Fertil Soc J, 2010,15(3): 200-8. |
| [22] | Mohamed HE, El-Swefy SE, Mohamed RH, et al. Effect of erythropoietin therapy on the progression of cisplatin induced renal injury in rats[J]. Exp Toxicol Pathol, 2013,65(1-2): 197-203. |
| [23] | Rezvanfar MA, Rezvanfar MA, Shahverdi AR, et al. Protection of cisplatin-induced spermatotoxicity, DNA damage and chromatin abnormality by selenium nano-particles[J]. Toxicol Appl Pharmacol, 2013, 266(3): 356-65. |
| [24] | Gopal KV, Wu C, Shrestha B, et al. d-Methionine protects against cisplatin-induced neurotoxicity in cortical networks[J]. Neurotoxicol Teratol, 2012,34(5): 495-504. |
| [25] | Qu J, Li X, Wang J, et al. Inhalation of hydrogen gas attenuates cisplatin-induced ototoxicity via reducing oxidative stress[J]. Int J Pediatr Otorhinolaryngol,2012,76(1): 111-5. |
| [26] | Rjiba-Touati K, Ayed-Boussema I, Skhiri H, et al. Induction of DNA fragmentation, chromosome aberrations and micronuclei by cisplatin in rat bone-marrow cells: protective effect of recombinant human erythropoietin[J]. Mutat Res, 2012,747(2): 202-6. |
| [27] | Nessa MU, Beale P, Chan C, et al. Studies on combination of platinum drugs cisplatin and oxaliplatin with phytochemicals anethole and curcumin in ovarian tumour models[J]. Anticancer Res, 2012, 32(11):4843-50. |
 2014, Vol.41
2014, Vol.41