流行病学研究发现,长期服用非甾体类抗炎 药(non-steroidal anti-infl ammatory drugs,NSAIDs) 可减少结直肠癌、食管癌、胃癌和胰腺癌等消化 道肿瘤的危险性[1],NSAIDs对胃肠道肿瘤有一定 的化学预防作用。大量实验证据表明,诱导凋亡和 影响细胞生长周期是NSAIDs以环氧合酶或非环氧 合酶介导途径预防肿瘤的主要方式,其中以凋亡 作用最显著。许多研究发现,NSAIDs 抗肿瘤作用 主要通过抑制COX-2表达,抑制前列腺素产物活 性或数量,引起凋亡蛋白和抗凋亡蛋白变化,最终 诱导细胞凋亡增加而实现的,这是COX-2介导的凋 亡途径。近年的研究结合我们的前期实验发现p38丝裂原激活蛋白激酶(p38 mitogen act ivated protein kinase,p38MAPK) 信号通路的下游底物环氧合 酶-2( cycloox ygenase-2,COX-2)具有调节表达的作 用[2]。在此基础之上,我们推测p38MAPK 可能通过 COX-2 在上游参与抑制肿瘤细胞的生长。为了进 一步探讨戊地昔布诱导结肠癌细胞凋亡的可能机 制,本研究在以往研究的基础上探讨其机制,为戊地 昔布应用于结肠癌的治疗提供实验性理论依据。 1 资料与方法 1.1 材料
人HT-29细胞购自上海中科院细胞中心。 DMEM/F12培养液为Gibco公司产品。兔抗cleaved caspase-3、p38 MAPK、p-p38 MAPK为美国Cell signaling公司产品。小鼠抗Bax单克隆抗体,兔抗 Bcl-2、caspase-3多克隆抗体以及ECL增强化学发 光试剂盒为美国Santa Cruz公司产品。Valdecoxib 由上海辉瑞生物科技有限公司合成,纯度99% ,用 0.5%羧甲基纤维素钠溶解。辣根酶标记羊抗小鼠或兔IgG购自北京中杉金桥公司。 1.2 方法 1.2.1 细胞培养和分组刺激实验
以含体积分数 0.1胎牛血清,2 mmol/L L-谷氨酰胺,100 u/ml青 霉素和100 μg/ml链霉素的DMEM-F12(3:1)培养 液常规培养细胞。待HT-29达75%~85%融合后,用 无血清培养液同步24 h。同步后的细胞分成3组: 正常组(C)、药物处理组(V)及溶剂对照组 (S)。刺激48 h后收集细胞观察。 1.2.2 流式细胞术(FCM)检测细胞凋亡
采用 Annexin V-PI双染法检测Valdecoxib干预48 h后 HT-29细胞凋亡变化。收集上清液及贴壁细胞,用 PBS洗2 次,以1 ml结合缓冲液重新悬浮细胞,使其 浓度为1×106 、100 μl的细胞悬液加入5 ml流式管 中,每管加入5 μl Annexin V-FITC和10 μl 20 μg/ml的 碘化丙啶避光15 min,流式细胞仪观察。 1.2.3 Western blot检测
细胞用冰冷PBS洗2遍, 加入细胞裂解液(25 mmol/L Tris-HCL,10 mmol/L EDTA,体积分数0.01 NP-40,150 mmol/L氯化钠,质 量浓度1 g/L苯甲基磺酰氟),冰浴2 h,4℃、12 000 r/min离心20 min,Lowry法测定上清液蛋白浓度。 细胞裂解蛋白40 μg,经十二烷基硫酸钠-聚丙烯酰 胺(SDS-PAGE)凝胶电泳后电转移至PVDF膜; 质量分数0.05的脱脂奶粉封闭PVDF膜2 h,分别 加入caspase-3、cleaved caspase-3、p38 MAPK、 p-p38 MAPK、Bax、Bcl-2抗体,4℃过夜,洗膜 后加辣根过氧化物酶标记的羊抗小鼠或兔抗体, 37℃孵育2 h;洗膜后加ECL试剂,ODYSSEY远 红外双色荧光成像系统显影(USA,LI.COR Gene Company)。用美国UVP公司LabWorks 4.5分析系 统软件对Western blot条带进行定量分析。 1.3 统计学方法
实验数据以x±s表示,采用SPSS13.0统计软 件进行统计,组间比较采用单因素方差分析,以 P<0.05为差异有统计学意义。 2 结果 2.1 Valdecoxib对HT-29细胞凋亡的影响
正常组(C)、溶剂对照组(S) 及药物处理组 (V),其HT-29细胞凋亡率分别为(3.6±0.5)、(3.86± 0.4)、(24.4±0.8),与正常组相比,Valdecoxib干预 HT-29细胞凋亡率,差异有统计学意义(P<0.01),见 图 1。此外,溶剂对细胞凋亡无明显影响。
 |
图 1 戊地昔布诱导HT-29细胞凋亡的影响 (n=6) Figure 1 Effects of Valdecoxib on apoptosis of human colon cancer cell line HT-29 (n=6) |
与C组(0.2±0.13)相比,戊地昔布干预能够显 著增加cleaved caspase-3表达(0.69±0.08)和Bax/ Bcl-2比率(0.89±0.07)(P<0.05),见图 2、3。此外, 溶剂组(0.26±0.11)对HT-29细胞cleaved caspase-3 表达和Bax/Bcl-2比率无明显影响(P>0.05)。
 |
图 2 戊地昔布对HT-29细胞cleaved caspase-3、caspase-3 的影响 (n=6) Figure 2 Effects of Valdecoxib on activation of cleaved caspase-3 and caspase-3 in human colon cancer cell line HT-29 (n=6) |
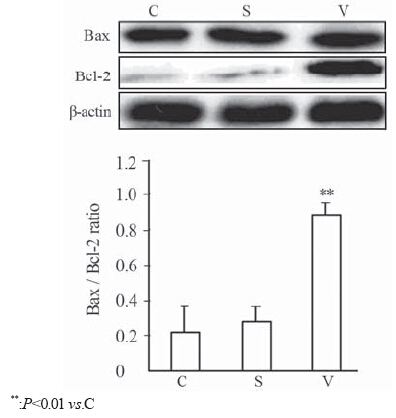 |
图 3 Valdecoxib对HT-29细胞Bax和Bcl-2的影响 (n=6) Figure 3 Effects of Valdecoxib on activation of Bax and Bcl-2 in human colon cancer cell line HT-29 (n=6) |
在干预48 h后,与C组(0.12±0.09)相比,V 组p38 MAPK的磷酸化水平明显升高(0.78±0.03) (P<0.01);与SB组(Valdecoxib干预的同时加入p38 MAPK抑制剂SB30580)(0.26±0.11)相比, Valdecoxib干预组p38 MAPK磷酸化水平明显升高 (0.78±0.03)(P<0.05),见图 4。溶剂组(0.13± 0.05)与正常对照组相比,p38 MAPK磷酸化水平 差异无统计学意义 (P>0.05)。
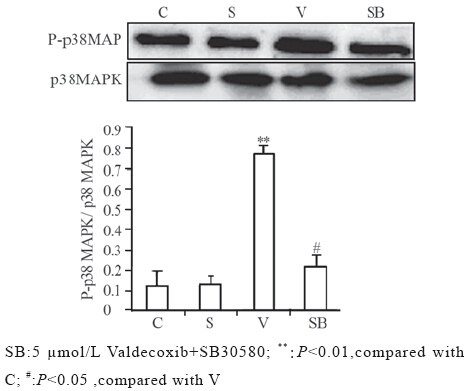 |
图 4 Valdecoxib对HT-29细胞p38 MAPK活化的影响 (n=6) Figure 4 Effects of Valdecoxib on activation of p38 MAPK in human colon cancer cell HT-29 (n=6) |
既往的研究已证实,长期服用NSAIDs的人群 中,结肠癌的发病率明显下降,提示NSAIDs对结 肠癌具有一定的化学预防作用,其中抑制COX-2 被认为是主要途径。因此,调节COX-2有可能成 为有效的治疗结肠癌的靶点[3]。最近研究[4]发现 NSAIDs除了抑制COX以外,还能抑制胃癌MAPKs 信号通路转导所必需的磷酸化蛋白激酶,从而抑制肿瘤细胞增生。研究[5]也认为IL-1β诱导COX-2 表达是由P38和P42/44途径介导的。以上结果表明 尽管COX-2在NSAIDs抗肿瘤作用中至关重要,但 仍存在不涉及COX-2的信号调节途径发挥抑癌作 用。提示NSAIDs促进肿瘤细胞凋亡部分可能存在 与抑制COX-2以外的途径有关。
p38蛋白激酶为丝氨酸/苏氨酸激酶家族成员, 是一个重要的信号分子。研究表明,p38 MAPK信 号通路可能与胃肠道肿瘤有关[6]。前期研究也表 明[2],p38MAPK 在结肠癌细胞凋亡中的作用及与 COX-2 的关系。以上说明,P38 MAPK信号通路 可能与HT-29细胞凋亡密切相关。本研究结果表明, COX-2选择性抑制剂Valdecoxib能够激活p38MAPK 且使其表达增高,采用SB203580阻断p38MAPK通路 能够抑制细胞凋亡、cleaved caspase-3表达和Bax/Bcl-2 比率。以上说明,p38MAPK信号通路可能与HT-29细 胞凋亡密切相关。Liu等[7]研究发现Valdecoxib通过 P38MAPK诱导食管癌Eca109细胞凋亡,同时上调Fas 和 FasL的表达。在人结肠癌细胞HT-29凋亡过程中, P38MAPK激活并抑制survivin的表达[8]。
综上所述,Valdecoxib诱导HT-29细胞凋亡, 这种作用可能部分是通过P38MAPK信号通路的活 化实现的,这为进一步探讨NSAIDs的抗肿瘤作用 机制及指导临床用药提供重要依据。
| [1] | Coogan PF,Rosenberg L,Palmer JR,et al.Nonsteroidal antiinflammatory drugs and risk of digestive cancers at sites other thanahe large bowel[J].Cancer Epidemiol Biomarkers Prev,2000, 9(1):119-23. |
| [2] | Song WQ,Liu Y,Wei JY,et al.Role of p38MAPK in Apoptosis ofaolon Cancer Cells and Its Relationship with COX-2[J].Zhongaiu Fang Zhi Yan Jiu,2007,34(5):359-62. [宋伟庆,刘玉,韦金英,a. p38MAPK 在结肠癌细胞凋亡中的作用及与COX-2 的关系[J].肿瘤防治研究,2007,34(5):359-62.] |
| [3] | Wei JY, Han CL, Song WQ, et al.Expressions of COX-2、hMLH1and hMSH2 in microsatellite instable colorectal cancer[J].Linahuang Yu Shi Yan Bing Li Xue Za Zhi,2006,22(5),571-4.[韦a英,韩彩丽,宋伟庆,等.微卫星不稳定结直肠癌中COX-2、aMLH1、hMSH2的表达[J] . 临床与实验病理学杂志,a006,22(5),571-4.] |
| [4] | Limami Y,Pinon A,Leger DY,et al.The P2Y2/Src/p38/COX-2aathway is involved in the resistance to ursolic acid-inducedapoptosis in colorectal and prostate cancer cells[J].Biochimie,2012,a4(8):1754-63. |
| [5] | Zhu Y, Zhu M, Lance P. IL1β-mediated Stromal COX-2 signalingaediates proliferation and invasiveness of colonic epithelialaancer cells[J]. Exp Cell Res,2012,318(19):2520-30. |
| [6] | Park EJ, Kwon TK.Rottlerin enhances IL-1β-induced COX-2axpression through sustained p38 MAPK activation inaDA-MB-231 human breast cancer cells[J].Exp Molaed,2011,43(12):669-75. |
| [7] | Liu SX, Zhang YJ,Guo HF,et al.The regulatory effect of the p38aignaling pathway on valdecoxib-induced apoptosis of the Eca109aell line[J]. Oncol Rep,2009,22(2):313-9. |
| [8] | Hsu YF,Sheu JR,Lin CH,et al.Trichostatin A and sirtinol suppressedaurvivin expression through AMPK and p38MAPK in HT29 colonaancer cells[J]. Biochim Biophys Acta,2012,1820(2):104-15. |
 2014, Vol.41
2014, Vol.41



