胃癌是消化系统最常见的一种恶性肿瘤。研 究发现胃泌素可通过多种途径促进胃癌的发生发 展[1],其受体拮抗剂能拮抗胃泌素这一作用,其具 体作用机制目前还不完全清楚,是否还有其他因 子与其促癌作用有关尚待实验证明。目前研究发 现三叶因子家族(TFFs)成员分别具有胃肠道黏 膜保护和修复、肿瘤抑制、信号转导、抑制细胞 凋亡等功能[2, 3, 4] 。生理条件下,TFF在胃肠道的表 达呈部位特异性[5],但在病理条件下,这种表达特 异性消失,可在胃肠道所有黏膜损伤部位表达。 近年有研究显示TFF1在胃癌发生过程中表达呈逐 步降低,是一种肿瘤抑制因子[6] 。另据文献报道 TFF3具有同血管内皮生长因子、转化生长因子的促 血管形成作用,被认为可促进肿瘤生长和转移[7]。 那么胃泌素是否可通过TFF1和TFF3途径对胃癌生 长产生影响,目前尚鲜见研究报道。本研究采用 MTT法证实胃泌素及其受体拮抗剂丙谷胺及胃癌 细胞的促增殖作用,再用WB法观察胃泌素及丙谷 胺是否可对胃癌细胞株MKN45中TFF1、TFF3蛋 白表达有调节作用,从而探求胃泌素是否可通过 TFF1、TFF3途径促癌细胞增殖。 1 资料与方法 1.1 材料
人低分化胃腺癌细胞株MKN45由遵义医学 院基础学院微生物学教研室惠赠。17肽胃泌素 购自美国GenScript公司;丙谷胺购自湖北健源 化工有限公司;MTT(四甲基偶氮唑盐)购自 AMERESCO公司;兔抗人单克隆抗体购自Abcam 公司。 1.2 方法 1.2.1 细胞培养
人胃癌细胞株MKN-45用RPMI 1640培养液在37℃、5%CO2条件下常规培养。 1.2.2 MTT法测定细胞增殖
实验时取处于对数 生长期细胞,调整细胞浓度为5×104 cells/ml,每 孔200 μl接种于96孔板中,无血清培养液同步化24 h。实验分4组:17肽胃泌素组:终浓度为1、10、 100、1000 nmol/L;丙谷胺组:终浓度为0.1、1、 10 mmol/L;17肽胃泌素+丙谷胺组:17肽胃泌素 终浓度为100 nmol/L,丙谷胺终浓度为0.1、1、 10 mmol/L;对照组:培养液不加17肽胃泌素或 丙谷胺。每组加6个复孔。孵育48 h后每孔加MTT 20 μl(5 mg/m1),再培养4 h,弃上清液,每孔加 入DMSO150 μl终止反应,恒温振荡器水平振荡10 min。酶联免疫检测仪于490 nm波长处测定每孔 吸光度(OD值),用对照组的OD值调零,实验重复 3次。细胞生长抑制率(IR)=(OD对照组值-OD实验组值) / OD对照组值×100%。若该值为正说明药物对细胞增殖 具有抑制作用,该值为0说明对细胞增殖无影响, 该值为负说明对细胞增殖具有促进作用。 1.2.3 Western blot 检测TFF1和TFF3表达
取17肽 胃泌素和丙谷胺处理48 h后的各组细胞,蛋白定 量后与Buffer以3:1比例混合,超声10 min,20℃ 冻存备用。常规行SDS-PAGE电泳后转印至PVDF 膜,分别将兔抗人TFF1、TFF3抗体作为第一抗 体,HRP标记的羊抗兔IgG为第二抗体。化学发光 显色,将胶片结果扫描。 1.3 统计学方法
采用SPSS 13.0 统计软件进行统计分析,计量 资料用均数±标准差(x±s)表示,组间显著性比较采 用单因素方差分析(ANOVA)。设P<0.05为差异 有统计学意义。 2 结果 2.1 17肽胃泌素对MKN45胃癌细胞增殖的影响
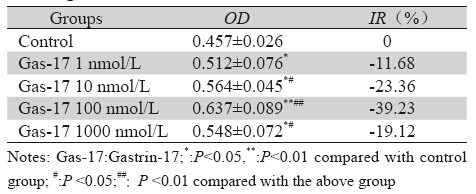
相比对照组,17肽胃泌素在1~1000 nmo1/L 时具有促MKN45细胞增殖作用(P<0.05),且 17肽胃泌素浓度为100 nmo1/L时作用最显著(P <0.01),见表 1。
|
|
表 1 17肽胃泌素对人胃癌细胞MKN45增殖的影响 Table 1 The effects of Gastrin-17 on cell proliferation in human gastric cancer line MKN45 |
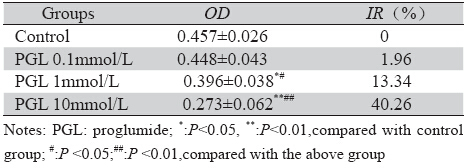
与对照组相比,丙谷胺在 1~10 mmol/L时有显 著的抑制MKN45细胞增殖作用(P<0.05),10 mmo1/L时作用最明显(P<0.01);PGL在0.1mmo1/L时, 无明显抑制作用(P>0.05),见表 2。
|
|
表 2 丙谷胺对人胃癌细胞MKN45增殖的影响 Table 2 The effects of PGL on cell proliferation in human gastric cancer line MKN45 |
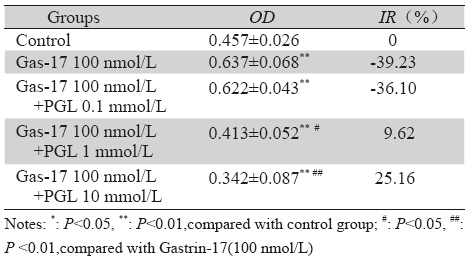
17肽胃泌素促MKN45细胞增殖作用可以被丙 谷胺所阻断,在17肽胃泌素+丙谷胺组中,丙谷胺 (1~10 mmol/L)能明显阻断并抑制17肽胃泌素对 胃癌细胞MKN45的促增殖作用(P <0.05),且 10 nmo1/L时作用最明显(P <0.01),而0.1 mmo1/L 时对17肽胃泌素促进的MKN45细胞增殖无明显抑 制作用(P >0.05),见表 3。
|
|
表 3 17肽胃泌素(100 nmol/L)及其受体拮抗剂丙谷胺对 MKN45细胞增殖的影响 Table 3 The effects of Gastrin-17(100 nmol/L)and its antagonist PGL on cell proliferation in human gastric cancer line MKN45 |
胃癌细胞株MKN45中有TFF1蛋白的表达。17 肽胃泌素在1~100 nmo1/L时可显著减弱MKN45细 胞中TFF1蛋白表达,17肽胃泌素浓度为100 nmo1/L 时作用最明显;其受体拮抗剂丙谷胺能明显促进 TFF1蛋白表达,见图 1。
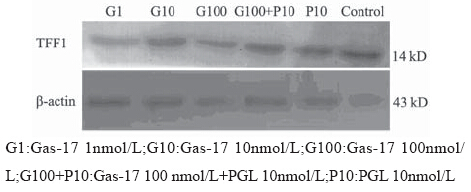 |
图 1 Western blot检测胃泌素对胃癌细胞MKN45中TFF1 蛋白表达的影响 Figure 1 The effects of Gastrin-17 on TFF1 expression in human gastric cancer line MKN45 detected by Western blot |
胃癌细胞株MKN45中有TFF3蛋白的表达。胃 泌素-17在1~100 nmo1/L时可显著增强MKN45细胞 株中TFF3蛋白表达,100 nmo1/L时作用最明显; 丙谷胺可明显抑制TFF3蛋白表达,见图 2。
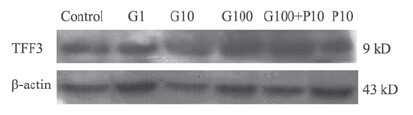 |
图 2 Western blot检测胃泌素对胃癌细胞MKN45中TFF3 蛋白表达的影响 Figure 2 The effects of Gastrin-17 on TFF3 expression in human gastric cancer line MKN45 detected by Western blot |
胃泌素是人们研究最早、最多的胃肠肽类激素,已有大量研究报道胃泌素能够促进胃癌的形 成及发展,本研究通过MTT法先观察外源性17肽 胃泌素对胃癌细胞MKN45增殖的影响。结果表 明,17肽胃泌素在1~1 000 nmol/L时具有明显的促 MKN45细胞增殖作用(P<0.05),联用其受体阻断 剂丙谷胺时该促进作用被阻断。这说明17肽胃泌 素可促进体外培养的胃癌细胞增殖。因此阻断17 肽胃泌素的促癌细胞生长作用,就可能为治疗胃 癌提供新的突破口。胃泌素促癌机制的研究现已 成为国内外热点,但具体作用机制还不明确。国 内外研究显示:胃泌素除本身的促肿瘤增殖作用[8] 外,还可通过COX-2、MMPs及EGF等下游因子参 与胃癌的发生和发展,但是否还有其他因子与其 促癌作用有关尚待实验证明。
三叶因子家族(trefoil factor family,TFFs)主 要是胃肠道黏液细胞分泌的一类具有特定三叶结 构域的小分子多肽。包括TFF1、TFF2及TFF3三 位成员,在正常组织中其主要表达位点分别为胃 基底和胃体(TFF1)、胃窦深部的小凹(TFF2)及杯 状细胞(TFF3)。既往研究主要集中在TFFs胃肠道 黏膜保护和促黏膜愈合作用。最近研究发现在肠 增生性息肉及胃癌、胆道系统肿瘤等均可见TFFs 表达,使TFFs与肿瘤相关的研究日渐增多,成为 癌症研究的新热点之一。有研究发现胃癌发生时 人染色体21q22常有等位基因的缺失[9],此位点正 是TFFs的基因所在位置,其缺失可能影响相关癌 基因及抑癌基因的改变。而这其中对TFF1和TFF3的研究格外引人注意。据国外研究报道[10]在敲除 TFF1基因小鼠模型中,所有小鼠胃上皮细胞均表 现为严重增生、高度发育不良甚至胃窦部腺瘤形 成,部分发展为浸润型胃癌,有力证明了TFF1是 一种肿瘤抑制因子。据文献报道TFF3可通过环氧 合酶(COX)-2、EGF受体(EGFR)相关途径促进新生 血管形成[6, 11],而血管形成又是肿瘤形成的关键, 由此推断TFF3可促进肿瘤的生长、转移。将TFF3 转染至鼠肠癌细胞或成纤维细胞后,其侵袭能力变 强,而阻断TFF3则可抑制肿瘤细胞的生长。并有研 究表明TFF3与胃癌的预后有一定的关系,Im 等[12] 在20例正常胃组织中没有测检到TFF3,而在292例 胃癌组织有44.2%显示出高的表达水平,且TFF3的 高表达与胃癌的淋巴结转移、淋巴管浸润、静脉 浸润显著相关。与之相反,53.8%胃癌组织中TFF1 表达降低。因此他认为,TFF3表达增高可被确定 为一个独立的预后不良的标志。Cobler等[13]研究发 现在胃癌细胞恶化过程中TFF1的表达下调与NF- κB途径的活化有关。以上研究说明,TFF1可能 是特异性肿瘤抑制因子,而TFF3却促进肿瘤细胞 生长和血管形成,并参与了肿瘤转移等过程。因 此,我们有理由认为,胃泌素与TFF1和TFF3及胃 癌之间或许存在着密切的联系。胃泌素是否通过 TFF1和TFF3作为其下游因子参与胃癌的发展,目 前鲜见研究报道。本研究通过Western blot法观察 胃泌素及丙谷胺是否对胃癌细胞MKN45中TFF1和 TFF3蛋白水平具有调节作用,结果显示:浓度为1~1 000 nmol/L的Gas-17可增强MKN45细胞中TFF3蛋 白表达(P<0.05)并减弱 TFF1蛋白表达(P<0.05),且 在100 nmol/L时作用最显著(P<0.01)。丙谷胺阻断 Gas-17促进的TFF3蛋白表达上调和TFF1蛋白表达 下调作用,这一结果与胃泌素促进胃癌细胞增殖 的结论一致,说明TFF1、TFF3是胃泌素促癌作用 的下游目标之一。这与上述国外动物实验报道结 果一致,但胃泌素及丙谷胺对TFF1、TFF3蛋白在 细胞水平表达的研究国内外未见相关报道。由于 TFF1可抑制肿瘤生长,而TFF3却促进肿瘤细胞生 长和转移,因此,胃泌素对TFF1和TFF3的调节作 用具有重要意义。随着对胃泌素促癌作用机制的 深入研究,相信我们对胃癌的发病的认识将更加 清晰,从而为胃肠肿瘤的综合防治开辟新的途径。
| [1] | Szabó I, Rumi G, Bódis B, et al. Gastrin and pentagastrin enhance the tumour proliferation of human stable cultured gastric adenocarcinoma cells[J]. J Physiol Paris, 2000, 94(1):71-4. |
| [2] | Mashimo H, Wu DC, Podolsky DK, et al. Impaired defense of intestinal mucosa in mice lacking intestinal trefoil factor[J].Science,1996,274(5285): 262-5. |
| [3] | Perry JK, Kannan N, Grandison PM, et al. Are trefoil factors oncogenic? [J].Trends Endocrinol Metab,2008,19(2):74-81. |
| [4] | Loncar MB, Al-azzeh ED, Sommer PS, et al. Tumour necrosis factor alpha and nuclear factor kappaB inhibit transcription of human TFF3 encoding a gastrointestinal healing peptide[J].Gut,2003, 52(9):1297-303. |
| [5] | Madsen J, Nielsen O, Tornøe I, et al. Tissue localization of human trefoil factors 1, 2, and 3[J]. Histochem Cytochem,2007,55(5):505-13. |
| [6] | Kirikoshi H, Katoh M. Expression of TFFl, TFF2 and TFF3 in gastric cancer[J]. Int J Oncol,2002,2 1(3):655-9. |
| [7] | Joo YE, Rew JS, Sec YH, et al. Cyclooxygenase-2 overexpression correlates with vascular endothelial growth factor expression and tumor angiogenesis in gastric cancer[J]. J Clin Gastroenterol, 2003, 37(1): 28-33. |
| [8] | Wu HC,Zhao K,Man KW,et al. Effects of gastrin and Proglumide on cell proliferation and epidermal growth factor secretion in gastric cancer cell lines MKN45 in vitro[J]. Shanxi Yi Xue Za Zhi,2008,37(7):800-3. [吴会超,赵逵,文国容,等.胃泌素及丙谷胺 对胃癌细胞株MKN45增殖及EGF表达的影响[J].陕西医学杂 志,2008,37(7):800-3.] |
| [9] | Park WS, Oh RR, Park JY, et al. Mapping of a new target region of allelic loss at 21q22 in primary gastric cancers[J]. Cancer Lett, 2000,159(1): 15-21. |
| [10] | Lefebvre O, Chenard MP, Masson R, et a1. Gastric mucosa abnormalities and tumorigenesis in mice lacking the pS2 trefoil protein[J]. Science,1996, 274(5285):259-62. |
| [11] | Zhang QN, Ma L. Correlation between expression of trefoil factor 3 and angiogenesis in gastric cancer[J]. Xian Dai Zhong Liu Yi Xue, 2005,13(1):42-4.[张秋宁,马力.三叶因子3在胃癌组织中的 表达及与血管形成的关系[J].现代肿瘤医学,2005,13(1):42-4.] |
| [12] | Im S, Yoo C, Jung JH,et a1. Reduced expression of TFF1 and increased expression of TFF3 in gastric cancer: correlation with clinicopathological parameters and prognosis[J]. Int J Med Sci,2013,10(2):133-40. |
| [13] | Cobler L, Mejías-Luque R, Garrido M, et a1. Activation of the NF- κB pathway downregulates TFF-1 in gastric carcinogenesis[J]. Virchows Arch,2013,463(4):497-507. |
 2014, Vol.41
2014, Vol.41