乳腺癌的致癌机制可能是多步骤、多因素、 多基因协同或单独作用于机体不同阶段的复杂过 程,在正常情况下,机体存在多种原癌基因并参 与细胞的生长、增殖、分化以及信号转导,但在 异常情况下,当原癌基因非正常表达或过表达则 会导致相应的细胞增殖分化异常甚至成为克隆性生长的肿瘤细胞。而由原癌基因c-fms编码的集落 刺激因子CSF-1的受体CSF-1R的过度表达对乳腺 癌肿瘤的发生、发展起很重要的作用[1]。
CSF-1是体内重要的细胞因子,在进行造血 细胞体外研究中,它可刺激不同的造血干细胞在 半固体培养液中形成细胞,在体外实验中对骨髓 和脾巨噬细胞系有刺激作用[2]。而集落刺激因子 CSF-1受体是c-fms基因编码的产物,它是一种酪 氨酸激酶受体,当它与其配体CSF-1结合后会激活 受体酪氨酸激酶信号系统,并使酪氨酸激酶的活 性持续升高,从而改变效应器的生物活性,使相 应的细胞持续生长增殖,并且对细胞还发挥长时 效的作用,最后分化发生癌变[3, 4]。
本研究拟通过建立乳腺癌荷瘤鼠动物模型, 探讨CSF-1及其受体对乳腺癌荷瘤鼠肿瘤的作用 及对免疫器官脾和骨髓的影响。实验检测小鼠肿 瘤的体积大小变化,探其相关基因的表达,以及 检测鼠肿瘤、脾脏和骨髓细胞的增殖生长活性, 对鼠的胸腺、脾和淋巴结的细胞进行表型分析鉴 定,从而更加全面地研究探讨CSF-1及受体对乳腺 癌荷瘤鼠肿瘤的生长和机体免疫的作用。 1 材料与方法 1.1 材料
Balb/c小鼠,雌性,250~300 g,由中国人民 解放军军事医学研究院实验动物中心提供;4T1 细胞购自中国医学科学院肿瘤医院;Trizol,DNA marker购自北京普博欣生物科技公司 ;RPMI 1640 培养液购自美国Gibco公司;GAPDH,引物由美 国Invitrogen公司合成;一步法RT-PCR试剂盒购 自美国Bioer公司;MTT试剂购自天津润泰科技有 限公司;CSF-1(rM-CSF)购自美国Peprotech 公 司;CSF-1受体(CSF1R/MCSF Receptor)购自北京 义翘神州生物技术有限公司(Sino Biological Inc.)。 1.2 方法 1.2.1 RT-PCR
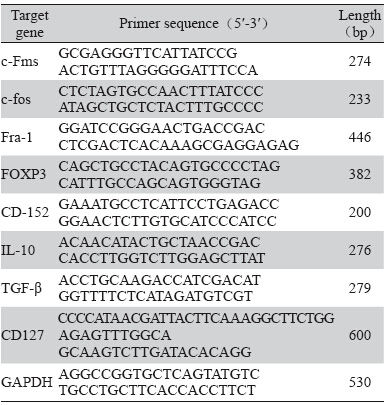
RT-PCR技术是目前用于对提取的目标RNA进 行反转录的方法。本实验设计了如下的引物分别 对小鼠脾细胞进行反转录实验,测定CSF-1作用后 细胞相关目的基因mRNA的表达,见表 1。 反应参数:50℃反转录30 min,94℃预热5 min后,94℃ 30 s,47℃ 30 s,72℃ 3 min,循环 40次,72℃延伸5 min。用Originpro8.5软件处理 数据,以引物因子为横坐标,以所测OD值为纵坐 标,获得相关函数,绘制标准曲线。
|
|
表 1 相关目标基因RT-PCR的引物序列 Table 1 RT-PCR associated primer sequences of target gene |
利用MTT比色法测定免疫器官包括脾细胞 和骨髓细胞,及其肿瘤细胞对刺激物CSF-1的反 应,进而来推断细胞增殖活性功能的变化。用 Originpro8.5软件来处理数据,绘制曲线。 1.2.3 动物实验
在无菌条件下,为对照组(A组)和实验组(B组) 左侧腋下注射1×107浓度的4T1细胞悬液建立荷瘤 鼠模型,于注射后第7天成瘤,并检测小鼠的成瘤 率。在瘤体出现的第4天为实验组小鼠注射CSF-1 及其受体,每天注射rM-CSF 3~4 ml (200 ng/ml); CSF1R/MCSF Receptor 50×104~100×104IU/次连 续2天,对照组小鼠注射相同剂量的0.9%氯化钠溶 液。从成瘤的第1天开始,记录肿瘤长径(L)和短 径(W),每天早中晚各一次取其平均值,用Steel 公式:V=LW2/2计算肿瘤的体积。于成瘤后第8天 断颈法处死小鼠取出肿瘤、骨髓和脾脏,做细胞实 验,将对照组与实验组的三种标本(脾,骨髓,肿 瘤)的新鲜细胞分于两份,第一份以Trizol法提取 总RNA,做RT-PCR和电泳,第二份培养24 h,做 MTT实验。目的在于测定CSF-1及其受体刺激后目 的mRNA的表达变化和各成分细胞活性增殖情况。 1.3 统计学方法
采用SPSS17.0软件进行统计分析,计量数据 以均数±标准差(x±s),多个样本均数多重比较采用 方差分析及SNK-q检验,以双侧检验P<0.05为差 异有统计学意义。 2 结果 2.1 动物实验结果
术后同期放化疗组生存率明显高于单纯放射 在未作用CSF-1及其受体的前三天内,实验组 的肿瘤体积增长速度为0.0357,对照组的增长速度 为0.0374,两者相比差异无统计学意义(P>0.05), 而CSF-1及其受体作用后实验组肿瘤增长速度为 0.0216,对照组的增长速度为0.0091,实验组是 对照组的2.4倍,两组相比差异有统计学意义(P <0.05),见图1。
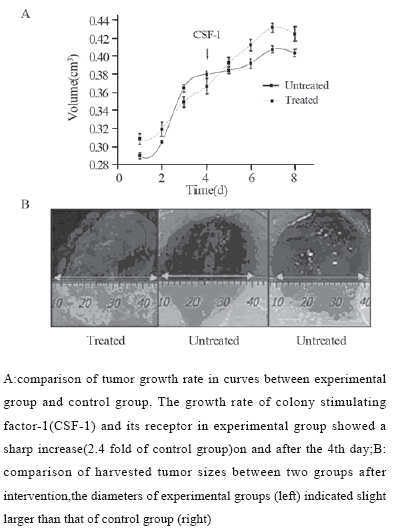 |
图 1CSF-1及其受体对肿瘤体积的影响 Figure 1Effects of CSF-1 and its receptor on tumor volume |
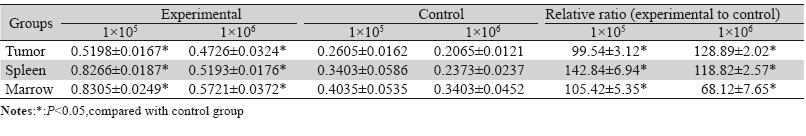
用MTT实验检测CSF-1及其受体作用后荷 瘤鼠肿瘤细胞、脾细胞及骨髓细胞的增殖生长 活性。实验首先在1×106的细胞浓度下进行细胞 培养,为了验证不同浓度的细胞数目是否会对 MTT的结果有影响,我们又用1×105的细胞进行 实验,检测各细胞活性。结果为在1×105浓度下, 实验组肿瘤细胞、脾细胞及骨髓细胞的活性均高 于对照组,由统计学分析得出其相对比分别为 (99.54±3.12)%、(142.84±6.94)%、(105.42 ±5.35)%(P<0.05),其相对值倍数分别为2.0、 2.4、2.1,结果均具有统计学意义。在1×106浓度 下,实验组上述三种细胞活性同样均高于对照 组,由统计学分析得其相对比分别为(128.89± 2.02)%、(118.82±2.57)%、(68.12±7.65)% (P<0.05),其相对值倍数为2.3、2.2、1.7,结果 具有明显的统计学意义。因此MTT实验结果表明 CSF-1及其受体作用后小鼠的肿瘤细胞增殖活跃, 同时脾细胞、骨髓细胞都有增殖活性升高的表 现,见表 2、图 2。
|
|
表 2 小鼠MTT实验细胞活性检测(x±s,%) Table 2 Proliferation of mice tumor and lymphocyte detected by MTT assay(x±s,%) |
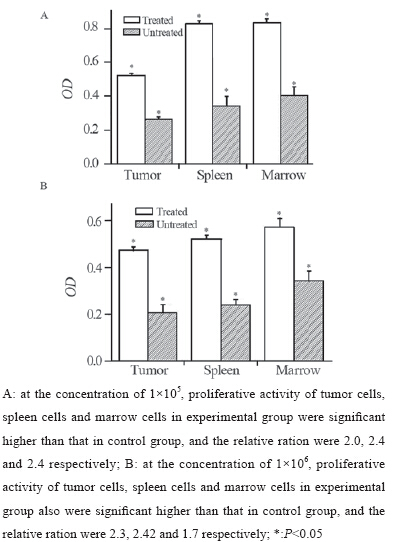 |
图 2MTT实验检测细胞增殖活性的结果 Figure 2Cell proliferation activity determined by MTT test |
为了研究CSF-1及其受体对荷瘤鼠肿瘤生长的 影响,我们收集了未治疗荷瘤小鼠的肿瘤细胞提 取其RNA做对照,测定CSF-1及其受体治疗后荷瘤 鼠肿瘤细胞的c-fms、Fra-1及c-Fos等分子的mRNA 表达情况。由RT-PCR电泳结果可见在实验组中 c-fms、Fra-1、c-Fos的mRNA表达量都不同程度地 高于相应对照组。从电泳结果可看出,与对照组相 比实验组小鼠肿瘤细胞中与CSF-1相关的癌基因表 达水平均有不同程度的变化。c-fms、Fra-1及c-Fos 的表达量有所增加,促进了肿瘤增长,见图 3。
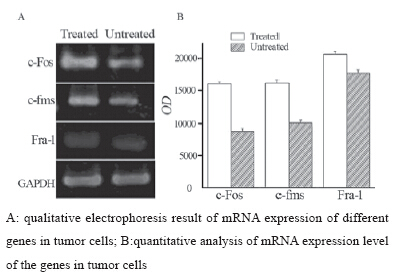 |
图 3RT-PCR检测肿瘤细胞内不同基因的mRNA表达结果 分析 (灰度值,x±s) Figure 3Comparison of mRNA expression in tumor cells between two groups detected by RT-PCR (gray value,x±s) |
为了进一步从数量及功能变化方面了解相关 免疫细胞在荷瘤前后表达的变化,我们采用半定 量RT-PCR技术检测了一些关于免疫抑制相关分 子的mRNA在荷瘤小鼠胸腺、脾脏及淋巴结中的 表达情况,从而推断出相关免疫细胞分泌免疫抑 制性细胞因子的能力。检测的目的分子包括核内 的转录因子Foxp3、表面分子CD152、CD127及分 泌产物TGF-β、IL-10等。从电泳结果可看出,无 论在胸腺、脾脏或淋巴结中,肿瘤组小鼠体内目 的基因表达水平均有不同程度的变化。具体表现 为与对照组相比,实验组CD127表达量下降,而 Foxp3、CD152、TGF-β、IL-10的表达量有所增 加,这表明荷瘤小鼠体内抑制活性的免疫细胞数 量增加,可以推测,在荷瘤小鼠体内,免疫细胞 表现抑制能力增强,CSF-1及其受体治疗后荷瘤鼠 的免疫细胞增值活跃,发挥更强大的免疫抑制功 能,促进了肿瘤增长,见图 4。
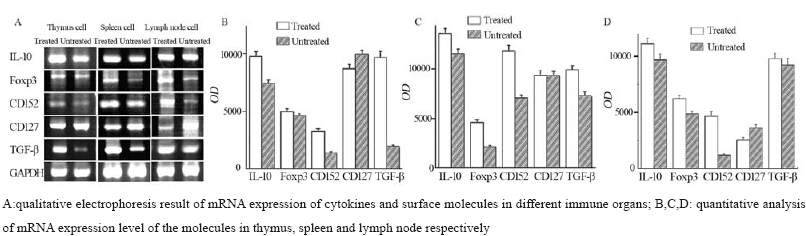 |
图 4RT-PCR检测不同免疫器官中细胞因子及表面分子mRNA表达结果分析(灰度值,x±s) Figure 4Comparison of mRNA expression of cytokines and surface molecules in deferent immune organs between two groups detected by RT-PCR (gray value,x±s) |
CSF-1不仅能选择性刺激巨噬细胞集落形成,诱 导巨噬细胞的增殖分化,而且在许多肿瘤的发生、 发展过程中也扮演重要的角色[5]。通过动物实验检测 CSF-1及其受体对荷瘤鼠肿瘤体积的影响,发现CSF-1 及其受体作用能够加快荷瘤鼠肿瘤的体积增长。
我们便从细胞水平探求原因,发现与正常荷 瘤小鼠相比,实验组荷瘤鼠的肿瘤细胞、脾脏细 胞、骨髓细胞的增殖水平均呈现升高的状态。肿 瘤细胞的增殖活跃是理解范围之内的,由于脾 脏、骨髓部位的淋巴细胞是机体免疫的主要效应 细胞,它的增殖功能在一定程度上反应了机体的 免疫功能状态。因此,促进肿瘤增长结果说明 CSF-1及其受体治疗后荷瘤鼠的整体免疫功能是低 下的。
本实验用RT-PCR分别检测了肿瘤细胞与 CSF-1相关的癌基因表达,结果显示c-fms、 Fra-1、c-Fos的mRNA表达量都不同程度高表达, 这一结果与动物实验结果吻合。RT-PCR的另一 部分结果提示:无论在胸腺、脾脏或是淋巴结 中,肿瘤组小鼠体内的目的基因的表达水平均有 不同程度的变化。其中,CD127表达量下降,而 Foxp3、CD152、TGF-β、IL-10的表达量有所增 加。CD127low低提示抑制性CD4+CD25+调节性T 细胞的分泌产物TGF-β、IL-10的mRNA表达量上 升,而CD4+CD25+调节性T细胞功能的发挥有赖 于这两种细胞因子,同时Foxp3及CD152也影响着 CD4+CD25+调节性T细胞功能的发挥,它们的基因 表达水平上调,表明CD4+CD25+调节性T细胞的功 能增强,导致机体免疫功能低下,免疫系统对肿 瘤免疫应答降低,有利于肿瘤耐受的形成,促进 肿瘤的发生和发展。换言之,CSF-1及其受体治疗 后荷瘤鼠的免疫细胞增殖活跃,发挥更强大的免 疫抑制功能,促进了肿瘤增长。
CSF-1作为炎症介质分子,结合于膜受体, 受体二聚化引发磷酸化,进而激活下游通路,如 Ras、MAPK和PI3K等,使M-CSF效力于肿瘤的侵 袭和生长,在乳腺癌预后不良的病例中也出现了 较高比例的M-CSF和M-CSFR的过表达[6]。总之, 我们确定CSF-1及其受体促进荷瘤鼠的抑制表型 的免疫细胞增殖活跃,发挥更强大的免疫抑制功 能,从而促进了肿瘤增长[7]。
此次试验结果证实CSF-1及其受体会促进乳 腺癌肿瘤的增长,进一步支持了阻断CSF-1/ CSF- 1R(c-fms)则可以抑制肿瘤生长的观点,这也是肿 瘤免疫抑制机制的一部分。通过阻断CSF-1/ CSF- 1R(c-fms)来逆转抑制性免疫细胞诱导的免疫耐 受,为提高抗肿瘤治疗效果开辟了新途径[8]。由此 可以设想用c-fms基因疫苗可以预防并阻止乳腺癌 肿瘤增长,并能够进一步开展针对性肿瘤免疫治 疗的新技术,以原癌基因为肿瘤免疫的靶点构建 基因疫苗,挖掘肿瘤免疫治疗的潜在价值。
| [1] | Stanley ER,Berg KL,Einstein DB,et al.Biology and action of colony--stimulating factor-1[J]. Mol Reprod Dev,1997,46(1):4-10. |
| [2] | Chambers SK,Kacinski BM,Ivins CM,et al.Overexpression of epithelial macrophage colony-stimulating factor (CSF-1) and CSF-1 receptor: a poor prognostic factor in epithelial ovarian cancer, contrasted with a protective effect of stromal CSF-1[J]. Clin Cancer Res,1997,3(6):999-1007. |
| [3] | Yang DH, Liu WW, Gu JR. Expressions of IGF-I,IGF-II receptor and CSF-1 receptor of /c-fms oncogene in hepatocellular carcinomas and adjacent non-tumor tissues[J].Di San Jun Yi Da Xue Xue Bao,1992,14(1):100.[杨冬华,刘为纹,顾健人.IGF-II、 IGF-II受体和CSF-1受体/c-fms癌基因产物在肝癌及癌旁肝组 织的表达[J].第三军医大学学报,1992,14(1):100.] |
| [4] | Pollard JW. Role of colony-stimulating factor-1 in reproduction and development[J]. Mol Reprod Dev, 1997 ,46(1):54-60. |
| [5] | Kacinski BM. CSF-1 and its receptor in breast carcinomas and neoplasms of the female reproductive tract[J]. Mol Reprod Dev, 1997,46(1):71-4. |
| [6] | Qian LF, Wu KF, Geng YQ, et al. Biological effect of monoclonal antibodies against CSF1 & CSF 1R on human hepatic cancer cells transplanted in nude mice[J].Zhong Liu,1997,17(4):207-8. [钱连 芳,吴克复,耿以琪,等.集落刺激因子1及其受体的单抗对人肝癌 细胞在裸鼠体内生长的抑制作用[J].肿瘤,1997,17(4):207-8.] |
| [7] | Cui J,Yang DH.CSF-1 receptor/c-fms and liver cancer[J].Shi Jie Hua Ren Xiao Hua Za Zhi,2000,8(6):696-7.[崔俊,杨冬华. CSF-1 受体/c-fms与肝癌[J].世界华人消化杂志,2000,8(6):696-7.] |
 2014, Vol.41
2014, Vol.41