近年来,随着一些涉及肿瘤浸润、转移及血管 新生特异性靶点的发现,肿瘤靶向治疗的研究成为 肿瘤研究的新热点,肿瘤靶向药物以其高效低毒的 特性,必将成为今后肿瘤化疗药物开发的趋势。短 肽CTT是由Koivunen等[1]于1999年利用噬菌体展示 技术筛选出来的针对MMP-2、MMP-9的特异性阻 断剂。研究表明,MMP-2、MMP-9在多种恶性肿 瘤中呈现高表达,与肿瘤侵袭、转移及肿瘤脉管生 成密切相关[2, 3, 4],是抗肿瘤转移的理想靶点。短肽 CTT不但在肿瘤浸润转移方面有很好的抑瘤效果, 而且也表现出良好的肿瘤靶向性[1, 5, 6],预示着CTT 在抗肿瘤药物开发、靶向带药或肿瘤显像方面有良 好的应用前景。但目前的研究也发现CTT在应用方 面存在一些问题:(1)CTT主要由疏水性氨基酸 构成,因而水溶性较差[7, 8, 9];(2)CTT只有10个氨 基酸,体内稳定性较差,容易被降解[9, 10, 11]。随着对 短肽CTT结构和效能关系研究的逐步深入,对其分 子结构进行适当改造、改善理化性质和药代动力学 性质,增强抗肿瘤效果,以利于其在药物开发方面 的应用,成为短肽CTT应用研究的热点。
RGD三肽序列是目前倍受关注的功能肽片 段,是细胞外基质中各种粘连蛋白共同含有的一 个保守三肽,它可与细胞膜上的整合素相互识 别,从而介导细胞与细胞外基质之间的黏附[12]。 国内外学者发现外源性RGD肽可竞争性封闭肿瘤 细胞的整合素与ECM结合,从而阻断肿瘤细胞与 ECM的黏附及其信号转导通路,进一步抑制肿瘤细 胞的增殖和诱导肿瘤细胞的凋亡[13, 14, 15]。此外,外源 性RGD肽还可下调MMP-2、MMP-9的表达和分泌, 抑制肿瘤细胞对基质蛋白的水解,从而抑制肿瘤的 侵袭和转移[16, 17]。因RGD序列肽具有上述的抗肿瘤 活性,而且其中精氨酸R、天冬氨酸D均为极性氨基 酸,若将其用于CTT的结构改造,对提高CTT的水 溶性和稳定性,增强抗肿瘤功能都有重要的意义。 基于以上背景,本研究对短肽CTT的结构进行 设计改良,在其氨基端接上一段极性氨基酸序列 (RGDSY-),其中引入RGD三肽,得到双靶向抗肿瘤 的CTT衍生肽RGDSY-CTT,希望能提高短肽的水溶 性和稳定性,并获得更强的抗肿瘤效果,为开发更有 效的肽类抗肿瘤靶向治疗药物提供实验理论依据。1 材料与方法 1.1 材料 1.1.1 细胞株
乳腺癌MCF-7细胞株由广州医学 院实验中心提供。 1.1.2 肽段合成
参照文献[1, 5],本研究自行设 计十五肽:RGDSYC*TTHWGFTLC*,由广州杰 特伟公司合成,并同时合成C*TTHWGFTLC*及 STTHWGFTLS作为对照肽,*为二硫键氧化成环 部位,上述多肽均经高压液相色谱仪(HPLC)及 质谱分析确认。 1.1.3 主要试剂
BCA蛋白定量试剂盒购自 凯基生物公司; Ⅳ 型胶原酶 ( 主要成分为 MMP-2、MMP-9)购自美国Gibco公司;酪蛋 白(β-casein)购自美国Sigma 公司;纤连蛋 白(Fn)购自美国CHEMICON公司;Costar Transwell TM培养板(3422)购自美国Corning公 司;MTT购自Sigma公司。 1.2 方法 1.2.1 细胞培养
MCF-7采用RPMI 1640培养液(含 10%胎牛血清)37℃、5%CO2培养箱常规培养,细胞 长至80%~90%,0.25%胰酶消化,按1:3传代。 1.2.2 多肽溶液配置
多肽以PBS配成溶液,过滤 除菌,-20℃保存。 1.2.3 酪蛋白(β-casein)水解抑制实验
实验设7 组,第一组为最大水解组:Ⅳ型胶原酶(80 μg /ml) 及底物β-casein(1.25 μg/ml);第二组为无水解组: 只有底物β-casein(1.25 μg/ml);第三至第七组为 实验组:除胶原酶和β-casein外分别加入250、500 μg/ml RGDSY-CTT; 250、500 μg /ml CTT;500 μg/ml STT。37℃孵育1 h,加入5×蛋白质上样缓冲 液(PH6.8Tris-cl60 mmol/l,甘油25%,SDS 5%, 溴酚篮0.1%)混合后上样于12%聚丙烯酰胺凝胶 (12%分离胶,4%积层胶)每孔20 μl,进行连续SDS-PAGE电泳,积层胶 80V 30 min,分离胶200V 90 min。0.25%考马斯亮蓝染色2 h,脱色过夜。凝 胶电泳结果用Iamgemaster进行拍照,采用Quantity one软件密度扫描分析。重复3次,取平均灰度 值,计算酪蛋白水解抑制率。 1.2.4 短肽溶解度检测
精确称取CTT及RGDSYCTT 各0.25、0.5、1.0、2.0 mg分别溶于0.5 ml蒸馏 水,溶解条件参见我国《药典》凡例2000年版: 置于(25±2)℃环境,每隔5 min摇床振荡30 s,观察 30 min。待其充分溶解后,2 000 r/min离心2 min, 取上清液,BCA法测蛋白浓度。每个蛋白梯度样 品做3个复孔,用酶标仪测定562 nm波长的吸光度 值,取平均值。绘制标准曲线,查得相应蛋白含 量,计算蛋白浓度。 1.2.5 细胞黏附实验
以Fn(10 μg/ml)每孔50 μl 包被96孔板,1%BSA100 μl封闭2 h,接种指数生长 期的MCF-7细胞约5×104细胞/孔。实验设实验组、 空白对照组(细胞+培液)和空白调零组(只加培 液)。实验组CTT、RGDSY-CTT、STT分别设终浓 度为50、100、200 μg/ml共9组,细胞37℃孵育2 h, 弃培养液,PBS洗涤3次。每孔加入20 μl MTT(5 mg/ml),孵育4 h,弃上清液,每孔再加入200 μl DMSO,摇床振荡20 min至MTT结晶溶解,酶标分 析仪490 nm测吸光度值。实验每组重复6次。 1.2.6 细胞迁移实验
以Fn(10 μg/ml)每孔50 μl 涂布Transwell小室滤膜下表面。接种指数生长期 的MCF-7细胞于Transwell小室上室每孔100 μl(约 1×105细胞),下室加入NIH/3T3细胞培养上清 液600 μl。实验设实验组和空白对照组,实验组 CTT、RGDSY-CTT、STT分别设终浓度为100、 200 μg/ml共6组。37℃孵育12 h后,用棉签擦去 滤膜上层未穿膜的肿瘤细胞,滤膜经甲醛固定30 min,伊红染色,200倍显微镜下计数上下左右中5 个视野的穿膜细胞数。实验每组重复5次。 1.3 统计学方法
采用SPSS12.0统计分析软件建立数据库,进 行统计分析。计数资料的统计描述用x±s表示,多 组均数的比较采用单因素方差分析。P<0.01为差 异有统计学意义。 2 结果 2.1 酪蛋白水解抑制实验
灰度值扫描显示RGDSY-CTT、CTT对Ⅳ型胶 原酶的抑制作用明显,浓度为250 μg/ml时RGDSYCTT 和CTT抑制率约为53.6%和77.7%;高浓度500 μg/ml时,两者抑制率相近,分别为94.6%和 96.9%;高浓度500 μg /ml时,STT抑制效率仅有 11.6%,见图 1。
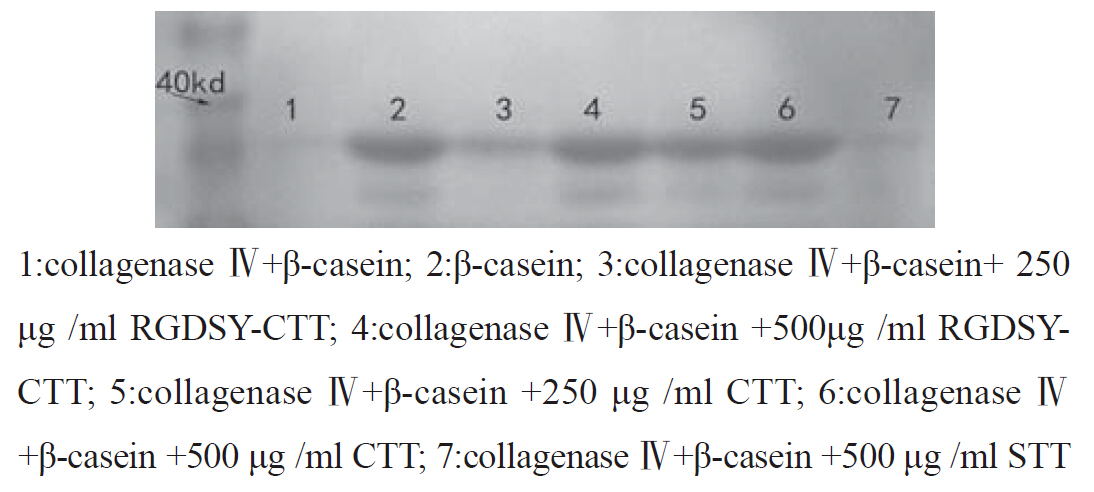 |
图 1 酪蛋白水解抑制实验 Figure 1 β-casein hydrolyzation and inhibition assay |
由BCA法检测结果绘制标准曲线查得相应蛋白 含量见图 2,计算各组样品蛋白浓度得到:CTT的溶 解度约为745 μg/ml,RGDSY-CTT四个检测组均完 全溶解,溶液未饱和,最高检测浓度为4 030 μg/ml。
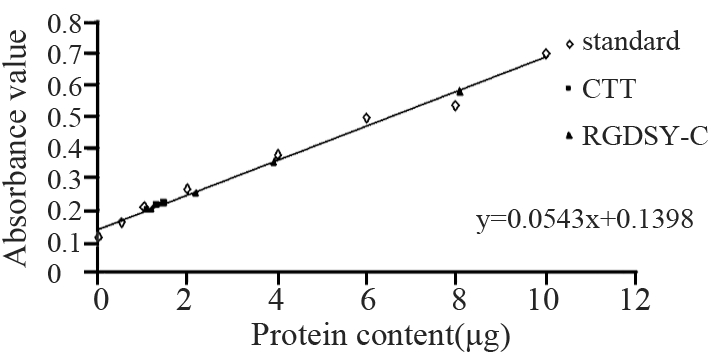 |
图 2 蛋白定量BCA 法检测短肽溶液蛋白含量 Figure 2 Quantity of peptides was detected by BCA |
RGDSY-CTT在终浓度为50、100、200 μg/ml时, MCF-7细胞的黏附率依次为:85.1%、74.1%、 63.8%,随着浓度升高,黏附率降低(P<0.01); RGDSY-CTT在三种浓度对MCF-7细胞黏附能力的 抑制作用均比CTT强(P<0.01);CTT与STT在各浓 度下对MCF-7细胞黏附能力的影响与空白对照相比 差异均无统计学意义(P>0.05),见图 3。
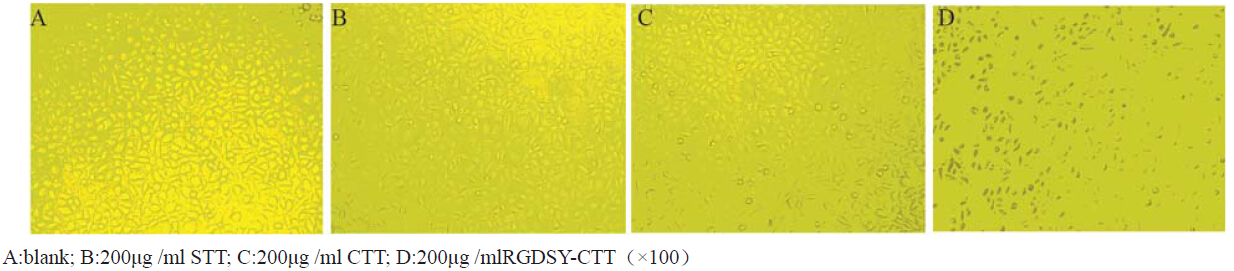 |
图 3 短肽处理2h对MCF-7细胞黏附的影响 Figure 3 Cellular adhesion capability of MCF-7 by peptides after 2h |
RGDSY-CTT在100和200 μg/ml时对MCF-7细 胞的迁移能力抑制率分别为42.9%和60.8%; CTT 在100和200 μg/ml时对MCF-7细胞的迁移能力抑 制率分别为39.2%和57.0%;RGDSY-CTT比CTT对 MCF-7细胞的迁移能力抑制作用更明显(P<0.05), 见图 4。
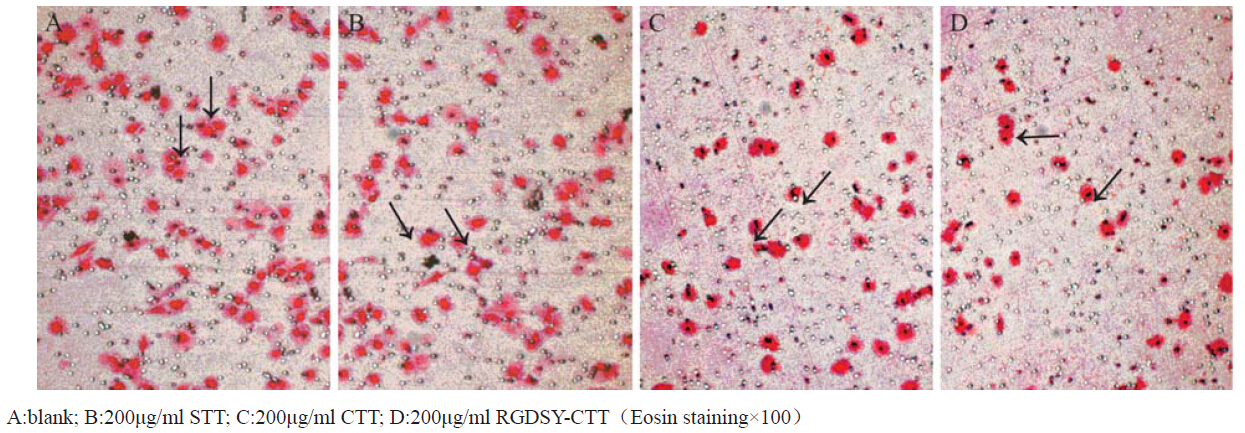 |
图 4 短肽对MCF-7细胞迁移的抑制作用 Figure 4 The inhibition of celler migration capability of MCF-7 by peptides |
环肽CTT能特异性抑制MMP-2和MMP-9, 对其他基质金属蛋白酶家族成员无明显影响[1, 7], 在开发以MMP-2、MMP-9为靶点的抗肿瘤药物方面展现了良好的应用前景。对环肽CTT进行结 构改造或是化学修饰,改善其理化性质,增加 生物利用度以及增强其抗肿瘤功能,是CTT在抗 肿瘤转移应用研究方面的重要内容。本研究从改 善CTT水溶性,增加其稳定性,同时增强其抗肿 瘤能力的目的出发,以环肽CTT为基础,引入含 RGD功能基团的极性氨基酸序列(RGDSY-), 将RGDSY序列中酪氨酸Y的自由羧基与环肽CTT 第一个氨基酸半胱氨酸C的自由氨基以肽键连接而 成,得到新肽RGDSY-CTT。新肽中加入的极性氨 基酸序列(RGDSY-)含有RGD序列肽,能以整合 素αvβ3为靶点阻断肿瘤细胞与基质或基底膜之间黏 附,这将使新肽RGDSY-CTT具有更优的理化特性 以及双靶点抗肿瘤功能。
短肽CTT由10个氨基酸构成,其中两个半胱氨 酸(C)二硫键缩合形成胱氨酸极难溶于水,且色 氨酸、甘氨酸、苯丙氨酸、亮氨酸(W、G、F、 L) 均为侧链疏水氨基酸,具有很强的疏水性。药 物溶解度直接影响药物在体内的吸收与药物生物 利用度,因此CTT的水溶性差在一定程度上限制了 它作为药物的开发和应用。目前常用的改善肽类药 物水溶性的方法有:(1)增加极性亲水氨基酸构 成比例[18, 19];(2)通过高亲水性分子化学修饰等 [20, 21]。本研究中设计的新肽RGDSY-CTT,引入了 极性氨基酸序列(RGDSY-),序列中含有四个极 性氨基酸(R、D、S、Y),增加了极性氨基酸在 肽构成中的比例,据Swiss Institute of Bioinformatics 建立的专业蛋白质分析系统EXPASY评估其亲水性 能比CTT有显著提高。而参照《药典》凡例2000版 检测药物溶解度的条件,将RGDSY-CTT与CTT分 别溶于蒸馏水中,通过蛋白定量BCA法测得CTT的 饱和溶解度约为745 μg /ml,而RGDSY-CTT溶解度 在4 030 μg/ml以上(实验中最高检测浓度至4 030 μg/ml),表明了引入极性氨基酸序列(RGDSY-) 对改善CTT的水溶性有显著效果。
短肽CTT是由10个氨基酸组成的小分子肽, 体内稳定性差,容易降解,这也是小分子活性肽 在应用中普遍会遇到的问题。为克服这一缺点, 目前常采用的改造方式有:(1)在小分子肽中掺 入非天然氨基酸[22, 23];(2)增加肽的长度,一般 认为12肽以上有助增加肽的刚性,减少降解[9]。本 研究设计的新肽RGDSY-CTT为15肽,这将在一定 程度上有助于增加短肽的刚性;当然,肽分子越 大,免疫原性也会越大,因此增加的氨基酸序列 也不宜过长[9]。
新肽RGDSY-CTT的理化特性更优于CTT,有 利于增加其生物利用度,然而这种设计是否会影 响短肽的功能基团,从而影响其活性,是评价本 次改造成败的关键。本研究通过酪蛋白水解抑制 实验检测RGDSY-CTT抑制MMP-2、MMP-9水解 底物酪蛋白的能力,结果显示RGDSY-CTT、CTT 对MMP-2、MMP-9的抑制作用明显,在浓度为250 μg/ml时,RGDSY-CTT抑制率约为53.6%,低 于CTT的抑制率77.7%;而在高浓度500 μg /ml时, 两者抑制率相近,分别为94.6%和96.9 %。低浓 度时RGDSY-CTT抑制效率比CTT低,是由于前者 分子量较大,相同质量浓度所带的抑酶功能基团 较少,这一比率与两者质量摩尔比基本一致。在 高浓度时,两者功能基团与酶作用接近饱和,因 此两者的抑制效率也都接近于完全抑制。由此可 见,新肽RGDSY-CTT所加的极性氨基酸序列并未 影响短肽抑制 MMP-2、MMP-9的活性。
新肽RGDSY-CTT引入了RGD功能序列,从 结构组成上除了具有抑制MMP-2、MMP-9的活 性,还可阻断肿瘤细胞整合素αvβ3对细胞外基质的 黏附,使其具有了针对整合素为靶点的抗肿瘤活 性。本研究把MCF-7细胞种植于涂布Fn的孔板, 与短肽共孵育2 h后,检测其对MCF-7细胞黏附能 力的影响,结果显示随着RGDSY-CTT浓度升高, MCF-7细胞的黏附率明显降低,而CTT各浓度组黏 附率均未见明显下降。这说明新肽RGDSY-CTT具 有抗肿瘤细胞黏附作用,而且这种活性主要来自 于引入的RGD片段,而并非环肽CTT所原有的。 此外,通过细胞迁移试验观察短肽对MCF-7细胞 迁移的影响,结果显示相同浓度下RGDSY-CTT对 MCF-7细胞迁移的抑制能力比CTT更强(P<0.05)。 这一结果表明新肽RGDSY-CTT能通过RGD片段 抑制MCF-7细胞的黏附作用而影响其运动迁移能 力,从而增强其抗肿瘤浸润和转移的效果。
综上所述,本研究设计合成的新肽RGDSYCTT 有更优于CTT的理化特性且具有CTT及RGD两 个功能基团,可作用于不同的抗肿瘤靶点,在开 发靶向抗肿瘤药物或肿瘤显像方面都将具有更好 的应用前景。
| [1] | Koivunen E,Arap W,Valtanen H,et al.Tumor targeting with a selective gelatinase inhibitor[J].Nat Biotechnol,1999,17(8):768-74. |
| [2] | Kang JH,Han IH,Sung MK,et al.Soybean saponin inhibits tumor cell metastasis by modulating expressions of MMP-2, MMP-9 and TIMP-2[J].Cancer Lett,2008,261(1):84-92. |
| [3] | Alford SH,Vrana MS,Waite L,et al.Matrix metalloproteinase expression in high grade soft tissue sarcomas[J].Oncol Rep,2007,18(6):1529-36. |
| [4] | Stahtea XN,Roussidis AE,Kanakis I,et al.Imatinib inhibits colorectal cancer cell growth and suppresses stromal-induced growth stimulation,MT1-MMP expression and pro-MMP2 activation[J].Int J Cancer,2007,121(12):2808-14. |
| [5] | Medina OP,Kairemo K,Valtanen H,et al.Radionuclide imaging of tumor xenografts in mice using a gelatinase-targeting peptide[J]. Anticancer Res,2005,25(1A):33-42. |
| [6] | Zou Y,Chen Y,Jiang Y,et al.Targeting matrix metalloproteinases and endothelial cells with a fusion peptide against tumor[J]. Cancer Res,2007,67(15):7295-300. |
| [7] | Heikkil? P,Suojanen J,Piril? E,et al.Human tongue carcinoma growth is inhibited by selective antigelatinolytic peptides[J]. Int J Cancer,2006,118(9):2202-9. |
| [8] | Medina OP,S?derlund T,Laakkonen LJ,et al.Binding of novel peptide inhibitors of type IV collagenases to phospholipid membranes and use in liposome targeting to tumor cells in vitro[J].Cancer Res,2001,61(10):3978-85. |
| [9] | Liang YJ, Liu KL.Peptide drug research: infinite scene in the perilous peak[N]. Zhongguo Yi Yao Bao,2007-01-18(11). [梁远军,刘克良.肽类药物研究:无限风光在险峰[N].中国医药报, 2007-01-18(11).] |
| [10] | Bj?rklund M,Valtanen H,Savilahti H,et al.Use of intein-directed peptide biosynthesis to improve serum stability and bioactivity of a gelatinase inhibitory peptide[J].Comb Chem High Throughput Screen,2003,6(1):29-35. |
| [11] | Mukai T,Suganuma N,Soejima K,et al.Synthesis of a betatetrapeptide analog as a mother compound for the development of matrix metalloproteinase-2-imaging agents[J].Chem Pharm Bull (Tokyo),2008,56(3):260-5. |
| [12] | Sawyer AA,Hennessy KM,Bellis SL,et al.The effect of adsorbed serum proteins, RGD and proteoglycan-binding peptides on the adhesion of mesenchymal stem cells to hydroxyapatite[J].Biomate rials,2007,28(3):383-92. |
| [13] | Oliva IB,Coelho RM,Barcellos GG,et al.Effect of RGD-disintegrins on melanoma cell growth and metastasis: involvement of the actin cytoskeleton, FAK and c-Fos[J].Toxicon,2007,50(8):1053-63. |
| [14] | Jones S,Martel C,Belzacq-Casagrande AS,et al.Mitoparan and target-selective chimeric analogues: membrane translocation and intracellular redistribution induces mitochondrial apoptosis[J]. Biochim Biophys Acta,2008,1783(5):849-63. |
| [15] | Terentiev AA, Moldogazieva NT.Cell adhesion proteins and alphafetoprotein. Similar structural motifs as prerequisites for common functions[J]. Biochemistry (Mosc),2007,72(9):920-35. |
| [16] | Das S,Banerji A,Frei E,et al.Rapid expression and activation of MMP-2 and MMP-9 upon exposure of human breast cancer cells (MCF-7) to fibronectin in serum free medium[J].Life Sci,2008,82(9-10):467-76. |
| [17] | Baum O,Hlushchuk R,Forster A,et al.Increased invasive potential and up-regulation of MMP-2 in MDA-MB-231 breast cancer cells expressing the beta3 integrin subunit[J].Int J Oncol,2007,30(2):325-32. |
| [18] | Angell Y,Chen D,Brahimi F,et al.A combinatorial method for solution-phase synthesis of labeled bivalent beta-turn mimics[J].J Am Chem Soc,2008,130(2):556-65. |
| [19] | Wang W,Jiang J,Ballard CE,et al.Prodrug approaches to the improved delivery of peptide drugs[J].Curr Pharm Des,1999,5(4):265-87. |
| [20] | Ryan SM,Mantovani G,Wang X,et al.Advances in PEGylation of important biotech molecules:delivery aspects[J].Expert Opin Drug Deliv,2008,5(4):371-83. |
| [21] | Wang LY,Wu KL.Methods of peptide and protein pegylation[J]. You Ji Hua Xue,2003,23(11):1320-3.[王良友,刘克良.多肽和蛋白质的聚乙二醇化修饰方法[J].有机化学,2003,23(11):1320-3.] |
| [22] | Weiss HM,Wirz B,Schweitzer A,et al.ADME investigations of unnatural peptides: distribution of a 14C-labeled beta 3-octaarginine in rats[J].Chem Biodivers,2007,4(7):1413-37. |
| [23] | Sato AK,Viswanathan M,Kent RB,et al.Therapeutic peptides: technological advances driving peptides into development[J].Curr Opin Biotechnol,2006,17(6):638-42. |
 2014, Vol.41
2014, Vol.41


