基础研究发现唑来膦酸对多种肿瘤有直接 或间接的抗肿瘤作用[1, 2, 3],包括抑制肿瘤细胞增殖、诱导凋亡、降低肿瘤细胞的迁移、侵袭能 力,抑制肿瘤新生血管形成等。在鼻咽癌细胞系 HNE-1,已有体外研究证明唑来膦酸可以抑制其 侵袭、迁移能力[4],但对其增殖及凋亡作用未见报 道。本研究通过体外试验,观察唑来膦酸对人鼻 咽癌细胞株HNE-1增殖抑制及凋亡诱导作用并探 索相关机制,为临床治疗提供基础理论依据。 1 材料与方法 1.1 材料 1.1.1 试剂
唑来膦酸(瑞士Novartis公司),Trizol (美国Invitrogen公司),SYBR® Green Ex Taq™ 试剂 盒(日本TaKaRa公司),细胞凋亡检测试剂盒(南京 凯基公司),TUNEL试剂盒(德国罗氏公司),兔抗 人Bcl-2、Bad、Bax、Caspase-9、GAPDH多克隆 抗体(北京博奥森公司)。1.1.2 细胞株
人鼻咽癌细胞株HNE-1由中南大 学肿瘤研究所提供,细胞培养用含15%胎牛血清、 100 u/ml青霉素、100 μg/ml链霉素的DMEM培养 液,于37℃、95%湿度、5%CO2条件下进行培养。1.2 实验方法 1.2.1 MTT法检测
取对数生长期HNE1细胞,按 每孔2×103个细胞种植于96孔板,以不同浓度(0、 2.5、5、10、20、40 μmol/L)唑来膦酸分别作用 24、48、72 h后,每孔加入浓度为5 g/L的MTT 20 μl,继续培养4 h,加入150 μl 二甲基亚砜,待MTT 结晶充分溶解后,应用酶标光度仪测定各孔492 nm 的A值,计算唑来膦酸对细胞的增殖抑制率。增殖 抑制率=(1-A实验组/A对照组)×100%。根据MTT结果 筛选出唑来膦酸的最佳处理剂量组,分为4组,即 对照组、10、20和40 μmol/L处理组。 1.2.2 流式细胞术检测细胞凋亡
药物作用48及72 h,用0.25%胰蛋白酶常规消化,收集1×105个细胞, 500 μl Binding buffer悬浮细胞,加入5 μl Annexin V-FITC混匀后加入5 μl Propidium Iodide,室温避光 5 min,在1 h用内流式细胞仪检测细胞凋亡。 1.2.3 流式细胞术检测细胞周期
药物作用48 h, 常规消化,加入预冷的70%乙醇4 ml悬浮细胞,加 入PI染液400 μl(含0.25 mg/ml RNase A),室温避光 30 min,用流式细胞仪检测细胞周期分布情况。 1.2.4 原位末端标记法(TdT-mediated dUTP nick end labeling ,TUNEL)检测凋亡细胞片段化
收集细胞,固定、脱水、浸蜡制成细胞团石蜡块,4μm 厚连续切片,脱蜡、水化后按TUNEL试剂盒说 明书操作。显微镜下(×400)随机计数上下左右中5 个不同视野的凋亡细胞数及总细胞数,计算凋亡 率。凋亡率=(凋亡细胞数/总细胞数)×100%。 1.2.5 反转录聚合酶链反应(RT-PCR)测定Bcl-2、 Bax、Bad和Caspase-9 mRNA的表达
药物作用48h后,以Trizol液提取细胞总RNA,取1 μg用于反转 录,产物用于反转录PCR扩增。目的基因Bcl-2上 游引物为5'-CTC CCT CTC CCC GCG ACT CC-3' , 下游引物为5'-GGG GGT GTC TTC AAT CAC GCG G-3',Bax上游引物5'-TCCAGGATCGAGCAGGG CGA-3' ,下游引物为5'-AAA AGG GCG ACA ACC CGG CC-3',Bad上游引物为5'- GGG ATG GGG GAG GAG CCCAG-3' ,下游引物:5'- AAG GTC ACT GGG AGG GGG CG-3' ,Caspase-9上游引物为 5'-TCCCAGGGGCTGTCTACGGC-3',下游引物为 5'-TCC AGCTGGTCGAAGGTCCTCA-3',GAPDH 上游引物5'-ACC CAG AAG ACTGTG GATGG-3', 下游引物为5'-TGCTGTAGCCAAATTCGTTG-3'。 在PCR结束后由实时荧光定量PCR仪自动绘制扩增曲 线,各组标本中目的基因mRNA表达量的检测:在反 应结束后PCR仪会自动分析给出每个标本的Ct值,应 用△△Ct法根据公式:相对表达量=2(-△△Ct),其中△△ Ct=△Ct测量样本-△Ct参照样本,△Ct=Ct目的基因-Ct内参基因。 1.2.6 Western blot法测定Bcl-2、Bax、Bad和Caspase-9蛋白的表达
HNE1细胞经不同浓度唑来 膦酸作用48 h后,加入适量裂解液,收集蛋白上清 液,每孔加入20 μg蛋白,变性不连续聚丙烯酰胺 凝胶电泳(SDS-PAGE),转移至PVDF膜上,加 入Bcl-2、Bax、Bad、Caspase-9和GAPDH抗体, 用辣根过氧化物酶标记的二抗检测蛋白表达。于 PVDF膜上滴加化学发光荧光增强剂显影。不做任 何处理的HNE1细胞作为对照组。 1.3 统计学方法
采用 SPSS17.0软件进行分析。用x±s表示,比 较多组样本均数用单因素方差分析,比较均数间相 差的显著性用方差分析中的Student-Newman-Keult Q 检验。P<0.05为差异有统计学意义。 2 结果 2.1 唑来膦酸对HNE-1细胞的增殖抑制作用
与对照组比较,各处理组作用24 h后唑来膦 酸对HNE-1细胞无增殖抑制作用(P>0.05);而作用 48 和72 h均能抑制细胞增殖,差异有统计学意义 (P<0.05);但抑制增殖能力未呈时效和量效关系 (P>0.05),见图 1。
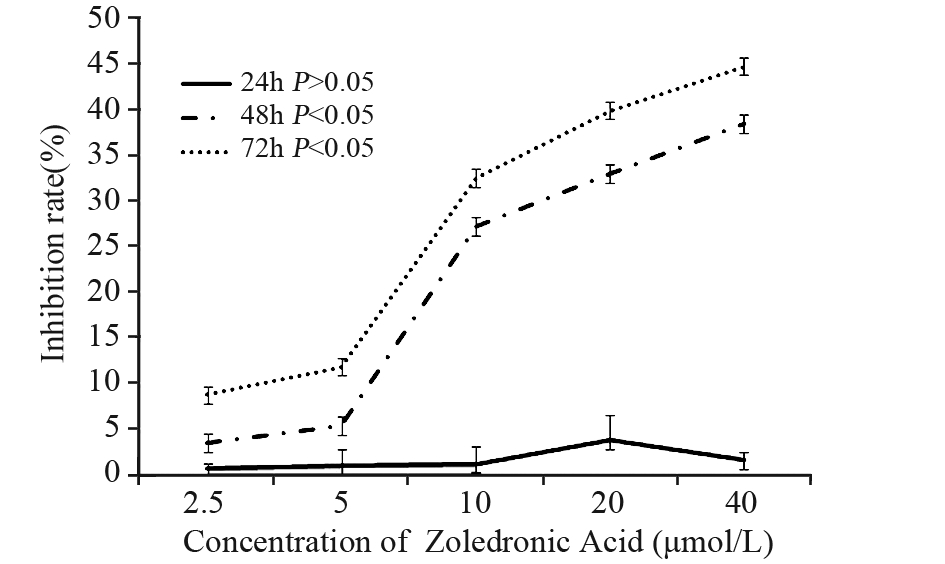 |
图 1 不同浓度唑来膦酸对HNE-1细胞的增殖抑制作用 Figure 1 The anti-proliferative effect of different concentrations of Zoledronic Acid on HNE-1 cells |
唑来膦酸处理HNE-1细胞48 h后,10、20、 40 μmol/L唑来膦酸组的早期凋亡率分别为(13.6 ±2.3)%、(16.2±3.42)%和(17.9±1.64)%, 与对照组凋亡率(4.2±0.1)%比较,差异有统 计学意义(P<0.05);处理72 h后,早期凋亡率分 别为(12.9±3.6)%、(13.6±1.2)%和(27.2± 0.6)%,与对照组凋亡率(3.53±0.44)%比较, 差异有统计学意义(P<0.05)。 2.3 唑来膦酸影响HNE-1细胞周期的分布
不同浓度唑来膦酸作用HNE-1细胞48 h,S 期细胞比例较对照组升高,差异有统计学意义(P <0.01),见图 2。
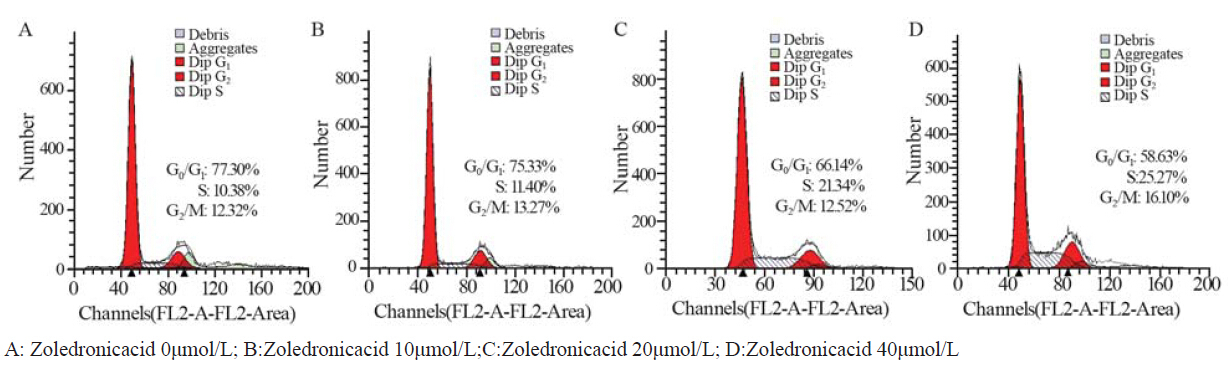 |
图 2 不同浓度唑来膦酸作用HNE-1细胞48h后细胞周期分布情况 Figure 2 Cell cycle distribution of HNE-1 cells treated with various concentrations of Zoledronic Acid for 48h |
经TUNEL法染色后阳性物质呈棕褐色颗粒, 位于细胞核内。凋亡细胞多呈圆形,少数形状不 规则。各个浓度组作用HNE-1细胞48 h后的凋亡细 胞数分别为 (4.25±3.33)%、(4.45±2.56)%、(5.55± 2.87)%和(5.12±3.14)%,与对照组(3.33±4.25)%比 较差异无统计学意义(P>0.05),作用72 h的凋亡指 数分别为(5.00±5.84)%、(11.67±3.33)%、(16.67± 5.29)% 和(26.11±4.92)% ,与对照组(5.00±5.84)% 比较差异有统计学意义(P<0.05),见图 3。
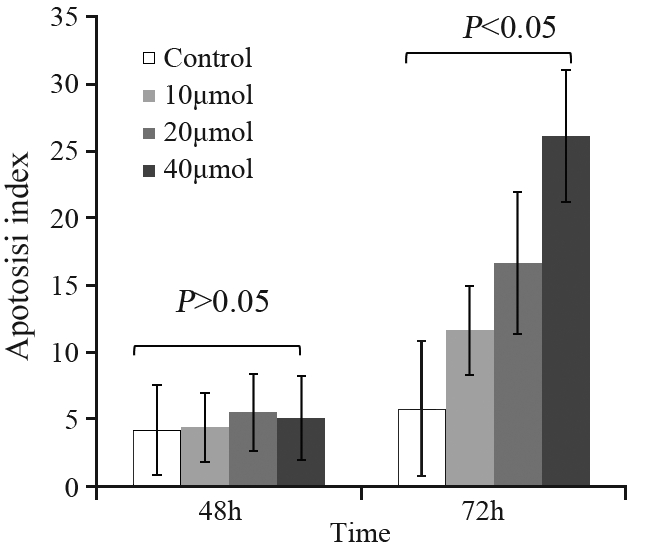 |
图 3 不同浓度唑来膦酸作用HNE-1细胞48及72h后的凋亡率 Figure 3 Apoptotic rates of HNE-1 cells treated with different concentrations of Zoledronic Acid for 48 and 72h |
Real time-PCR和Western blot检测结果显示经唑 来膦酸处理48 h,无论是mRNA还是蛋白水平,Bax、 Bad和Caspase-9三者的表达均有不同程度的上升,而 Bcl-2表达则在高浓度唑来膦酸处理时下降,见图 4、5。
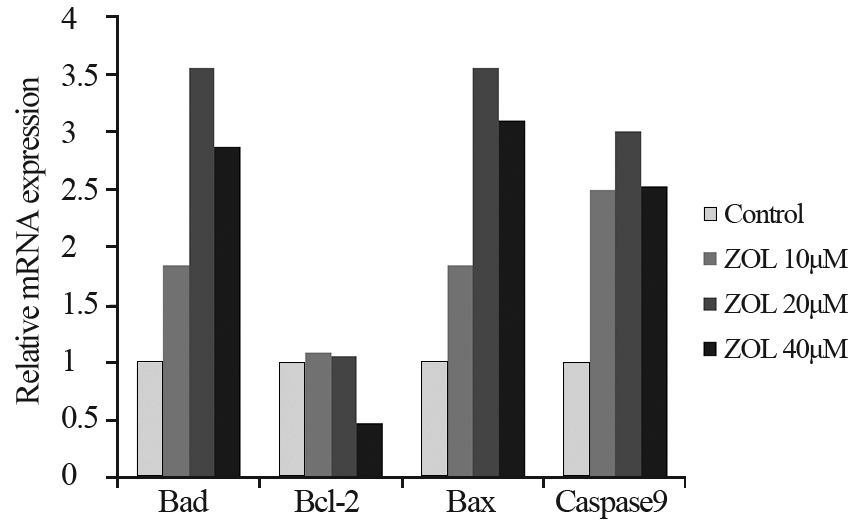 |
图 4 不同浓度唑来膦酸处理后HNE-1细胞Bcl-2、Bax、Bad和Caspase9 mRNA的表达 Figure 4 The mRNA expressions of Bcl-2,Bax,Bad and Caspase9 treated with different concentrations of Zoledronic Acid |
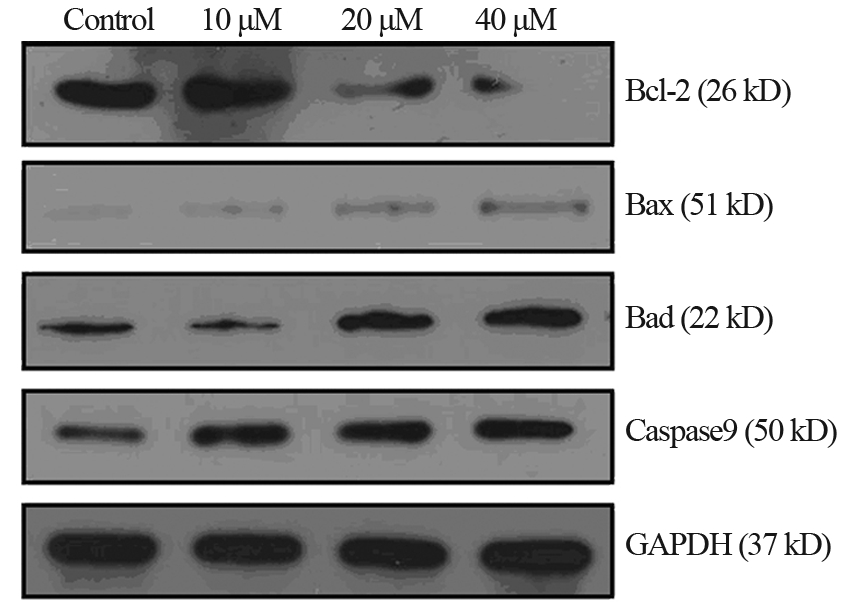 |
图 5 不同浓度唑来膦酸处理后HNE-1细胞Bcl-2、Bax、Bad和Caspase9 蛋白的表达 Figure 5 The protein expressions of Bcl-2,Bax,Bad and Caspase9 treated with different concentrations of Zoledronic Acid |
本体外实验发现唑来膦酸能抑制鼻咽癌HNE-1 细胞的增殖,诱导细胞凋亡;并进一步发现可能与 上调HNE-1细胞Bax、Bad和Caspase9 mRNA和蛋白 的表达,下调Bcl-2 mRNA和蛋白的表达有关。
本研究显示唑来膦酸对HNE-1细胞的抗增殖作 用不存在时间及浓度的依赖性。作用24 h对细胞增 殖无影响;作用48 h和72 h,浓度为10~40μmol/L 的增殖抑制率均接近50%,组间差异无统计学意 义。与文献报道唑来膦酸对乳腺癌细胞的增殖抑 制不存在浓度依赖相一致[5, 6]。但在其他研究中 唑来膦酸对一些肿瘤表现出较强的抗增殖作用 并且呈时效及量效关系[7, 8]。Li等[7]报道唑来膦酸 50 μmol/L对肺癌细胞系BABB/cByJ的增殖抑制率 达80%;Ory等[8]报道唑来膦酸对在骨肉瘤细胞系 MG63、SaOS2、U2OS和MNNG-HOS的增殖抑制 率接近90%。这可能是唑来膦酸对不同细胞系的敏 感度差异所致。
本研究发现唑来膦酸可以诱导HNE-1细胞凋亡, 并影响细胞周期的分布,这与文献报道相符[9, 10]。张卫 东等[9]报道,唑来膦酸在浓度为30 μmol/L时能诱导肺癌95D细胞凋亡,并增加G0/G1期的细胞比例; Iguchi等[10]研究指出,唑来膦酸在(10~100)μmol/L 时能诱导骨肉瘤HOS细胞和MG63细胞凋亡,并明 显增加S期的细胞比例。本研究进一步探讨唑来膦 酸诱导凋亡的可能机制。
细胞凋亡通过两个途径,胞膜死亡受体介导的 外在通路及线粒体介导的内在通路。已有研究报道 唑来膦酸诱导肿瘤细胞的凋亡是通过线粒体途径 [11]。本研究中唑来膦酸处理后,Bcl-2家族抑制凋亡 成员如Bcl-2表达抑制,而促凋亡成员如Bax、Bad的 表达上调,且凋亡执行蛋白Caspase9 的表达上调。 提示唑来膦酸诱导HNE-1细胞凋亡可能也是通过线 粒体介导的内在通路,此结果为唑来膦酸抗鼻咽癌作用的体内抑瘤研究、抗癌机制的进一步阐明, 以及临床治疗提供一定的理论依据。但更具体的 机制,如细胞色素C的释放、线粒体膜电位的改变这 些更经典的表现等均需要进一步研究证实。
| [1] | Okamoto S, Kawamura K, Li Q, et al. Zoledronic acid produces antitumor effects on mesothelioma through apoptosis and S-phase arrest in p53-independent and Ras prenylation-independent manners[J].J Thorac Oncol,2012,7(5):873-82. |
| [2] | Ibrahim T, Mercatali L, Sacanna E, et al. Inhibition of breast cancer cell proliferation in repeated and non-repeated treatment with zoledronic acid[J].Cancer Cell Int,2012,12(1):48. |
| [3] | Koto K, Murata H, Kimura S, et al. Zoledronic acid significantly enhances radiation-induced apoptosis against human fibrosarcoma cells by inhibiting radioadaptive signaling[J]. Int J Oncol,2013,42(2):525-34. |
| [4] | Li XY, Lin YC, Huang WL, et al. Zoledronic acid inhibits proliferation and impairs migration and invasion through downregulating VEGF and MMPs expression in human nasopharyngeal carcinoma cells[J]. Med Oncol,2012,29(2):714-20. |
| [5] | Neville-Webbe HL, Coleman RE, Holen I. Combined effects of the bisphosphonate, zoledronic acid and the aromatase inhibitor letrozole on breast cancer cells in vitro:evidence of synergistic interaction[J]. Br J Cancer,2010, 102(6):1010-7. |
| [6] | Rachner TD, Singh SK, Schoppet M, et al. Zoledronic acid induces apoptosis and changes the TRAIL/OPG ratio in breast cancer cells[J]. Cancer Lett,2010,287(1):109-16. |
| [7] | Li YY, Chang JW, Chou WC, et al. Zoledronic acid is unable to induce apoptosis, but slows tumor growth and prolongs survival for non-small-cell lung cancers[J]. Lung Cancer,2008,59(2):180-91. |
| [8] | Ory B, Blanchard F, Battaglia S, et al. Zoledronic acid activates the DNA S-phase checkpoint and induces osteosarcoma cell death characterized by apoptosis-inducing factor and endonuclease-G translocation independently of p53 and retinoblastoma status[J]. Mol Pharmacol,2007,71(1):333-43. |
| [9] | Zhang WD, Han YP, Zong ZH, et al. Zoledronic acid blocks cell cycle and induces apoptosis in lung cancer cell line 95D cells and their mechanisms of action[J]. Zhonghua Zhong Liu Za Zhi,2009,31(6):418-22. [张卫东,韩轶鹏,宗志红,等.唑来膦酸对 肺癌95D细胞周期阻滞和诱导凋亡的作用机制[J].中华肿瘤杂 志,2009,31(6):418-22.]. |
| [10] | Iguchi T, Miyakawa Y, Saito K, et al. Zoledronate-induced S phase arrest and apoptosis accompanied by DNA damage and activation of the ATM/Chk1/cdc25 pathway in human osteosarcoma cells[J]. Int J Oncol,2007,31(2):285-91. |
| [11] | Mitrofan LM, Castells FB, Pelkonen J, et al. Lysosomalmitochondrial axis in zoledronic acid-induced apoptosis in human follicular lymphoma cells[J]. J Biol Chem,2010,285(3):1967-79. |
 2014, Vol.41
2014, Vol.41


