2.牡丹江医学院基础医学院病理学教研室
2.Department of Pathology, Basic Medical College, Mudanjiang Medical University
EB病毒(Epstein-Barr virus,EBV)是一种广泛 存在的疱疹病毒,主要以B淋巴细胞为靶细胞, 导致靶细胞异常增殖引起疾病。有研究表明EBV与各种淋巴和上皮组织恶性肿瘤如伯基特氏淋巴 瘤、鼻咽癌、免疫缺陷病导致的淋巴增生性疾病 和胃癌等密切相关[1, 2, 3]。EB病毒感染人体后将长期 潜伏在B细胞中,多数感染者终身潜伏感染。在体 外早期感染EBV后末梢血B细胞可获得在组织培养 中维持长期生长和增生的能力,称为永生化增殖 细胞(lymphoblastoid cell line,LCL)[4]。但对 于 感染EBV后末梢血B细胞是否还存在静息B细胞的 形式,目前尚存在争议。
现在国内外关于EB病毒及相关基因与各种疾 病关系的研究较多,但是体内环境下研究EB病毒的感染、增殖、潜伏、激活及致病的机制较少。 体内储存EB病毒的静息B细胞的模型制备,目前 尚未见报道。本实验在前期成功建立套细胞淋 巴瘤模型研究基础上[5],采用EB病毒感染末梢血 CD5+B细胞建立体内储存EB病毒的静息B细胞模 型,观察EBV阳性的CD+B/EBV病毒潜伏基因、免 疫表型及增殖活性的表达,为预防和治疗EB病毒 相关疾病提供研究基础。1 材料与方法 1.1 材料
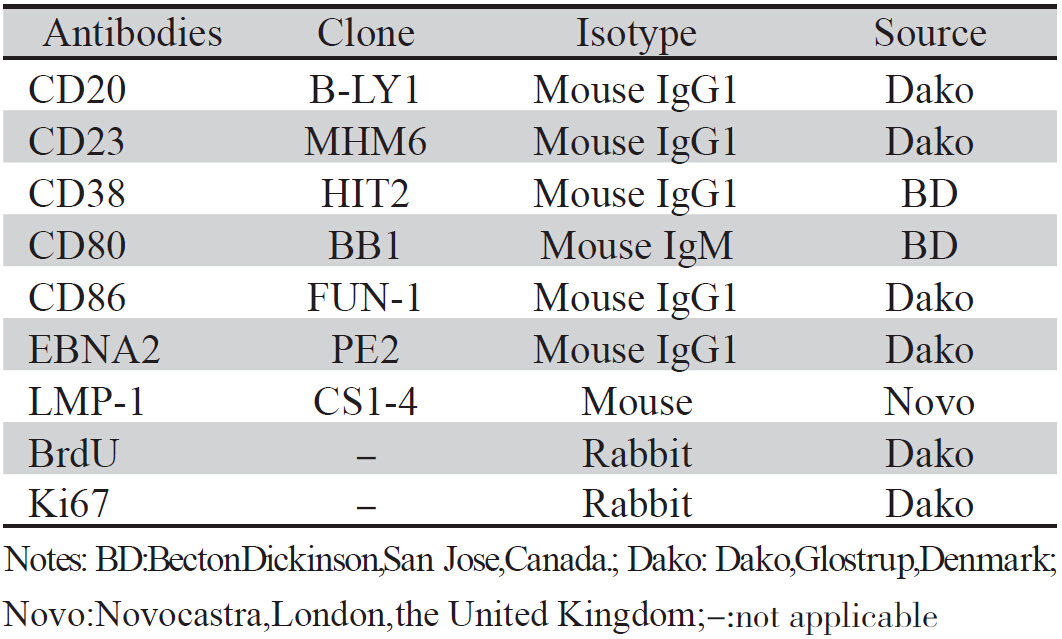
EB 病毒B958细胞株由日本冈山大学提供,人 CD5mAb及鼠IgG免疫磁珠购于法国Immunotech公 司;免疫荧光染色试剂盒购于美国Sigma公司;各 种抗体分别购买于加拿大Becton Dickinson,丹麦 Dako,英国Novocastra公司,见表 1。
|
|
表 1 本研究使用的抗体 Table 1 The antibodies applied in the study |
常规 方法脐带血B细胞的分离,取上述所得B细胞1 ml, 加入2 mgCD5mAb,加入1 mg鼠IgG免疫磁珠,室温 孵育10 min,与磁珠作用10 min,清洗收集吸附的 CD5+ B细胞。1.2.2 EBV的感染
参照前期研究方法[5]将NeoR EBV感染的Akata细胞(Akata EBV)上清液作为 EBV使用,Akata EBV感染已分离CD5+B细胞用 G418筛选,转染后BrdU标记,将细胞分为CD5+B 对照组和CD5+B/EBV组。1.2.3 Western blot检测
各组细胞提取蛋白后采 用BCA定量试剂盒测定蛋白浓度。SDS-PAGE凝 胶电泳分离蛋白后转至硝酸纤维素膜;加入一抗 (EBNA2和LMP-1),4℃孵育过夜,二抗孵育2 h, TBS洗净后经显色液显示15 min,扫描后图像分析 软件对印迹区进行IOD分析。1.2.4 流式细胞仪分析 检测
各组细胞制备单细 胞悬液,细胞计数,锥虫蓝染色。在试管中加入 一抗(CD20、CD23、CD38、CD80、CD86)孵育 1 h,PBS洗涤,加入二抗孵育30 min,PBS洗涤, 离心3 min,弃上清液,加300 μl PBS,上机检测。1.2.5 免疫荧光染色检测
CD5+B/EBV组加入 BrdU培养4 d,参照说明书行EBNA2和BrdU双重染 色,按参照文献[6]对CD5+B/EBV细胞加 Sac、IL-2 和Thiored因子激活18 h后,行BrdU和Ki67及EBNA2 和Ki67抗体双重染色。1.3 统计学方法
所得数据以采用SPSS 13.0软件进行统计学分 析,数据以均值±标准差(x±s)表示,组间比较 采用t检验,P<0.05为差异有统计学意义。 2 结果 2.1 CD5+B/EBV细胞病毒免疫表型检测
CD5+B在EBV病毒感染后,流式细胞仪检测发 现CD5+B/EBV诱导CD20、CD80、CD38和CD86表 达增强,但CD23没有表达,见图 1。
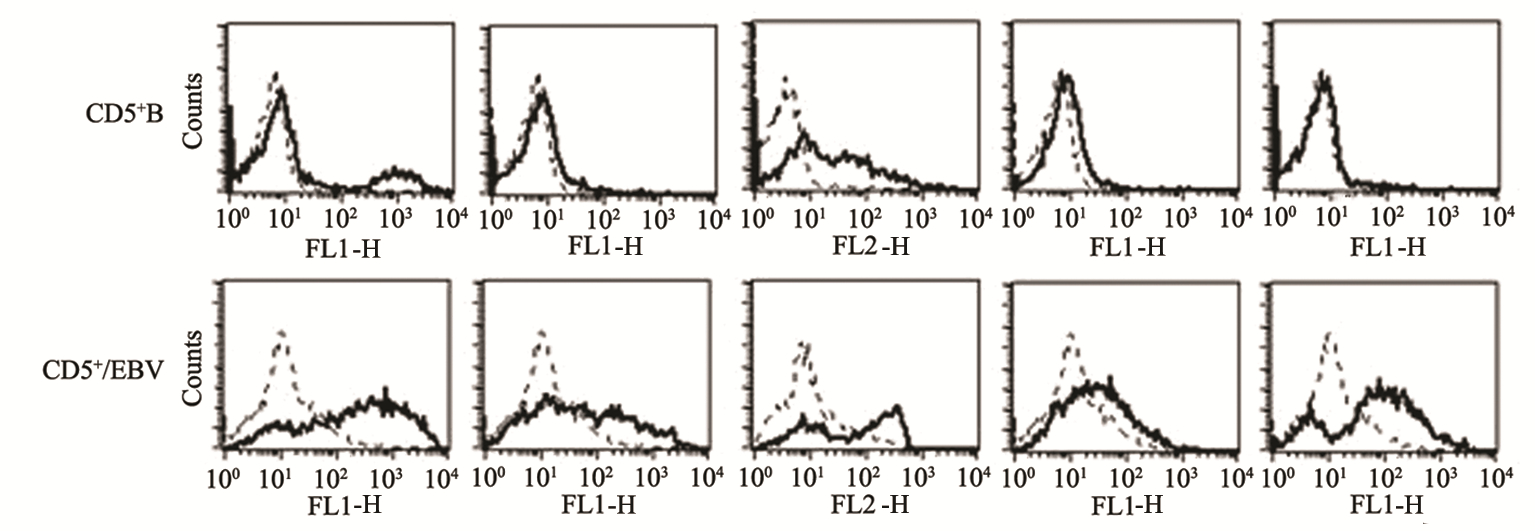 |
图 1 流式细胞仪检测各组细胞免疫表型 CD20、CD23、CD80、CD38和CD86表达 Figure 1 Cell immune phenotypes of CD20,CD23,CD80,CD38 and CD86 in all groups detected by fl ow cytometry |
用Akada EBV感染CD5+B后,经过G418 筛选, Western blot结果与CD5+B细胞比较,CD5+B/EBV 细胞中LMP1和EBNA2蛋白相对表达显著增高 (P=0.002,P=0.000),见图 2。
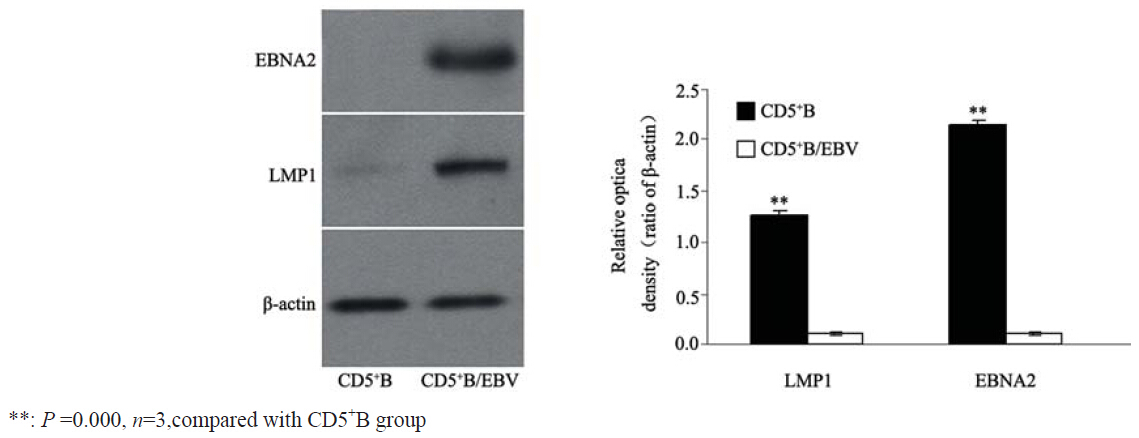 |
图 2 Western blot检测各组LMP1和EBNA2 蛋白的相对表达 Figure 2 LMP1 and EBNA2 protein expression detected by Western blot in all groups |
CD5+B/EBV加入BrdU培养了4 d。可见EBNA2阳性的细胞中含有BrdU阴性细胞,见图 3。加 Sac、IL-2、Thiored因子激活18 h,观察到Brdu阴 性细胞中有Ki67阳性细胞存在。而在EBNA2阳性 细胞中观察到Ki67阴性细胞,见图 4。
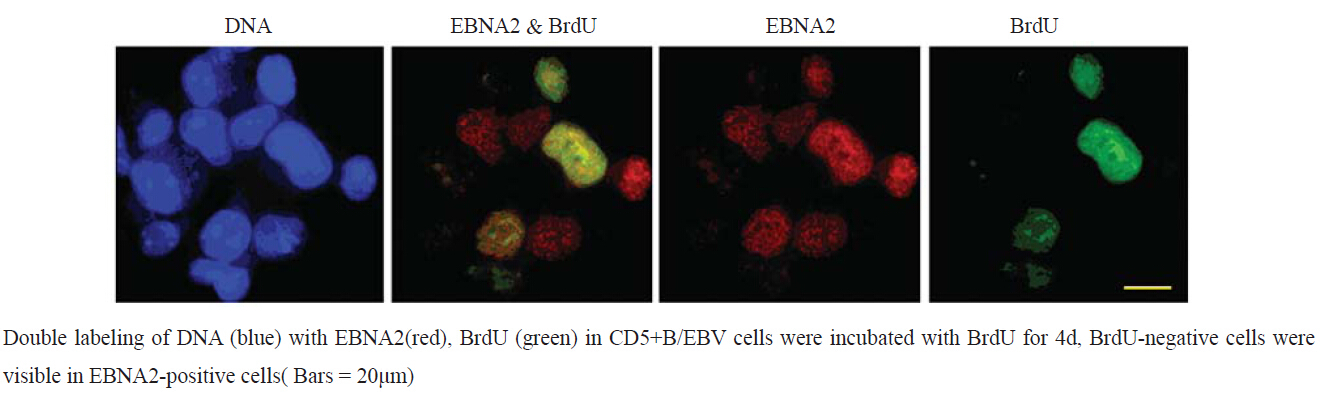 |
图 3 免疫荧光染色观察BrdU标记4天后的 CD5+B/EBV细胞情况 Figure 3 CD5+B/EBV cell labeled by BrdU for 4 days detected by immunofl uorescent staining |
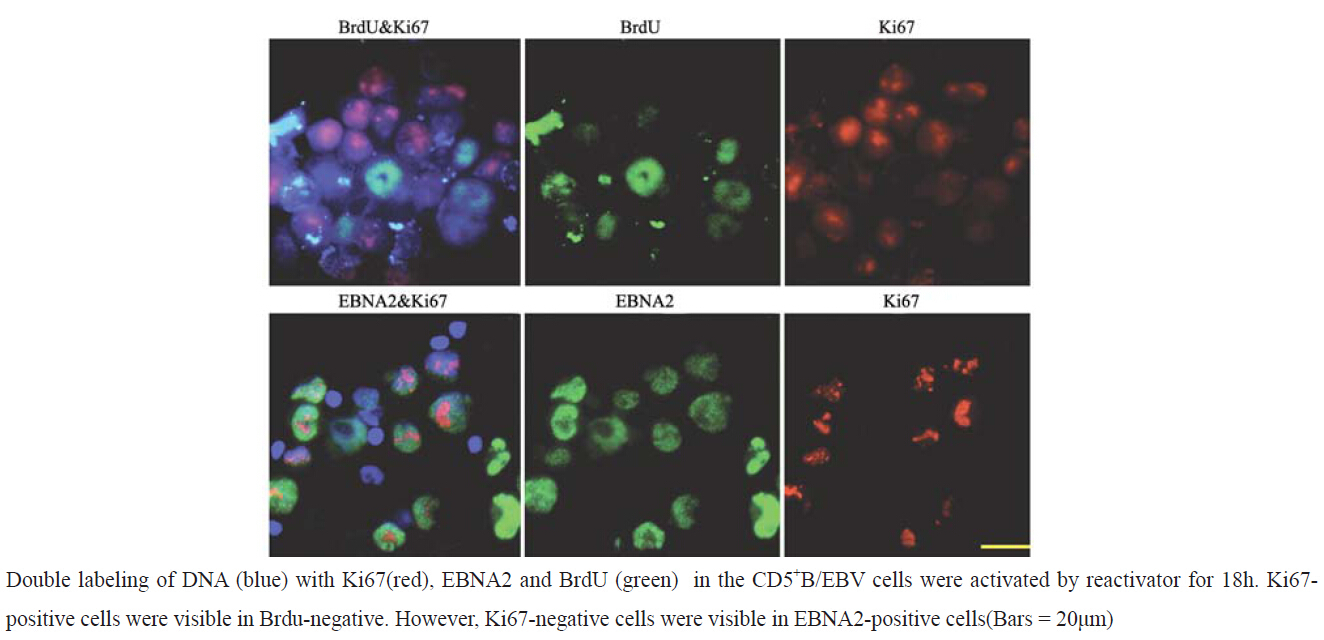 |
图 4 免疫荧光染色观察经激活因子激活18 小时后的CD5+B/EBV细胞情况 Figure 4 CD5+B/EBV cell activated by reactivator for 18h detected by immunofl uorescent staining |
EB病毒为一种嗜人类B淋巴细胞的γ疱疹病 毒,与宿主细胞关系的特点是潜伏感染。EBV 感 染的主要靶向是人类B淋巴细胞,但病毒还可以感染其他淋巴细胞和上皮细胞[2]。EB病毒感染人体 后,多数终身潜伏感染。所以,研究EB病毒相关 疾病的发病机制及各种因子的影响,首先要研究 储存EB病毒的静息B细胞及EB病毒相关基因在“感 染-潜伏-激活-致病”等一系列步骤上的作用机制。 EB病毒与宿主细胞关系的特点是潜伏感染。
在体外末梢血B细胞被EBV感染后永生化,表现 EBNAs、EBNA2、LMP-1等潜伏基因变为永生化 增殖细胞株(LCL)[3]。在EBV健康携带者上EBV 储藏细胞为静息期B细胞,就连免疫缺陷宿主也是 储藏EBV的细胞为静息期B细胞[7]。因此我们认为 在体外早期感染EBV后末梢血B细胞表现除了永生 化增殖细胞外,还存在成为静息期细胞的形式。 为证实此细胞的存在,我们利用新霉素耐性的重 组遗传基因EBV (NeoR EBV)对CD5+B进行感染, 加入BrdU培养了4天。然后对此细胞用EBNA2和 BrdU双重染色进行观察。可见,EBNA2阳性的细 胞中包含有BrdU阴性细胞。因BrdU和Ki67常用 于细胞增殖的标记,也就是说,虽有EB病毒的感 染,也有不能增殖的B细胞存在。我们对此细胞 加Sac、IL-2、Thiored等因子激活18 h,用BrdU 和Ki67双重染色,观察到Brdu阴性细胞中,有 Ki67阳性细胞存在。另外用EBNA2和Ki67抗体双 重染色,在EBNA2阳性细胞中,观察到Ki67阴性 细胞。这说明,感染EB病毒后不进行增殖的B细 胞,经激活可再次增生。以上结果证实了体外早 期感染EBV后末梢血B细胞后有静息B细胞存在。
现在国内外关于EB病毒及相关基因与各种 疾病关系的研究较多[8],但是体内环境下研究EB 病毒的感染、增殖、潜伏、激活及致病的机制 较少。关于体内储存EB病毒的静息B细胞的模型 制备,目前尚未见报道。本实验利用NeoR EBV 对CD5+B细胞进行感染,成功构建EBV阳性的 CD5+B/EBV细胞模型。此细胞EBV潜伏感染的基 因表型EBER1、EBNA2、LMP1表达为阳性,免 疫表型CD20、CD80、CD38和CD86表达增强, 表现出LCL型的EBV潜伏感染的基因表型和免疫 表型,但是LCL诱导的活性指标CD23等却没有 表达。因此,本实验建立的CD5+B/EBV细胞具有 LCL表型,但没有诱导出活性指标等特点,具有 机体内EBV潜伏感染静息期B细胞的一般特征[9], 所以期待此细胞可成为体内EBV潜伏感染研究上 的良好材料。
| [1] | Price AM,Tourigny JP,Forte E,et al. Analysis of Epstein-Barr virusregulated host gene expression changes through primary B-cell outgrowth reveals delayed kinetics of latent membrane protein 1- med ia ted NF-κB activation[J].J Virol,2012,86(20):11096-106. |
| [2] | Rasul AE, Nagy N, Sohlberg E, et al. Simultaneous detection of the two main proliferation driving EBV encoded proteins, EBNA-2 and LMP-1 in single B cells[J]. J Immunol Methods, 2012,385(1-2):60-70. |
| [3] | Leonard S, Wei W, Anderton J, et al. Epigenetic and transcriptional changes which follow Epstein-Barr virus infection of germinal center B cells and their relevance to the pathogenesis of Hodgkin’s lymphoma[J]. J Virol, 2011,85(18):9568-77. |
| [4] | Kalla M, Hammerschmidt W. Human B cells on their route to latent infection--early but transient expression of lytic genes of Epstein-Barr virus[J]. Eur J Cell Biol, 2012 ,91(1):65-9. |
| [5] | Jin ZS,An JD,Song HL,et al. EB virus latent infection of mantle cell lymphoma model[J]. Zhongguo Zhong Liu Lin Chuang,2012,39 (1):1-4. [金在顺,安锦丹,宋华林,等. EB病毒潜伏感染的套细胞淋巴瘤模型研究[J]. 中国肿瘤临床, 2012,39 (1):1-4.] |
| [6] | Gregorovic G, Bosshard R, Karstegl CE, et al. Cellular gene expression that correlates with EBER expression in EpsteinBarr Virus-infected lymphoblastoid cell lines[J]. J Virol, 2011,85(7):3535-45. |
| [7] | Hayashi K, Jin Z, Onoda S,et al. Rabbit model for human EBV-associated hemophagocytic syndrome (HPS): sequential autopsy analysis and characterization of IL-2 dependent cell lines established from herpesvirus papio-induced fatal rabbit lymphoproliferative diseases with HPS[J]. Am J Pathol, 2003,162 (5):1721-36. |
| [8] | Iwakiri D, Takada K. Role of EBERs in the pathogenesis of EBV infection [J]. Adv Cancer Res, 2010,107:119-36. |
| [9] | Halder S, Murakami M, Verma SC, et al. Early events associated with infection of Epstein-Barr virus infection of primary B-cells[J]. PLoS One,2009, 4(9):e7214. |
 2014, Vol.41
2014, Vol.41