2.中国人民解放军总医院消化科;
3.吉林医药学院临床血液检验教研室
2.Department of Gastroenterology, General Hospital of The Chinese People ‘s Liberation Army;
3.Department of Hematology Inspection,Jinlin Medical College
肺腺癌是一种死亡率很高的恶性肿瘤疾病, 具有发生早期转移的生物学特点,临床确诊时患者往往处于中晚期,约60%~80%的患者已发生纵隔 淋巴结和(或)远处转移而失去手术治疗的机会[1]。 因此,化疗是肺腺癌治疗的重要手段,尤其是 在肺腺癌综合治疗中发挥重要作用[2]。多西他赛 (Docetaxe1,DTX)是近年来应用于临床的一种有效 的化疗药物,其特点是以微血管为作用靶点,使其 在化疗失败的晚期或转移性肺腺癌的治疗性中极 具应用前景[3]。然而与其他化疗药物一样,在临床 应用过程中多数患者经多西他赛化疗缓解后,即 会产生耐药性而使后续治疗效果受到严重影响。本实验以多西他赛为诱导药物,人肺腺癌细胞株 A549为诱导对象,采用逐步增加剂量、间歇体外 诱导的方法,建立稳定的人肺腺癌多西他赛耐药 细胞株,并对肺癌细胞产生多西他赛耐药性的机 制进行初步探讨,为耐药逆转研究提供实验依据。 1 材料与方法 1.1 试剂
多西他赛为江苏奥赛康药业有限公司生产, RPMI 1640培养液购自美国Gibco公司,新生牛血 清为杭州四季青公司产品,MTT、二甲基亚砜购 自美国Sigma公司,Bcl-2、Bax单抗及辣根过氧化 物酶标记的二抗均为美国Santa Cruz公司产品、碘 化丙啶购自美国Pharmingen公司。 1.2 方法 1.2.1 细胞培养
人肺腺癌A549细胞株由吉林医 药学院细胞室保存,培养于含10%灭活新生牛血 清的RPMI 1640培养液中,置于37℃、5%CO2的培 养箱中培养,0.25%胰蛋白酶液消化传代,3~4天 传代一次,并取对数生长期细胞进行实验。A549/ DTX细胞为本实验室以小剂量多西他赛逐步、间 歇诱导方式建立的耐药细胞株,稳定生长于含50 μg/L多西他赛的培养液中。 1.2.2 耐药细胞的诱导
采用逐渐增加浓度、间 歇诱导的方法建立人肺癌A549/DTX多西他赛耐药 株。首先以0.5 μg/L终浓度的DTX作用于A549细胞 24 h,换液去除死细胞之后,脱药常规培养两周, 然后将生长状态良好的A549细胞更换为新的较高 浓度的DTX进行浓度逐步递增性诱导。重复以上 诱导传代过程,直到耐药株稳定生长于DTX终浓 度达50 μg/L的培养液中并常规传代,将该耐药细 胞株命名为A549/DTX。诱导过程中,双目倒置显 微镜下观察各时段细胞的生长情况。 1.2.3 MTT法检测耐药性
将对数生长期的A549 及A549/DTX细胞调整至浓度为3×105/ml后,接种 于96孔平底培养板,每孔100 μl。待细胞贴壁后 分别加入终浓度为6.25、12.5、25、50、100、200 μg/L的DTX 100 μl,每一浓度均设4个复孔,同时 设有对照孔和调零孔,各孔总体积均为200 μl, 于加药24 h后采用MTT比色法检测DTX对A549及 A549/DTX细胞生长的抑制作用。酶联免疫检测仪 在570 nm波长下测各孔的吸光度(A)值,并计算每 种浓度的多西他赛对A549及A549/DTX细胞的平均 抑制率。以药物浓度为横轴,抑制率为纵轴,绘制 浓度效应曲线,确定半数抑制(IC50)浓度,并依据 公式计算A549/DTX细胞多西他赛耐药指数(RI), 公式为RI=耐药细胞IC50/亲本细胞IC50。 1.2.4 流式细胞术测定凋亡
收获对数生长期A549 及A549/DTX细胞,接种于不同培养瓶中,细胞贴 壁后分别加入终浓度为12.5、25、50 μg/L的DTX, 并设置培养液组为对照组。24 h后收集上述各浓度 组A549及A549/DTX细胞,制备流式细胞术(FCM) 样品,测定细胞凋亡率。将细胞用PBS洗涤后调整 浓度为1×106/ml,碘化丙啶染色,应用流式细胞仪 EPICS XL(美国Beckman Coulter公司)检测DNA 含量,将亚G1期峰的细胞计为凋亡细胞,并由此计 算各浓度组A549及A549/DTX细胞凋亡率。 1.2.5 蛋白质印迹分析
收获对数生长期A549及 A549/DTX细胞,加入细胞裂解液,冰浴1 h,离心 后吸取上清液,考马斯亮蓝定量检测各组胞质总蛋 白。检测后,将样品调成相同浓度。经SDS-PAGE 电泳后转移至醋酸纤维薄膜,牛血清蛋白37℃封闭 2 h,分别加入Bax、Bcl-2鼠抗人单克隆抗体,4℃ 过夜,再加入HRP标记的二抗37℃放置2 h,DAB显 色试剂盒显色,拍照记录。以β-actin为内参照,采 用凝胶成像系统测定各条带积分吸光度值。 1.3 统计学方法
实验数据以均数±标准差(x±s)表示,采用 SPSS 11.0软件进行相关统计学分析。数据中组间的 比较采用方差分析,两两比较采用q检验。检验水 准α=0.05,以P<0.05为差异有统计学意义。 2 结果 2.1 MTT法检测细胞耐药特性结果
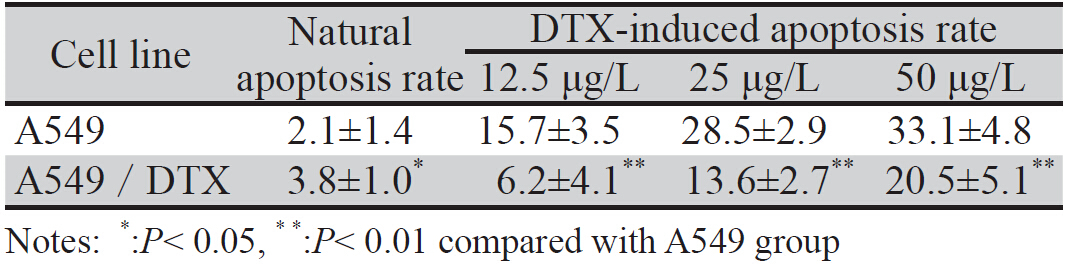
多西他赛对A549及A549/DTX细胞均具有明显的 生长抑制作用,表现为低浓度抑制细胞能力较小,随 着浓度的增加对细胞的抑制率呈上升趋势,在测定浓 度范围内具有明显的剂量依赖性,见图 1。根据浓度效 应曲线,确定DTX作用24 h后A549及A549/DTX的IC50 分别为14.9和275.7 μg/L,耐药指数RI为18.5,与亲本 细胞A549相比,A549/DTX表现出较高的耐药性。
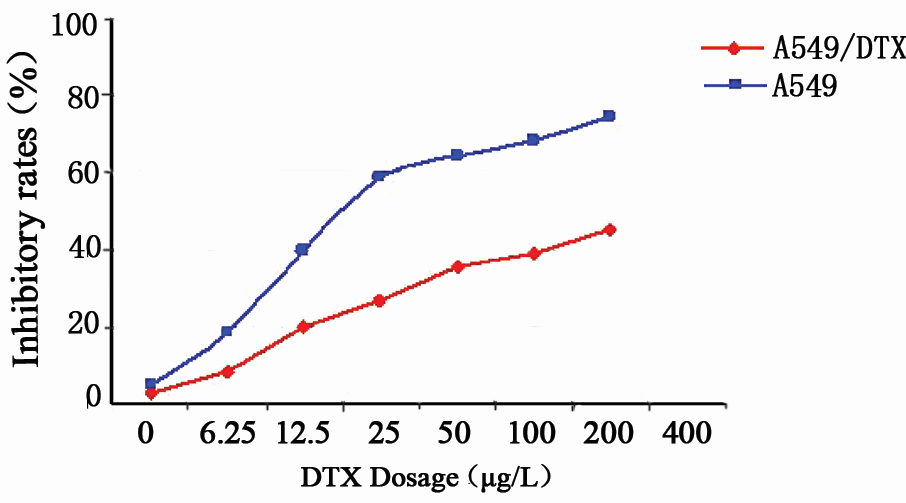 |
图 1 不同浓度多西他赛对A549、A549/DTX细胞的生长抑 制作用 Figure 1 Inhibitory effect of different concentrations of DTX on A549 and A549/DTX cells |
光学显微镜下A549细胞均贴壁生长,呈长梭形或 多角形,排列较为均匀紧密。耐药诱导过程中,细胞形 态会发生一些改变。加入DTX 24 h后,细胞胞体变圆 变小,敏感细胞不断死亡,需数次换液不断清除死细 胞,最后仅存少数贴壁细胞。存活细胞的胞体变大, 胞内空泡增多,并且细胞生长变缓慢,会出现一些崩 解死亡的细胞。撤药14 d左右时,存活下来的细胞可恢 复成团生长。诱导建立的A549/DTX细胞与A549细胞形 态并无明显差别,仅表现为胞体积略增大,细胞边界 模糊,呈较大的菱形和三角形,细胞排列较为松散,见 图 2。
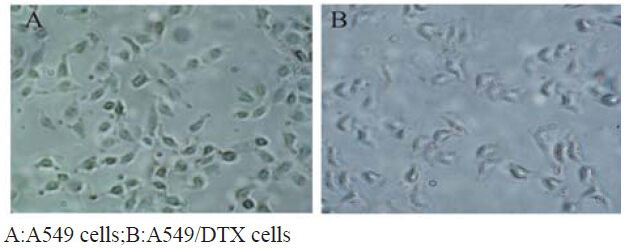 |
图 2 光学显微镜观察A549、A549/DTX细胞形态 Figure 2 Cell morphological observation of A549 and A549/DTX under microscope |
终浓度为12.5、25、50 μg/L的DTX作用24 h后,收 集各浓度组A549及A549/DTX细胞,流式细胞术测定凋亡率。与A549细胞相比,A549/DTX细胞的自然凋亡率 升高,并且差异具有统计学意义(P<0.05)。与不同浓 度多西他赛作用24 h后,A549及A549/DTX细胞凋亡率 在测定浓度范围内均随多西他赛浓度升高相应增加。但 是对于同一浓度的多西他赛,A549/DTX细胞的凋亡率 均明显低于A549细胞,两者相比差异有统计学意义(P<0.01),见表1。
|
|
表1 多西他赛对A549及A549/DTX细胞凋亡影响的比较(%) Table 1 Comparison of the effect of docetaxel on apoptosis of A549 and A549/DTX (%) |
两种细胞株均出现Bax、Bcl-2蛋白阳性条带。 其中Bcl-2蛋白条带在建立的A549/DTX细胞株比在 A549细胞株中深、宽;而Bax蛋白在A549/DTX细胞 株中蛋白条带较A549细胞变浅、变细。并且A549及 A549/DTX细胞Bcl-2蛋白表达量均随药物浓度升高而 降低,Bax蛋白表达量随浓度升高而增加,见图 3。以 β-actin作为内参照,采用图像分析系统对条带进行定 量分析,进一步证实:A549/DTX细胞Bcl-2蛋白表达 增加,Bax蛋白表达减少,且均与A549细胞有明显差 异(P<0.01),见图 4。
 |
图 3 Western blot分析Bax、Bcl-2蛋白表达 Figure 3 Bax,Bcl-2 protein expression analyzed by Western blot |
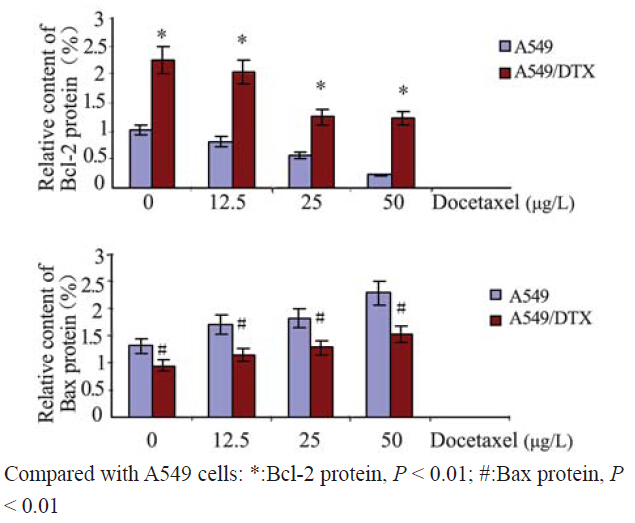 |
图 4 Western blot定量检测分析Bax、Bcl-2蛋白表达 Figure 4 Bax,Bcl-2 protein expression analyzed quantitatively by Western blot |
多西他赛是肺癌尤其是肺腺癌治疗的重要一线和二线用药,然而化疗药物普遍存在的耐药现 象限制了此类药物的疗效和更广泛的临床应用, 所以肿瘤耐药机制研究及耐药逆转,已成为肿瘤 研究领域的一大热点。耐药及逆转研究,通常采 用体外药物诱导的方法建立耐药细胞模型。在长 期诱导过程中,敏感细胞被化疗药物杀死,残留 下来的细胞得以扩增,这些细胞在形态和生物学 行为上可能发生某些改变,成为耐药细胞株。本 研究通过小剂量多西他赛逐步、间歇诱导方式建 成A549/DTX细胞株,对多西他赛明显耐药。与亲 本细胞A549相比,A549/DTX细胞多西他赛的耐 药指数达到18.5,并且能稳定生长传代,表明建立 A549/DTX细胞株可进一步用于多西他赛耐药细胞 的相关研究。
诱导凋亡是化疗药物抗肿瘤的作用机制之一。 多西他赛能够阻碍肿瘤细胞有丝分裂中期向后期 转化,使细胞周期阻滞于G2/M 期,以及能够提高 线粒体膜通透性,引起促凋亡活性物质释放,导 致肿瘤细胞凋亡,发挥抗瘤作用[4]。本研究将多西 他赛分别作用于A549细胞及A549/DTX细胞,流式 结果显示两种细胞株的凋亡率均随药物浓度的升 高而增加,但对于同一浓度多西他赛,A549/DTX细胞的凋亡率均明显低于A549细胞(P<0.01)。 该结果表明诱导凋亡是多西他赛抑制肺腺癌细胞 增殖的作用机制之一,更为重要的是提示凋亡抵 抗可能与A549/DTX细胞株耐药产生密切相关。
相关实验及临床研究表明,凋亡抵抗是肿瘤细 胞对化疗药物产生耐药性的重要机制,抗凋亡基 因bcl-2异常表达是耐药形成的因素之一[5]。bax基 因是bcl-2基因家族中成员,拮抗bcl-2的抗凋亡效 应,促进细胞凋亡。bcl-2和bax是位于同一基因家 族中,作用机制不同的一对基因,它们表达的变 化,尤其是两者比值的变化可影响化疗药物的效 果,在临床耐药形成过程中扮演了重要的角色。 体内、体外研究实验中均有证实:bcl-2表达增高 或bax表达降低,与多种肿瘤细胞的耐药性密切相 关[6]。在bcl-2对人小细胞肺癌细胞H446/DDP多药 耐药性影响的研究中,通过真核转染下调肺癌细 胞bcl-2基因的表达,能增强H446/DDP对顺铂的敏 感度,促进顺铂诱导的凋亡[7]。 同样在非小细胞肺 癌细胞的小鼠移植瘤实验中,将长春瑞滨与bcl-2 反义核苷酸联合作用植瘤小鼠后,对肿瘤的抑制 作用明显强于单独使用长春瑞滨[8]。与bcl-2作用 相反,bax表达降低可使药物诱导的细胞凋亡受到 不同程度的抑制,进而导致肿瘤细胞产生耐药。 所以,检测肿瘤细胞或肿瘤组织中bcl-2和bax的表 达对于耐药机制研究具有重要的意义,已成为该 领域关注的热点。bcl-2和bax基因产物Bcl-2蛋白和 Bax蛋白分别是Bcl-2家族中的抗凋亡和促凋亡蛋 白[9]。Bax结合于线粒体膜上,使线粒体跨膜电位 下降,促进细胞色素c释放,从而激活凋亡通路; Bcl-2主要通过与Bax形成异二聚体及抑制Bax向线 粒体的移位,阻碍Bax的功能。Bcl-2表达下调可以 导致细胞凋亡,Bcl-2高表达可抑制细胞凋亡,且 Bcl-2/Bax 比值决定了细胞对凋亡的敏感度[10]。
为明确A549/DTX细胞抗凋亡现象的分子机 制,我们对两种细胞株的凋亡调控因子Bcl-2和Bax 的表达进行了检测。经Western blot分析发现,Bcl-2 蛋白在多西他赛耐药细胞株A549/DTX中的表达, 较亲本A549细胞明显升高,而Bax蛋白表达明显降 低,说明在诱导建立A549/DTX细胞的过程中,肿 瘤细胞可能通过上调Bcl-2表达及下调Bax表达,抵 抗化疗药物形成耐药。为进一步验证结论,将两种 细胞株分别与不同浓度多西他赛作用,结果发现 A549/DTX细胞株中存在Bcl-2蛋白表达增加及Bax 蛋白表达减少,均与亲本A549细胞有明显差异,进 一步表明耐药肿瘤细胞株通过启动bcl-2基因及下调 bax基因,阻断细胞凋亡通路,抑制药物诱导的细 胞凋亡,降低细胞对化疗药物的敏感度。
本研究建立肺腺癌多西他赛耐药细胞株A549/ DTX,并初步阐明Bcl-2、Bax凋亡相关蛋白的表 达可能参与其耐药机制,从抗凋亡的角度解释耐 药现象,这不同于经典的耐药机制,为研究细胞 耐药提供了一个新思路。已有实验证明将敏感细 胞与耐药细胞进行mRNA差异筛选,筛选出bcl-2 基因,并将bcl-2称为“耐药基因”[11]。可见,Bcl-2 作为凋亡抑制蛋白在肿瘤细胞耐药中也起着不可 低估的作用。因此我们考虑在多西他赛耐药逆转 研究中,Bcl-2是否可作为耐药逆转靶分子?总 之,伴随研究的逐步深入,必将有助于提高和改 善多西他赛的临床疗效,为延长肺腺癌患者生存 期、提高生存质量提供有效的手段。
| [1] | Lv PT,Xiao J,Zhou K,et al.Mechanism research on the reversion of multidrug resistance in lung carcinoma cells A549 treated by coix lacryma-Jobi injection[J]. Zhongguo Quan Ke Yi Xue,2010,13(26):2956-8.[吕品田,萧娟,周坤,等.薏苡仁注射液对肺腺癌细胞多药耐药性逆转作用的机制研究[J].中国全科医 学,2010,13(26):2956-8.] |
| [2] | Chen LB.Research on the mechanisms of docetaxel-resistant human lung adenocarcinoma[J].Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi,2012,19(5):467-71.[陈龙邦.人肺腺癌多西他赛耐药机制的研究[J].中国肿瘤生物治疗杂 志,2012,19(5):467-71.] |
| [3] | Tsavaris N,Kosmas C,Skopelitis E,et al.A phaseⅡstudy of the docetaxel-carboplatin chemotherapy regimen in advanced nonsmall-cell lung cancer[J].Lung,2005,183(6):405-16. |
| [4] | Sun H,Geng J, Chen LB. Research development on drug-resistance mechanism of taxanes[J]. J Med Postgrad,2007,20(3):315-8,323. [孙海,耿建,陈龙邦.紫杉类药物耐药机制的研究进展[J].医学研究生学报,2007,20(3):315-8,323.] |
| [5] | Zhang N,Xiong YY,Li L. The relationship between expression of survivin, bcl-2, bax and multidrug resistance gene in non-small cell lung cancer[J].Zhong Liu Fang Zhi Yan Jiu,2006,33(3):168-70.[ 张娜,熊永炎,李莉.非小细胞肺癌中 survivin、bcl-2和bax蛋白与多药耐药基因的表达及其相关性[J].肿瘤防治研究,2006,33(3):168-70.] |
| [6] | Del Bufalo D, Biroccio A, Trisciuoglio D, et al.Bcl-2 has differing effects on the sensitivity of breast cancer cells depending on the antineoplastic drug used[J].Eur J Cancer,2002,38(18):2455-62. |
| [7] | Ji FY, Qian GS, Qian P, et al. Involvement of bcl-2 in multidrug resistance in human small cell lung cancer cell subline H446/ DDP[J]. Zhonghua Jie He He Hu Xi Za Zhi,2006,29(3):156-60. [戢福云,钱桂生,钱频,等.Bcl-2对人小细胞肺癌细胞系H446/DDP多药耐药性的影响[J].中华结核和呼吸杂志,2006,29(3):156-60.] |
| [8] | Hu Y,Bebb G,Tan S,et al.Antitumor efficacy of oblimersen Bcl-2 antisense oligonucleotide alone and in combination with vinorelbine in xenograft models of human non-small cell lung cancer[J]. Clin Cancer Res,2004,10(22):7662-70. |
| [9] | Ghobrial IM,Witzig TE,Adjei AA.Targeting apoptosis pathways in cancer therapy[J]. CA Cancer J Clin,2005,55(3):178-94. |
| [10] | Jendrossek V.The intrinsic apoptosis pathways as a target in anticancer therapy[J].Curr Pharm Biotechnol,2012,13(8)1426-38. |
| [11] | Sotiropoulou PA,Candi A,MascréG,et al.Bcl-2 and accelerated DNA repair mediates resistance of hair follicle bulge stem cells to DNA-damage-induced cell death[J].Nat Cell Biol,2010,12(6):572-82. |
 2014, Vol.41
2014, Vol.41