2.中国医科大学附属第一医院耳鼻喉科
2.Department of E.N.T., The First Hospital Affiliated to China Medical University
肺癌是发病率和死亡率增长最快、对人类健 康和生命威胁最大的恶性肿瘤。目前,由于其具 体发病机制不十分清楚,以手术、化疗、放疗为 主的综合治疗手段不能达到理想效果,肺癌的预 后仍较差[1]。因此,探讨肺癌的发病机制,找到治 疗药物的靶位点十分迫切。
细胞凋亡是由于细胞内外环境变化或死亡信 号激发以及在基因调控下所引起细胞主动死亡的 过程,其发生原因和途径复杂多样,许多基因参 与细胞凋亡的基因调控,包括致死基因和存活基 因。其中Bcl-2家族成员在细胞凋亡的基因调控过 程中起着至关重要的作用。Bcl-2家族可以分为两 类:一类是抗细胞凋亡基因,代表基因是Bcl-2基 因;另一类是促细胞凋亡基因,代表基因是BAX 基因,他们通过激活一系列下游基因发挥调节凋 亡作用。本研究旨在探讨BAX基因转染对肺癌 A549细胞的凋亡及化疗敏感度的影响,为提高肺 癌的化学治疗效果、补充手术和放疗的不足奠定 理论基础。1 材料与方法 1.1 细胞系及培养条件
人肺癌A549细胞系购自中科院上海细胞库。 A549细胞株在含10%胎牛血清的DMEM培养液 中,于37 ℃、饱和湿度、5% CO2条件下培养。细胞呈贴壁生长,接种细胞24 h进入对数生长期后开 始后续实验。1.2 主要试剂
顺铂(Cisplatin,DDP)购自山东齐鲁 制药厂,碘化丙啶(PI)和AnnexinV-FITC购 自美国Sigma公司。总RNA抽提试剂TRIzol和 Lipofectamine 2000转染试剂购自美国Invitrogen 公司。RT-PCR试剂盒为日本TaKaRa公司产品。 pcDNA3.1-BAX表达质粒由英国玛丽皇后学院惠 赠。1.3 Cell counting kit 8(CCK8)法检测DDP对A549细胞增殖的影响
CCK-8是基于WST8的广泛应用于细胞增殖 和细胞毒性的快速高敏感度检测方法,WST8是 MTT的一种升级替代产品,比MTT的结果更加稳 定,并且其线性范围更宽,敏感度更高。本研究 以每孔1×104细胞接种于96孔培养板中,培养24h 后,分别加入含不同浓度DDP的DMEM培养液, 使DDP的终浓度为0.5、1、2、4、8和16 μg/ml。 同时设阴性对照组和空白对照组,阴性对照组不 加顺铂只加培养液,空白对照组不加细胞只加培 养液。每组3个复孔,培养48h后,每孔加入20 μl CCK-8溶液,在培养箱内继续孵育1.5 h后用酶标 仪检测吸光度值,检测波长为450 nm,测量每孔 吸光度值。细胞增殖抑制率(%)=[1-(OD实验组- OD空白对照组)/(OD阴性对照组-OD空白对照组)] ×100%。1.4 细胞转染
以每孔5×106个细胞将对数生长期的肺癌细胞 A549转种于6孔培养板中,37℃、5%CO2环境中 培养24 h,细胞长至80%融合。实验分为三组: 空白对照组,pcDNA3.1空载体组和A549/BAX 转染组。转染前3~4 h换2 ml无血清DMEM培养 液培养。在无菌1.5 ml试管中制备下述溶液:溶 液A:将5 μl pcDNA3.1-BAX质粒溶于250 μl无血 清DMEM培养液中,轻微摇晃混匀5 min;溶液 B:将10 μl Lipofectamine 2000移至250 μl无血清 DMEM培养液中,轻微摇晃混匀5 min;溶液C: 合并溶液A和溶液B,轻轻混匀,室温下孵育20 min。弃去细胞培养液,用无血清DMEM培养液 洗涤细胞两次,备转染用。将溶液C加入含肺癌 细胞的六孔板中,前后轻微摇晃培养板,同时用 pcDNA3.1空质粒做阴性对照。37 ℃、5% CO2环境 中培养5~6 h后,更换为10%胎牛血清的DMEM培 养液继续培养,然后换用含G418的培养液进行筛 选,2周后从稳定表达的细胞克隆中挑选出多个单 克隆继续培养,将pcDNA3.1和BAX-pcDNA3.1转 染的细胞分别命名为A549/pcDNA3.1和A549/BAX, 并通过RT-PCR检测BAX基因的mRNA表达水平。1.5 半定量RT-PCR法检测转染结果
采用TRIzol试剂按照说明书操作提取总 RNA。通过甲醛聚丙烯酰胺凝胶电泳检测RNA 质量,通过检测OD260nm/280nm计算RNA浓度。以 1 μg总RNA为模板通过反转录系统合成cDNA 第一链。应用Primer5.0设计BAX引物,上游引 物:5′-CTGAGCAGATCATGAAGACA-3′,下游 引物:5′-AAAGATGGTCACGGTCTG-3′,扩增 长度为482 bp。β-actin为内参照,上游引物为: 5′-CACCAACTGGGACGACAT-3′,下游引物为: 5′-ACAGCCTGGATAGCAACG-3′,扩增长度为189 bp。PCR反应条件为:95 ℃4 min后,95℃45 s,59℃ 45 s,72℃60 s,共32个循环,再72℃延伸7 min。 RT-PCR产物通过2%琼脂糖凝胶电泳进行检测。采 用Fluor-S MultiImager(Bio-Rad公司,California, USA)系统成像并通过Multi-Analyst(Bio-Rad公 司,California,USA)软件进行灰度值分析。数据 经β-actin进行校正后加以分析。1.6 细胞周期分析
常规胰酶消化并收集细胞(1 000 r/min, 4℃,离心5 min),PBS漂洗3次,每次5 min, 冰乙醇固定,400 μl 0.05 g/L碘化丙啶(PI)室温 避光染色30 min后进行流式细胞仪(FACScan, Becton Dickinson)检测,采用Cell Quest软件对 细胞周期进行分析。以增殖指数(Proliferation index,PI)表示A549细胞的增殖水平, PI(%)=(S+G2/M)/(S+G2/M+G1)100%。1.7 细胞凋亡分析
将A549、A549/pcDNA3.1和A549/BAX细胞按 每孔1×106细胞接种于24孔培养板过夜培养,第2 天加入4 μg/ml DDP常规培养72 h,按说明书加入 FITC和PI双染色,流式细胞仪检测细胞凋亡情况。1.8 统计学方法
通过SPSS 13.0对数据进行分析,结果采用均 数±标准差(x±s)表示,多样本均数差别的多重 比较采用单因素方差分析,SNK-q检验,P<0.05为 具有统计学意义。2 结果 2.1 CCK8法筛选合适的DDP作用浓度
不同浓度DDP作用A549细胞48 h后,各实验组 DDP对A549细胞的均有抑制作用。随着药物浓度 增高抑制率显著提高,其中4 μg/ml组的抑制率近 似于50%,后续实验浓度将采用4 μg/ml,见表1 。
|
|
表1 不同浓度DDP作用A549细胞后CCK8结果 Table 1 CCK8 results after A549 cells treated with different concentrations of DDPa |
RT-PCR检测结果显示,A549/BAX表达质粒 转染组BAX基因的表达较空白对照组和pcDNA3.1 空载体组明显上调,见图 1。
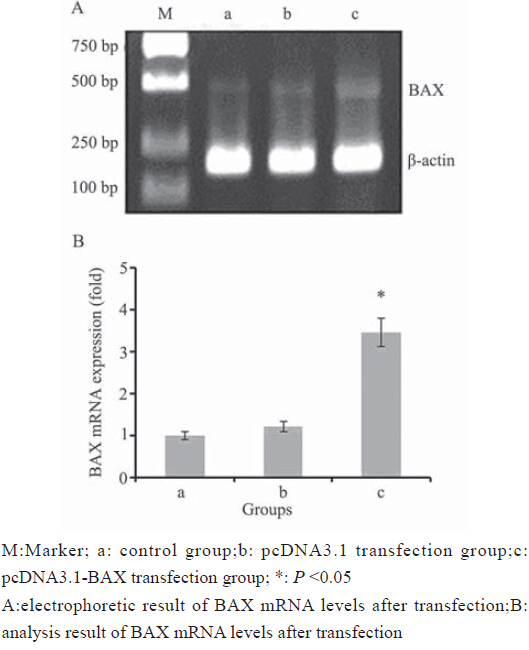 |
图 1 BAX基因转染效果的检测 Figure 1 Transfection effect on BAX detected by RT-PCR |
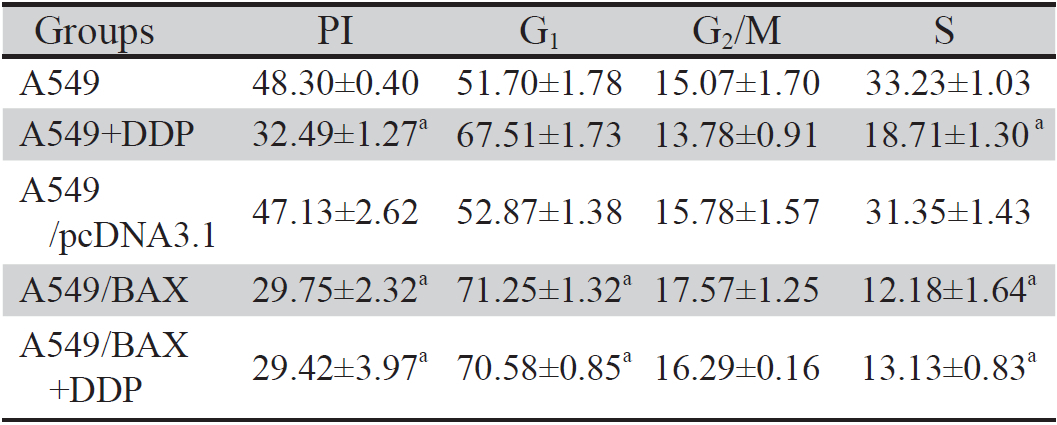
细胞经PI染色后通过流式细胞术检测细胞 周期,结果显示:A549+DDP组、A549/BAX和 A549/BAX+DDP组细胞增殖指数(PI)明显降 低,分别为32.49%、29.75%和29.42%。A549和 A549/pcDNA3.1组S期细胞百分比分别为33.23%和 31.35%,而A549+DDP 组(18.71%)、A549/BAX 组(12.18%)和A549/BAX+DDP组(13.13%), 与A549和A549/pcDNA3.1两组比较均有所减少, 差异有统计学意义(P<0.05)。转染BAX组及 DDP联合BAX转染组G1期细胞明显增加,由对照 组的51.70%增加到71.25%和70.58%,提示细胞发 生G1期阻滞。该研究结果表明BAX基因和DDP均 可以明显降低细胞增殖率,同时转染BAX基因联 合DDP可以进一步抑制细胞的增殖,见表2 。
|
|
表 2 过表达BAX和DDP处理后A549细胞周期分析(x±s,%,n=3) Table 2 A549 cell cycle profiles with BAX overexpression and 4 μg/mL DDP treatment (x±s,%,n=3) |
与A549组相比,A549/BAX组A549细胞系凋 亡率明显增高,细胞凋亡率由A549组的1.87%、 A549/pcDNA3.1组2.26%、A549/BAX组的7.73%和 A549+DDP组的10.43%增加到A549/BAX+DDP组 的21.14%,差异有统计学意义(P<0.05)。该研 究结果表明转染BAX基因和DDP均可以明显增加 A549细胞的凋亡率,同时转染BAX基因联合DDP 可以进一步增加A549的凋亡率,见图 2。
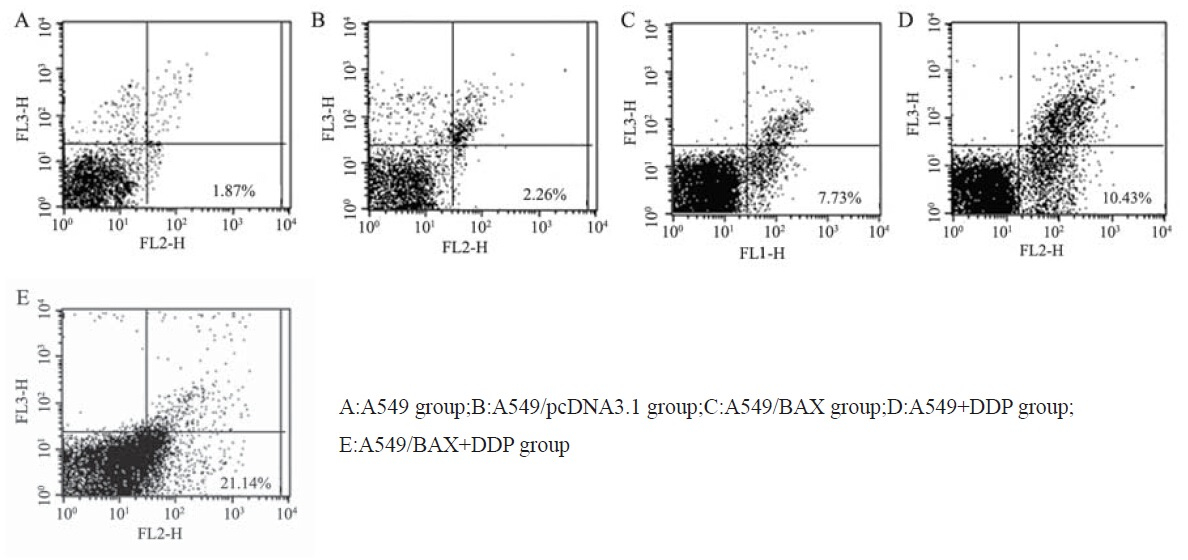 |
图 2 BAX基因转染效果的检测 Figure 2 Transfection effect on BAX detected by RT-PCR |
细胞凋亡是基因控制的细胞死亡,参与胚胎 发育、神经系统完善和免疫系统调节等多种生理 过程,多种疾病的发生和凋亡异常有关[2]。细胞凋 亡的重要途径之一是Bcl-2家族蛋白-线粒体途径, Bcl-2基因家族的表达和调控在细胞凋亡信号转导 途径中发挥重要作用[3]。该基因家族通过这个复杂 的调控网络控制细胞凋亡以及肿瘤细胞对化疗药 物的敏感度[4]。在Bcl-2基因家族中包括抑制凋亡 的成员如Bcl-2和Bcl-X等,还有促进凋亡的成员如 BAX和BAK等。Bcl-2家族中促凋亡蛋白和抑凋亡 蛋白的比例是决定细胞凋亡发生与否和凋亡作用 强弱的关键因素。促凋亡蛋白在细胞中的比例还 决定细胞对死亡信号的反应及细胞的命运。有研 究表明,BAX表达降低与肿瘤细胞对化疗的敏感 度差和肿瘤患者生存期短有关[5]。BAX与Bcl-2比 例可以作为预测口腔鳞癌预后的生物标记。BAX 基因在胃癌[6]、肝癌[7]等肿瘤组织中表达明显下 调。BAX基因突变与转移的乳腺癌化疗疗效降低 和生存期缩短相关[8]。
顺铂是治疗肺癌最常用的化疗药物之一。该 药物为金属铂类络合物,具有广谱抗瘤、对厌氧 细胞有效的特点。在细胞内,DDP先将分子中的 氯解力,然后与DNA上的鸟嘌呤、腺嘌呤和胞嘧 啶形成交叉联结,也可形成双链间的交叉联结,从而抑制DNA复制过程。同时损伤细胞膜上结 构,肿瘤细胞由于增值较快,对DDP的细胞毒作 用较正常细胞更为敏感,但长期使用会产生很大 不良反应,严重影响患者的生存质量。在本实验 中采用CCK8法检测各浓度DDP对肺癌A549细胞 的增殖抑制率,其中4 μg/ml最接近半数抑制量。 流式细胞仪检测结果提示DDP作用于细胞G1期和 S期,使细胞产生G1周期阻滞,并能使细胞凋亡, 从而导致细胞增殖减慢。在肺癌A549细胞中转染 BAX基因后,BAX表达增高,细胞凋亡比例增 加,证明高表达BAX可以诱发细胞凋亡,A549细 胞中G1期增多,S期细胞减少,提示肺癌细胞在进 入有丝分裂前不能进行DNA合成,使完成有丝分 裂过程的肿瘤细胞不断减少,进而使肿瘤细胞的 增殖受到抑制。而且与DDP联合应用后还能继续 增加细胞凋亡的比例,说明细胞中促凋亡蛋白在 与抑凋亡蛋白的比例中占优势,导致线粒体对各 种刺激的抵抗能力下降,从而使细胞色素C更容 易释放而导致后续凋亡级联反应[9]。最终体现为 A549细胞对DDP化疗敏感性增高。当然,本研究 中仅检测了DDP处理A549细胞48小时后的细胞生 长曲线,不能完全说明细胞的生长特性,当药物 浓度或细胞浓度改变是否仍然能达到增加化疗敏 感度的作用需要更多地后续实验验证。
BAX 高表达可增加肿瘤对化疗药物如吉西他 滨、5-Fu 以及放射治疗的敏感度,提高其基因表 达、上调BAX活性等针对BAX 的靶向治疗已显示 出促进白血病细胞凋亡、增强药物抗癌效应的作 用[10]。此外BAX作为一个重要的促凋亡因子,已 成为研究及评价各种抗癌药物作用机制与疗效的 标准之一。当然还有很多问题需要进一步研究, 如BAX在肺癌中高表达的机制,BAX与肺癌侵袭 转移的关系等等。深入研究BAX与肺癌之间的关 系,有助于肺癌的临床诊断、提高治疗效果和判 断预后。
| [1] | Long H, Lin ZC, Lin YB, et al. Quality of life after lobectomy for early stage non-small cell lung cancer--video-assisted thoracoscopic surgery versus minimal incision thoracotomy[J]. Ai Zheng,2007,26(6):624-8. [龙浩,林志潮,林勇斌,等.早期非小细胞肺癌胸腔镜手术与小切口肺切除术后患者生活质量的对比研究[J]. 癌症, 2007,26(6):624-8.]. |
| [2] | Ouyang L, Shi Z, Zhao S, et al. Programmed cell death pathways in cancer: a review of apoptosis, autophagy and programmed necrosis[J]. Cell Prolif,2012,45(6):487-98. |
| [3] | Galluzzi L, Kepp O, Trojel-Hansen C, et al. Mitochondrial control of cellular life, stress, and death[J]. Circ Res,2012,111(9):1198-207. |
| [4] | Benard G, Bellance N, Jose C, et al. Multi-site control and regulation of mitochondrial energy production[J]. Biochim Biophys Acta,2010,1797(6-7):698-709. |
| [5] | Singh S, Chhipa RR, Vijayakumar MV, et al. DNA damaging drugs-induced down-regulation of Bcl-2 is essential for induction of apoptosis in high-risk HPV-positive A549 and KB cells[J]. Cancer Lett,2006,236(2):213-21. |
| [6] | Anaqnostopoulos GK, Stefanou D, Arkoumani E, et al. Expression of Bax protein in gastric carcinomas. A clinicopathological and immunohistochemical study[J]. Acta Gastroenterol Belg,2007,70(3):285-9. |
| [7] | Yu JQ, Bao W, Lei JC. Emodin regulates apoptotic pathway in human liver cancer cells[J]. Phytother Res,2013,27(2):251-7. |
| [8] | Kolacinska A, Fendler W, Szemraj J, et al. Gene expression and pathologic response to neoadjuvant chemotherapy in breast cancer[J]. Mol Biol Rep,2012,39(7):7435-41. |
| [9] | Lalier L, Cartron PF, Juin P, et al. Bax activation and mitochondrial insertion during apoptosis[J]. Apoptosis,2007,12(5):887-96. |
| [10] | Del Poeta G, Bruno A, Del Principe MI,et al. Deregulation of the mitochondrial apoptotic machinery and development of molecular targeted drugs in acute myeloid leukemia[J]. Curr Cancer Drug Targets,2008,8(3):207-22. |
 2014, Vol.41
2014, Vol.41